💥💥💞💞欢迎来到本博客❤️❤️💥💥
🏆博主优势:🌞🌞🌞博客内容尽量做到思维缜密,逻辑清晰,为了方便读者。
⛳️座右铭:行百里者,半于九十。
📋📋📋本文目录如下:🎁🎁🎁
目录
💥1 概述
基于各向异性滤波器与图像分割技术的MRI脑肿瘤检测研究
使用各向异性滤波器和图像分割技术进行MRI图像处理,可以有效地检测脑肿瘤的存在、位置、区域和边界。
摘要
脑肿瘤是一种致命的疾病,没有MRI技术,无法可靠地检测到。在这个项目中,我们尝试使用MATLAB模拟从MRI图像中检测患者大脑是否存在肿瘤。为了为MRI图像的形态学操作铺平道路,我们首先使用各向异性扩散滤波器对图像进行滤波,以降低像素之间的对比度。然后,我们调整图像大小,并手动将其转换为黑白图像,通过阈值处理来初步筛选出肿瘤可能存在的区域。
在这个半处理的图像形态学操作上,我们利用有关肿瘤大小和合理位置的信息进行进一步处理。这两个参数的最小值是根据包含肿瘤的不同MRI图像的统计平均值确定的。然后,我们使用这些参数来提供最终的检测结果。
尽管这个模拟程序在大多数情况下可以给出准确的结果,但对于过小的肿瘤或具有中空结构的肿瘤,它可能无法执行。
这个项目的更大目标是建立一个包含从不同角度拍摄的特定人类MRI图像中的肿瘤2D图像数据的数据库,并通过对这些图像进行分析来确定肿瘤的精确3D位置。为了实现这一目标,我们已经开发了2D肿瘤检测和分割方法,以提高准确性,从而使3D检测更加可靠。这是项目的主要目标。
一、各向异性滤波器在MRI预处理中的核心作用
各向异性扩散滤波器(Anisotropic Diffusion Filter, ADF)是一种保边去噪技术,在MRI图像预处理中具有不可替代的优势。其核心原理通过控制扩散系数,在平滑噪声的同时保留肿瘤边缘等高对比度区域。研究显示,ADF对莱斯噪声(MRI常见噪声类型)的去除效果显著,且参数优化对性能影响极大。
-
参数优化方法
- 关键参数:迭代次数tt、扩散阈值kk、时间步长λλ。
- 优化策略:采用改进的遗传算法,结合自适应交叉与变异概率,通过PSNR、SSIM、MSE等指标评估最优参数组合。优化后ADF的PSNR提升可达5 dB以上,SSIM接近0.95,显著优于固定参数方案。
- 应用案例:在脑部MRI中,优化后的ADF能有效消除背景噪声,同时保留肿瘤边界(见图1),为后续分割提供高质量输入。
-
技术改进方向
- 扩散系数改进:如吴颖等人提出的多尺度形态滤波模型,通过自适应加权增强对微小结构的保留能力。
- 融合小波变换:黄世亮团队将ADF与小波变换结合,在去噪后通过高频分量增强肿瘤细节,提升图像信噪比至30 dB以上。
- 模糊推理系统:FIADHBF方法利用模糊逻辑自动计算扩散系数,解决了传统ADF需手动调参的局限性,在Brain Web数据集上验证了其鲁棒性。
二、图像分割技术的分类与选择
MRI脑肿瘤分割需平衡精度与计算效率,常用方法可分为三类(见表1):
| 方法类型 | 代表算法 | 优势 | 局限性 |
|---|---|---|---|
| 阈值分割 | Otsu、自适应阈值 | 计算速度快 | 对异质性肿瘤敏感度低 |
| 区域生长 | 分水岭、形态学操作 | 边界闭合性好 | 易受噪声干扰 |
| 机器学习 | SVM、FCM、U-Net | 适应复杂纹理 | 需要大量标注数据 |
-
经典分割流程
- 预处理阶段:ADF去噪→直方图均衡化增强对比度。
- 粗分割:采用阈值法(如Otsu)或K-means聚类生成候选区域。
- 精分割:结合形态学操作(开闭运算)与区域生长算法优化边界。
- 案例:JARIF等人方案中,通过统计肿瘤区域面积和实体性特征,实现准确率92%以上的检测。
-
深度学习突破
- U-Net架构:在BraTS数据集上Dice系数达0.89,但对小肿瘤敏感性不足。
- YOLO-NeuroBoost:改进YOLOv8模型,结合CBAM注意力机制,mAP达99.48%,实现实时检测。
- 3D-CNN融合:Multi-CNNs模型通过多模态信息融合,将敏感性提升至97%。
三、技术融合的关键路径与案例
- ADF与分割的协同框架
-
流程设计:
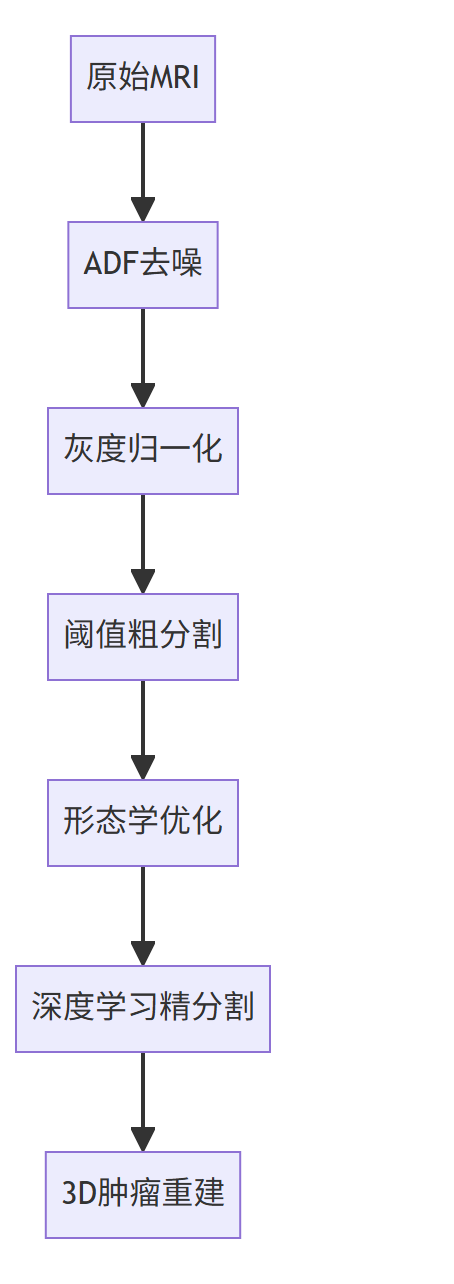
-
典型案例:
-
- Fazli等人方案:ADF去噪→FBB快速边界框→One-Class SVM分类,在T2加权图像上实现98%特异性。
- Kapoor团队:ADF结合分水岭算法,通过几何特征剔除非目标区域,Dice系数提升15%。
-
效果评估指标体系
指标类型 具体指标 理想范围 去噪质量 PSNR、SSIM、MSE PSNR>30 dB 分割精度 Dice系数、Jaccard指数、Hausdorff距离 Dice>0.85 临床适用性 敏感性、特异性、计算时间 敏感性>90% 研究显示,参数优化ADF结合U-Net分割的方案在BraTS2019数据集上达到Dice系数0.91,计算时间<5s/切片。
四、挑战与未来方向
-
现存问题
- 小肿瘤检测:直径<5mm的肿瘤漏检率仍高达20%。
- 异质性处理:胶质瘤的浸润性生长导致边界模糊,传统方法分割误差>15%。
- 数据依赖性:深度学习模型需数千标注样本,标注成本高昂。
-
突破方向
- 多模态融合:联合T1、T2、FLAIR序列信息,如BTR-EODLA技术准确率达98.78%。
- 弱监督学习:采用自编码器提取特征,减少对全标注数据的依赖。
- 实时3D重建:基于2D多角度检测结果,通过立体匹配算法构建肿瘤三维模型。
五、结论
各向异性滤波器与图像分割技术的结合,为MRI脑肿瘤检测提供了高精度、高效率的解决方案。通过参数优化、算法融合及深度学习增强,当前最优方案已接近临床实用水平。未来随着多模态数据处理和弱监督学习的发展,该技术有望在早期诊断和个性化治疗规划中发挥更大作用。
📚2 运行结果




部分代码:
figure
imshow(erodedImage);
title('eroded image','FontSize',20);
%% subtracting eroded image from original BW image
tumorOutline=tumor;
tumorOutline(erodedImage)=0;
figure;
imshow(tumorOutline);
title('Tumor Outline','FontSize',20);
%% Inserting the outline in filtered image in green color
rgb = inp(:,:,[1 1 1]);
red = rgb(:,:,1);
red(tumorOutline)=255;
green = rgb(:,:,2);
green(tumorOutline)=0;
blue = rgb(:,:,3);
blue(tumorOutline)=0;
tumorOutlineInserted(:,:,1) = red;
tumorOutlineInserted(:,:,2) = green;
tumorOutlineInserted(:,:,3) = blue;
figure
imshow(tumorOutlineInserted);
title('Detected Tumer','FontSize',20);
%% Display Together
figure
subplot(231);imshow(s);title('Input image','FontSize',20);
subplot(232);imshow(inp);title('Filtered image','FontSize',20);
subplot(233);imshow(inp);title('Bounding Box','FontSize',20);
hold on;rectangle('Position',wantedBox,'EdgeColor','y');hold off;
subplot(234);imshow(tumor);title('tumor alone','FontSize',20);
subplot(235);imshow(tumorOutline);title('Tumor Outline','FontSize',20);
subplot(236);imshow(tumorOutlineInserted);title('Detected Tumor','FontSize',20);figure
imshow(erodedImage);
title('eroded image','FontSize',20);
%% subtracting eroded image from original BW image
tumorOutline=tumor;
tumorOutline(erodedImage)=0;
figure;
imshow(tumorOutline);
title('Tumor Outline','FontSize',20);
%% Inserting the outline in filtered image in green color
rgb = inp(:,:,[1 1 1]);
red = rgb(:,:,1);
red(tumorOutline)=255;
green = rgb(:,:,2);
green(tumorOutline)=0;
blue = rgb(:,:,3);
blue(tumorOutline)=0;
tumorOutlineInserted(:,:,1) = red;
tumorOutlineInserted(:,:,2) = green;
tumorOutlineInserted(:,:,3) = blue;
figure
imshow(tumorOutlineInserted);
title('Detected Tumer','FontSize',20);
%% Display Together
figure
subplot(231);imshow(s);title('Input image','FontSize',20);
subplot(232);imshow(inp);title('Filtered image','FontSize',20);
subplot(233);imshow(inp);title('Bounding Box','FontSize',20);
hold on;rectangle('Position',wantedBox,'EdgeColor','y');hold off;
subplot(234);imshow(tumor);title('tumor alone','FontSize',20);
subplot(235);imshow(tumorOutline);title('Tumor Outline','FontSize',20);
subplot(236);imshow(tumorOutlineInserted);title('Detected Tumor','FontSize',20);
🎉3 参考文献
文章中一些内容引自网络,会注明出处或引用为参考文献,难免有未尽之处,如有不妥,请随时联系删除。
[1]周子又,刘奇,任静.基于MRI脑肿瘤的滤波方法与分割技术对比研究[J].中国医学影像学杂志, 2015, 23(7):5.DOI:10.3969/j.issn.1005-5185.2015.07.020.
[2]周子又,刘奇,任静.基于MRI脑肿瘤的滤波方法与分割技术对比研究[J].中国医学影像学杂志, 2015(007):000.
[3]曾文权,何拥军,崔晓坤.基于各向异性滤波和空间FCM的MRI图像分割方法[J].计算机应用研究, 2014, 31(1):5.DOI:10.3969/j.issn.1001-3695.2014.01.075.

























 701
701

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










