引言
中药活性成分是新药研发的“富矿”,但“不知道成分如何起效、找不到直接作用靶点”一直是制约中药现代化的关键瓶颈。近年来,随着质谱技术的发展,有限蛋白酶解 - 质谱联用技术(LiP-MS) 为中药活性成分的靶点筛选提供了高效解决方案。
今天带大家通过两篇顶刊研究 —— 分别聚焦“已知中药活性成分的新适应症验证” 和“未知中药活性成分的高通量筛选“,拆解中药靶点筛选的两种核心思路,顺便看看 LiP-MS 技术如何成为连接中药成分与疾病机制的“桥梁”。
已知活性成分的“新适应症”验证 —— 草豆蔻靶向钙调蛋白治疗MASLD
研究背景与核心目标
代谢相关脂肪性肝病(MASLD,含MASH)是全球第一大慢性肝病,但获批药物极少。山东大学团队(《Advanced Science》,2025)聚焦传统中药草豆蔻(Alpinia katsumadai Hayata)的活性成分 —— Alnustone(阿尔诺酮) 。此前研究已证实它有抗炎、抗菌、抗癌活性,且其同类成分(如姜黄素)已被报道可改善 MASLD。
因此,团队的核心目标不是 “筛选新成分”,而是验证 Alnustone 对 MASLD/MASH 的治疗潜力,并找到其直接作用靶点。
筛选与验证逻辑:“先疗效,后靶点”的精准验证
Alnustone 已有明确生物活性基础,研究跳过了 “化合物库筛选” 步骤,直接进入体内外多模型验证,全程围绕 “疗效 - 机制 - 靶点” 展开:
1. 体内:覆盖 4 种 MASLD/MASH 模型,验证疗效普适性
构建饮食诱导、遗传缺陷、纤维化共 4 种 MASLD/MASH 小鼠模型,排除模型特异性干扰。结果显示,Alnustone 经腹腔注射或口服均能降低血清甘油三酯、减少肝脂沉积、逆转肝纤维化,对雌雄小鼠均有效且无副作用。
2. 体外:锁定肝细胞,解析代谢机制
在小鼠及人类肝细胞的脂肪变性模型中,明确 Alnustone 通过促进线粒体脂肪酸 β- 氧化减少甘油三酯堆积,排除其他代谢机制干扰。
3. 靶点筛选:LiP-SMap + 多技术验证,锁定钙调蛋白
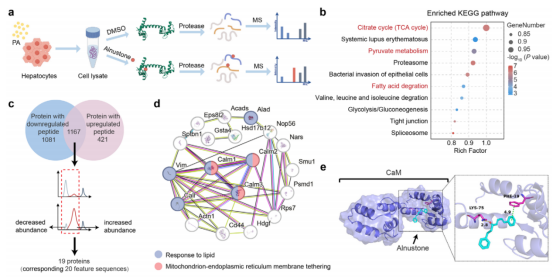
采用有限蛋白酶解 - 小分子映射(LiP-MS)技术筛选潜在靶点,后续通过多方法验证:
▶ LiP-SMap 分析:从差异蛋白中筛选出钙调蛋白,其为调控细胞内 Ca²⁺信号的关键蛋白;
▶ 结合特性验证:通过分子对接、表面等离子共振(SPR)、微量热泳动(MST),确认 Alnustone 直接结合钙调蛋白的 Ca²⁺结合位点;
▶ 功能必要性验证:构建肝脏特异性钙调蛋白敲除小鼠,发现 Alnustone 的降脂、抗纤维化效果完全消失,证实钙调蛋白是其必需作用靶点。
未知活性成分的 “高通量筛选”—— 紫堇灵靶向 PSMA2 抗胰腺纤维化
研究背景与核心目标
慢性胰腺炎(CP)的核心病理特征是胰腺纤维化,但目前尚无有效逆转药物。海军军医大学团队(《Journal of Gastroenterology》,2024)从大量中药单体中,筛选出能抑制胰腺纤维化的“未知活性成分”,并明确其靶点。
筛选与验证逻辑:“先筛成分,再证疗效,最后找靶点”
由于胰腺纤维化的中药活性成分研究较少,无明确 “同类有效成分” 参考,团队采用 “无偏向性高通量筛选” 策略:
1. 第一步:构建 80 种中药单体库,体外预筛选
构建 80 种中药单体库,用 TGF-β1 刺激人胰腺星状细胞(HPSCs,胰腺纤维化关键细胞)模拟病理过程,通过细胞活力检测筛选出候选成分紫堇灵(Corynoline)。
2. 第二步:验证成分特异性,排除非特异性细胞毒性
检测 Corynoline 对其他胰腺细胞(胰腺导管细胞、腺泡细胞)的影响,确认其仅靶向抑制 HPSCs 的活化、迁移及胶原合成,对其他胰腺细胞无毒性。
3. 第三步:体内验证,确认抗纤维化疗效
在雨蛙肽诱导的 CP 小鼠模型中,Corynoline 可改善胰腺形态、恢复胰内外分泌功能、抑制 NF-κB 炎症通路。
4. 第四步:靶点筛选,LiP-SMap 结合 DARTS 验证 PSMA2
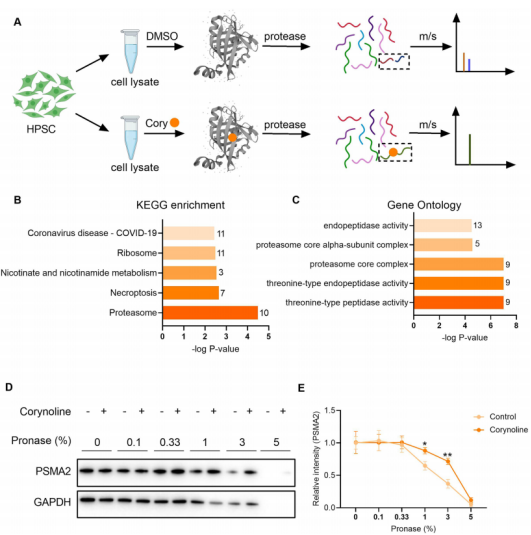
▶ LiP-SMap 分析:差异蛋白富集于 “蛋白酶体核心复合物” 通路,其中蛋白酶体 20S α2 亚基(PSMA2)的肽段差异最显著;
▶ 结合验证:通过 DARTS 证实 Corynoline 可保护 PSMA2 不被蛋白酶降解,确认两者直接结合;
▶ 功能验证:敲低 PSMA2 后,Corynoline 的抗纤维化效果完全消失,证实 PSMA2 是其必需作用靶点。。
两种筛选思路的核心异同:已知 vs 未知
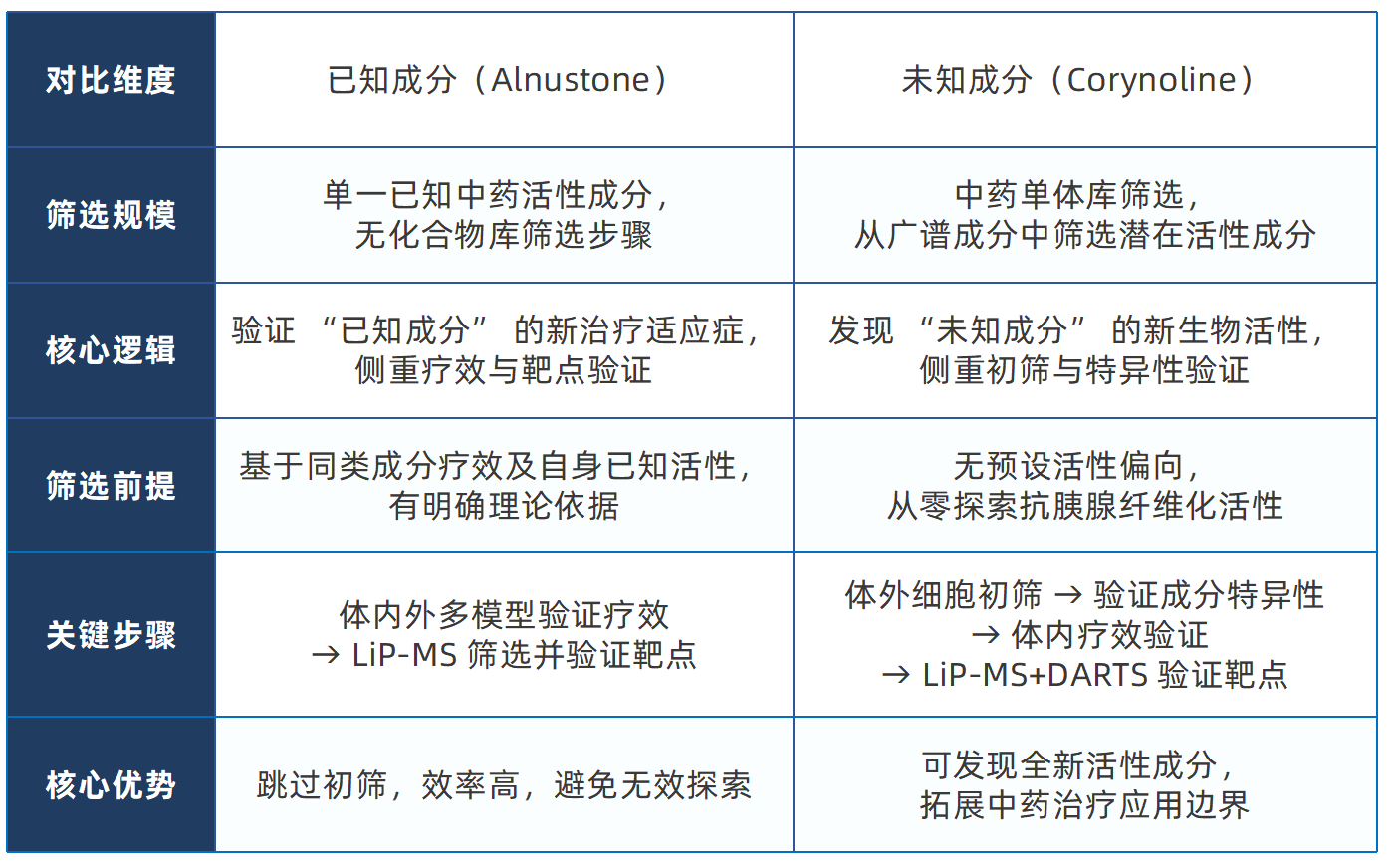
LiP-MS 技术:中药靶点筛选的 “破局者”
两篇研究均选择 LiP-MS 技术(LiP-SMap)筛选靶点,正是因为它完美解决了中药成分靶点筛选的两大痛点:
1. 无需修饰化合物,保留天然活性
传统靶点筛选(如亲和色谱)需对中药成分进行化学修饰(如生物素标记),但修饰可能破坏成分的天然结构和活性,导致 “假阴性”。
而 LiP-MS 无需修饰:药物与靶点的结合是 “天然状态”,仅通过蛋白酶解敏感性差异即可锁定靶点 —— 这对结构复杂的中药成分尤为重要。
2. 覆盖 “全蛋白组”,无偏向性
中药成分常存在 “多靶点作用”,但 LiP-MS 可一次性检测数千种蛋白的差异肽段,避免 “预设靶点” 的局限性。例如 Alnustone 的研究中,团队最初推测其作用于线粒体相关蛋白,最终却通过 LiP-MS 发现靶点是钙调蛋白,修正了研究方向。
3. 结合多技术验证,确保靶点可靠性
两篇研究均未仅凭 LiP-MS 下结论,而是搭配:
▶ 结构验证:分子对接(预测结合位点);
▶ 亲和力验证:SPR/MST(量化结合强度);
▶ 功能验证:基因敲除 / 过表达(证实靶点必需性);
▶ 补充技术:Corynoline 研究用 DARTS 进一步确认结合,降低假阳性。
总结:中药研究的“思路选择指南”
▶ 若探索已知活性中药成分的新适应症:直接通过 “体内多模型 + 体外细胞” 验证疗效,再用 LiP-MS 锁定靶点,聚焦 “疗效 - 机制 - 靶点” 闭环。
▶ 若挖掘中药全新活性成分:先构建单体库,经体外病理细胞模型高通量初筛,验证特异性后推进体内实验及 LiP-MS 靶点筛选。
无论哪种思路,LiP-MS 都是中药靶点筛选的核心工具:它不仅能破解中药“多成分、多靶点”的复杂性,还能为中药活性成分的“现代化阐释”提供直接证据 —— 让中药的“有效”不再是“黑箱”,而是可量化、可重复的科学结论。未来,随着 LiP-MS 技术的普及,相信会有更多中药活性成分的作用靶点被解析,为中药新药研发提供“从传统到现代”的桥梁。
参考文献
[1]Wang P, Huang B, Liu Y, et al. Corynoline protects chronic pancreatitis via binding to PSMA2 and alleviating pancreatic fibrosis. J Gastroenterol. 2024;59(11):1037-1051. doi:10.1007/s00535-024-02145-4
[2]Hu S, Liang X, Qin Y, et al. Alnustone Ameliorates Metabolic Dysfunction-Associated Steatotic Liver Disease by Facilitating Mitochondrial Fatty Acid β-Oxidation via Targeting Calmodulin. Adv Sci (Weinh). Published online June 5, 2025. doi:10.1002/advs.202411984





















 2412
2412

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








