
更多详情请见:LiP-MS药物靶点筛选技术
在药物研发的复杂过程中,药物靶点的筛选是关键环节之一。化学蛋白质组学技术的出现,为药物靶点筛选提供了强大的工具。作为蛋白质组学的分支之一,化学蛋白质组学旨在深入了解蛋白质在生物体内的作用机制,为疾病诊断、治疗和药物研发提供重要信息。在这一领域,等温热迁移实验(Isothermal Shift Assay, iTSA)和LiP-MS(Limited Proteolysis Mass Spectrometry)技术犹如两颗璀璨的明星,照亮了药物靶点筛选的路径。这两种技术虽然各有特色,但都致力于揭示小分子药物与蛋白质之间的相互作用,以及这些相互作用如何影响蛋白质的结构和功能。在本文中,我们将深入探讨iTSA和LiP-MS技术的关系与区别,以及它们在现代药物研发中的重要应用。
一、等温热迁移实验
iTSA技术的核心原理在于捕捉蛋白质热稳定性的微妙变化。当小分子药物与靶蛋白发生结合时,会显著改变蛋白质的热稳定性,进而导致其在特定温度下的热变性曲线产生相应的改变。与热蛋白组学(TPP)技术不同,iTSA技术独具特色之处在于,它仅针对目的蛋白选定一种最适温度条件进行检测,以精准评估蛋白质的稳定性。通过细致监测蛋白丰度的变化,那些丰度显著变化的蛋白,便可被识别为与药物直接相互作用的蛋白,从而找到药物结合的靶蛋白,为药物作用机制的研究提供关键线索。
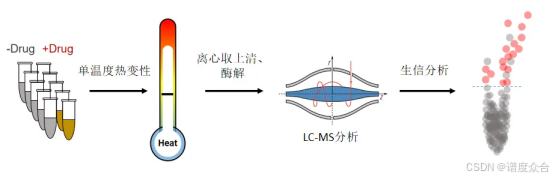
iTSA流程图
实验流程:
1.细胞处理:细胞样本与药物孵育后,在特定温度下进行热处理。
2.蛋白质提取:通过质谱分析上清中的蛋白,比较药物处理组和对照组的数据。
3.数据分析:丰度显著变化的蛋白即为药物直接相互作用的蛋白。
优势:
- 高通量:能够在全蛋白质组水平上进行筛选。
- 灵敏度高:能够检测到微弱的蛋白质-小分子相互作用。
局限性:
- 特异性较低:可能需要后续验证实验来确认靶点。
二、LiP-MS
LiP-MS技术基于有限蛋白水解的原理。小分子药物与蛋白质结合后,会引起蛋白质构象的变化,这种构象变化会影响蛋白酶的切割位点可及性,从而在有限的蛋白酶解过程中产生靶蛋白的特异性片段。通过比较代谢物处理样品与未处理样品中肽段的丰度差异,可以精确识别出与小分子药物结合的蛋白质及其作用位点。
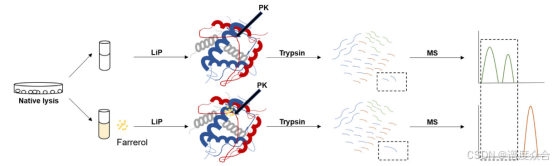
LiP-MS流程图
实验流程:
- 细胞裂解:将细胞裂解以获得蛋白质样本。
- 小分子药物与裂解物的孵育:将小分子药物与细胞裂解物共同孵育。
- 有限蛋白酶切:在孵育后的裂解混合物中加入非特异性蛋白酶(如蛋白酶K)进行有限蛋白酶切。
- 胰蛋白酶消化:使用胰蛋白酶对蛋白质片段进行进一步消化,生成适合定量质谱分析的肽段。
- 质谱分析:通过LC-MS/MS分析检测肽段的质量和丰度。
优势:
- 高分辨率:能够精确检测小分子与蛋白质的结合位点。
- 适用样本类型广:适用于多种样本类型,包括蛋白质溶液、组织、细胞、细菌、酵母等。
- 同时检测蛋白质丰度和结构变化:为研究蛋白质-小分子相互作用提供了全面的视角。
- 揭示蛋白质在天然状态下的动态构象特征。
局限性:
- 靶蛋白具有较高的序列覆盖率。
- 蛋白质构象的动态变化可能掩盖或干扰结合位点的识别,影响结合位点的准确定位。
三、iTSA与LiP-MS技术的对比
| 技术方法 | iTSA | LiP-MS |
| 技术原理 | 基于热蛋白组学技术,通过在特定温度下进行热处理,检测蛋白质的热稳定性变化,从而揭示药物与蛋白质的相互作用。 | 通过小分子药物与蛋白质的结合引起蛋白质构象的变化,这种构象变化会影响蛋白酶的切割位点可及性,从而在有限的蛋白酶解过程中产生靶蛋白的特异性片段。 |
| 样品处理 | 细胞样本在药物处理后,在特定温度下进行热处理。 | 将细胞裂解以获得蛋白质样本,然后将小分子药物与细胞裂解物共同孵育。 |
| 检测方法 | 通过质谱分析上清中的蛋白,比较药物处理组和对照组的数据。 | 在孵育后的裂解混合物中加入非特异性蛋白酶(如蛋白酶K)进行有限蛋白酶切,然后使用胰蛋白酶对蛋白质片段进行进一步消化,生成适合定量质谱分析的肽段。 |
| 数据分析 | 丰度显著变化的蛋白即为药物直接相互作用的蛋白。 | 通过比较代谢物处理样品与未处理样品中肽段的丰度差异,可以精确识别出与小分子药物结合的蛋白质及其作用位点。 |
| 应用场景 | 主要用于药物靶点发现,通过检测蛋白质热稳定性的变化来鉴定药物的直接靶蛋白。 | 除了药物靶点发现外,还广泛应用于蛋白质-蛋白质相互作用、翻译后修饰研究、蛋白质折叠动力学研究等领域。 |
四、总结
在药物靶点筛选领域,等温热迁移实验(iTSA)和LiP-MS技术均为关键工具。iTSA通过监测蛋白质热稳定性的变化来锁定药物靶点,而LiP-MS则凭借对蛋白质构象变化的捕捉来实现靶点识别。二者在药物靶点筛选过程中各具千秋,具体选用哪项技术,需依据实际研究需求及实验条件综合考量。值得注意的是,当将iTSA与LiP-MS联合运用时,二者能够实现优势互补,提供更为全面、精准的药物靶点信息。这有助于深入剖析小分子药物与蛋白质之间错综复杂的作用机制,从而为药物研发进程注入强大动力,提供坚实的支撑。





















 1604
1604

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








