 详情请看:LiP-MS药物靶点筛选技术
详情请看:LiP-MS药物靶点筛选技术
植物代谢物在生长、发育和防御过程中发挥着关键作用,其通过与蛋白质的相互作用调控酶的活性、信号传导途径或基因表达,进而影响植物的生理过程。然而,尽管近年来蛋白质组学技术取得了显著进展,植物中蛋白质-代谢物相互作用(PMIs)的研究仍相对滞后,主要受限于技术复杂性和植物系统的特殊性。有限蛋白酶解耦合质谱法(Limited Proteolysis-Coupled Mass Spectrometry, LiP-MS)作为一种新兴的高通量技术,通过检测代谢物结合后蛋白质结构的变化及其对蛋白酶敏感性的影响,能够系统地鉴定代谢物结合的蛋白质及其结合位点。该技术最初在微生物研究中成功应用,现已被引入植物研究。尽管LiP-MS在植物中的应用尚处于起步阶段,但其高通量和高灵敏度的特点使其成为研究植物PMIs的有力工具。
目前,通过LiP-MS,研究人员能够系统地鉴定植物中的代谢物结合蛋白,揭示新的调控机制和信号传导途径。这一技术的应用将有助于更全面地理解植物的代谢网络和生理过程,为作物改良和生物技术应用提供新的见解。随着LiP-MS技术的不断优化,其在植物研究中的应用将更加广泛和深入。接下来,本文将详细介绍利用LiP-MS鉴定植物中蛋白质-代谢物相互作用的相关实验操作。
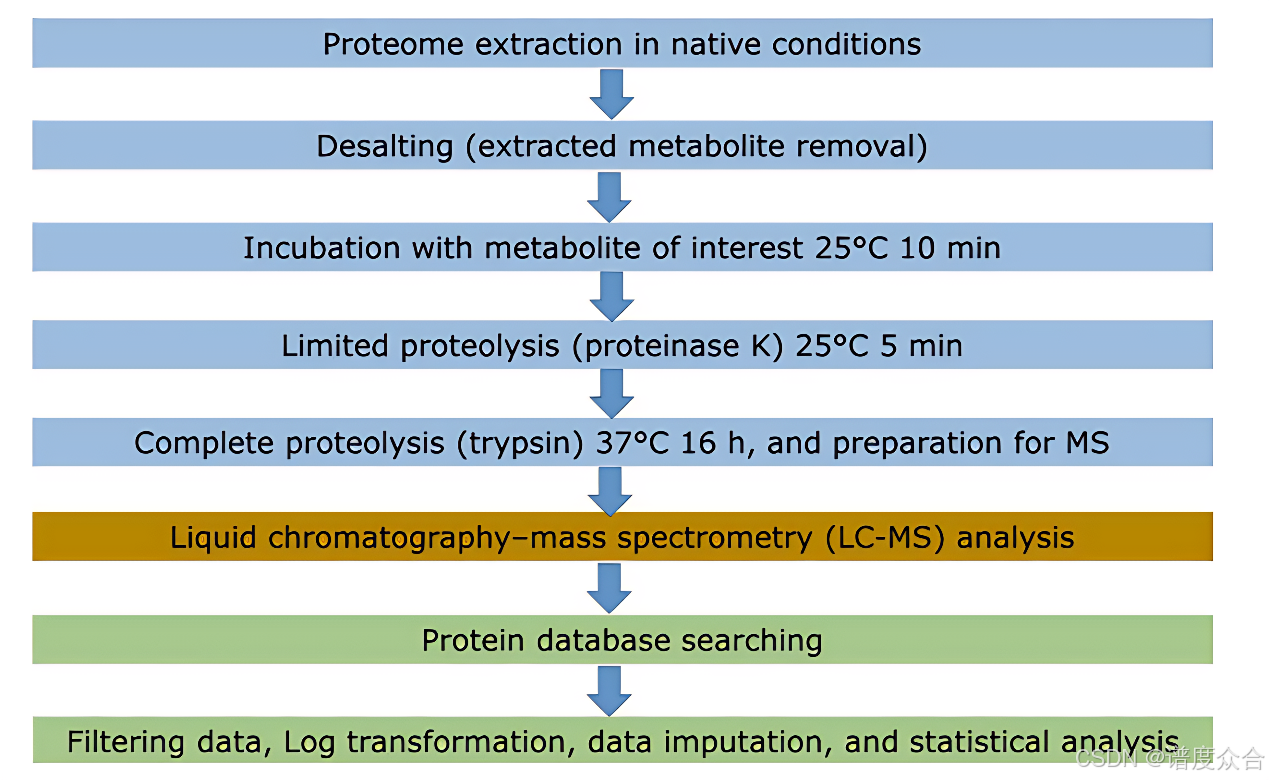
适用于植物的有限蛋白水解偶联质谱(LiP-MS)方案的工作流程图
适用于植物的LiP-MS实验流程
1. 样品制备
- 植物样品采集:
- 收集植物样品,并在液氮中迅速研磨成细粉,随后保存于-70°C,以确保蛋白质的稳定性和活性。
- 蛋白质提取:
- 将研磨后的样品悬浮于提取缓冲液中,通过冻融裂解和超声处理破碎细胞,释放蛋白质。
- 离心去除细胞碎片,收集上清液作为蛋白质提取物。
- 脱盐处理:
- 使用脱盐柱去除内源性代谢物,避免其对后续实验的干扰。
- 通过Bradford法测定蛋白质浓度,确保最终蛋白质浓度约为1000 µg/mL,以保证实验的重复性和准确性。
- 代谢物孵育:
- 将蛋白质样品与目标代谢物或对照溶剂在25°C孵育10分钟,使代谢物与蛋白质充分结合。
- 有限蛋白酶解:
- 加入蛋白酶K,在25°C孵育5分钟,进行有限的非特异性蛋白酶解。
- 通过加热(98°C,3分钟)终止蛋白酶K的活性,防止过度酶解。
- 完全胰蛋白酶解:
- 使用胰蛋白酶在37°C孵育16小时,进行完全酶解,将蛋白质消化为肽段。
- 酸化样品(加入0.5% TFA)并离心去除不溶性颗粒,确保样品纯净。
- 肽段纯化:
- 使用反相固相萃取柱纯化肽段,去除杂质。
- 真空干燥样品,溶解在重悬缓冲液中,以备后续质谱分析。
2. 质谱数据采集
- 液相色谱-质谱(LC-MS)分析:
- 使用高分辨率质谱仪(如Q-Exactive-HF)进行数据依赖采集(DDA)或数据独立采集(DIA)。
- 样品通过纳米液相色谱分离,采用非线性梯度洗脱,以提高肽段分离效果。
- 质谱仪在正离子模式下运行,采集MS1(全扫描)和MS2(碎片离子)数据。
- 数据采集模式:
- DDA模式:选择MS1中最丰富的12个峰进行MS2碎裂,适用于高通量筛选。
- DIA模式:使用预定义的宽窗口进行MS2碎裂,覆盖更广泛的肽段,提高低丰度肽段的检测灵敏度。
3. 数据分析
- DDA数据分析:
- 使用MaxQuant软件将原始数据与UniProt数据库进行比对,识别肽段和蛋白质。
- 设置参数:半特异性酶解、乙酰化(N端)和氧化(甲硫氨酸)修饰。
- 进行无标记定量(LFQ)分析,识别代谢物处理组与对照组之间差异富集的肽段。
- DIA数据分析:
- 生成光谱库,并进行DIA数据分析。
- 进行肽段和蛋白质水平的假阳性率(FDR)控制,确保数据可靠性。
- 进行差异富集分析,生成火山图等可视化结果,展示显著变化的肽段。
- 统计分析与结果验证:
- 通过线性模型和贝叶斯统计方法识别显著差异的肽段。
- 生成最终结果表,包含肽段序列、显著性(q值)、Log2倍数变化、UniProt ID等信息。
该实验方法通过系统的样品制备、质谱数据采集和数据分析,能够高效地鉴定植物中的蛋白质-代谢物相互作用。LiP-MS技术凭借其高通量和高灵敏度的特点,为揭示植物代谢调控机制提供了强有力的工具,为植物生理学和作物改良研究开辟了新的方向。如果您希望将LiP-MS技术应用于植物蛋白质相互作用研究,或进一步探索其在不同研究领域中的潜力,欢迎随时与我们联系。我们团队将竭诚为您提供专业的技术支持与合作机会,助力您在科学研究中取得突破性进展。期待与您携手,共同推动科学创新与发展!




















 1604
1604

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








