磷脂酰肌醇 3-激酶(PI3K)是一种胞内磷脂酰肌醇激酶,同时具有丝氨酸/苏氨酸(Ser/Thr)激酶和磷脂酰肌醇激酶的活性,其可参与增殖、分化和葡萄糖转运等多种细胞功能的调节。Akt 是一种丝氨酸/苏氨酸特异性蛋白激酶,在细胞存活和凋亡中起重要作用,经研究表明 PI3K-Akt 信号通路在人类肿瘤谱中普遍失调,该通路某些因素的突变导致的功能获得或功能缺失,引起细胞转化,同时可调节肿瘤细胞的增殖和存活,并与肿瘤的侵袭转移行为密切相关。
PI3K-Akt 信号的激活一般是受到酪氨酸激酶和 G 蛋白偶联受体的刺激后,PI3K 的 p85 调节亚基即被募集到邻近质膜的部位,p110 亚基通过与 p85 亚基结合把底物 4,5-二磷酸磷脂酰肌醇(PIP2)转化为三磷酸磷脂酰肌醇(PIP3)。
PIP3 可以和 Akt 的 N 端 PH 结构域结合。使 Akt 从细胞质转移到细胞膜上,并在 3-磷酸肌醇依赖性蛋白激酶 1(PDKI)和 3-磷酸肌醇依赖性蛋白激酶 2(PDK2)的辅助下,分别使 Akt 蛋白上的苏氨酸磷酸化位点(Thr308)和丝氨酸磷酸化位点(Ser473)磷酸化而使其激活。
长期以来,人们一直认为 PI3K-Akt 信号在细胞表面受体激活后的下游反应发生在质膜上,而 2020 年 11 月威斯康星大学麦迪逊分校医学与公共卫生学院的 Thapa 和 Chen 博士发表在《Nature Cell Biology》(IF = 20.042)上《Phosphatidylinositol 3-kinase signalling isspatially organized at endosomal compartments by microtubule-associated protein4》一文揭示了内体上 PI3Kα 介导的 PIP3 合成的激活,其取决于 PI3Kα 与微管结合蛋白 MAP4 间的相互作用。
研究者运用激动剂刺激 PI3K-Akt 信号传导的经典模型发现 MAP4 对 PI3K-Akt 信号在内体上传导的调控作用。
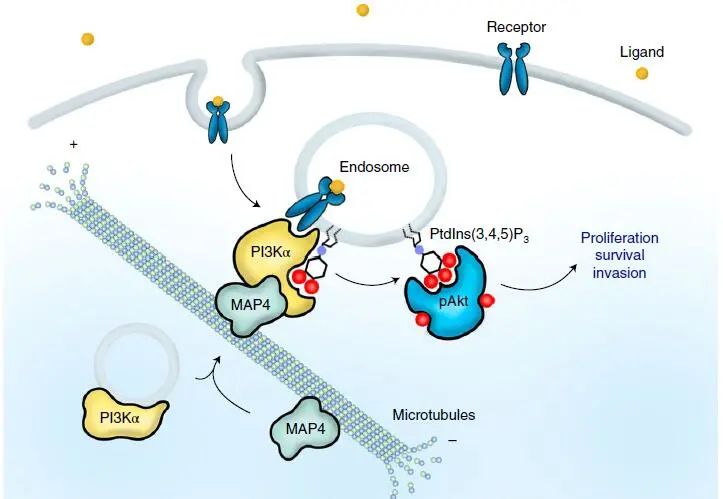
★ PI3Kα 分布在沿微管的小囊泡上,PI3Kα 与 MAP4 的直接作用可促进 PI3Kα 沿着微管分布。
★ PI3Kα-MAP4 复合物在受到受体酪氨酸激酶的刺激后,使得内体中的 PI3Kα 活化。
★ MAP4 的缺失会干扰 PI3Kα 募集到微管和内体上,影响 PI3Kα 与激活受体复合物的结合,并减少 PI3Kα 的在内体中活化、PIP3 的合成导致 PI3K-Akt 的信号传导的失调。
主要结论
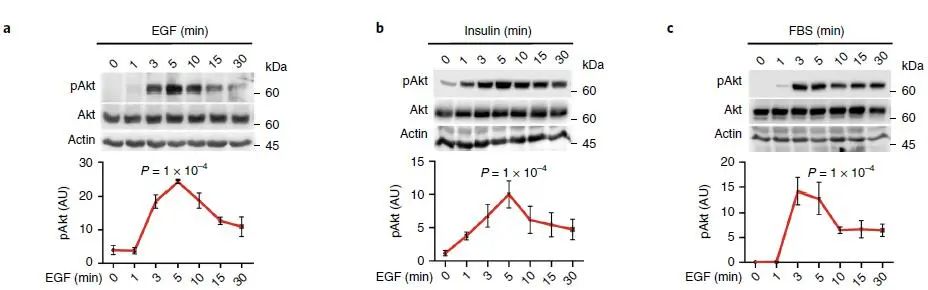
(1)激动剂刺激 PIP3 的生成和 Akt 的激活发生在沿微管的内膜区室中
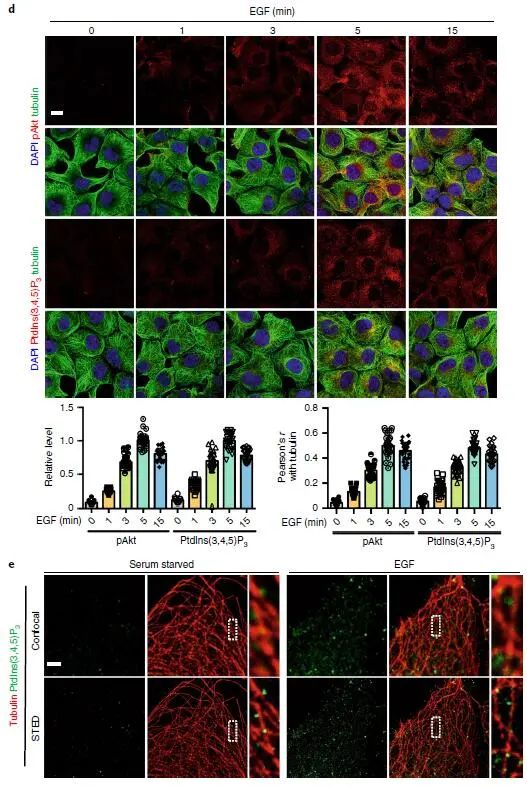
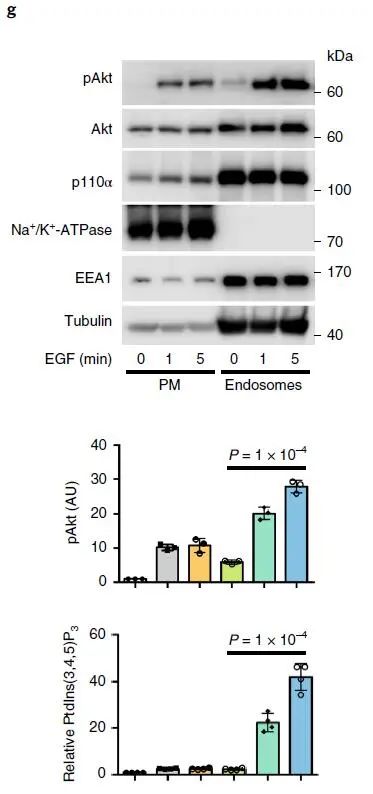
激动剂刺激细胞后,PI3K-Akt 信号迅速启动,Akt 信号在约 5 min 时达到峰值(下图 a,b,c),活化的 Akt 主要沿微管定位在囊泡结构上(下图 d),以上结果表明激动剂刺激后,Akt 的激活主要发生在细胞内体区室中;与 Akt 激活一致,EGF 刺激细胞后生成的 PIP3 在 5 min 达到峰值,并且也沿微管定位在囊泡区室(下图 d,e),使用柱式法亚细胞分离技术分离细胞质膜组分以及内体组分,WB 证明了 EGF 刺激细胞诱导的内体组分中 PIP3 生成和 Akt 的活化(下图 g)。
(2)MAP4 是 PI3Kα 的互作伴侣
PI3Kα 和 PIP3 的生成定位在微管附近的内部囊泡中,表明与 PI3Kα 相互作用的蛋白质可以将 PI3Kα 沿微管连接到内部囊泡。PI3Kα 免疫沉淀物的质谱分析确定了 MAP4 是 PI3Kα 的互作伴侣,MAP4 是普遍表达的非神经元微管相关蛋白(下图 a,b)。
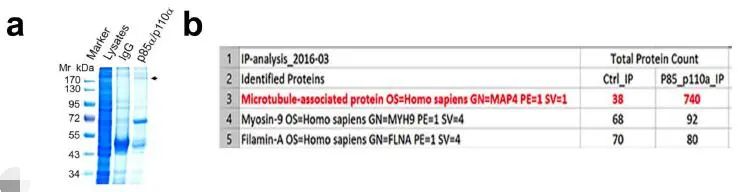
(3)内体中 MAP4-PI3Kα 相互作用的调节
为了了解激动剂刺激后 PI3Kα 和 MAP4 的空间定位,作者研究了 EGF 刺激后 PI3Kα 和 MAP4 的亚细胞分布,MAP4 和 PI3Kα 主要集中在微管中心及周围;使用免疫荧光显微镜观察,未观察到 PI3Kα 与 MAP4 的分布或共定位发生任何变化(下图 g)。PLA 法检测到 MAP4 和 p110α 之间的相互作用显着增加,而与 p85 亚基则没有(下图 h)。以上结果表明 PI3Kα 囊泡的一部分位于内体中,在激动剂刺激被激活后可能与 MAP4 相互作用。
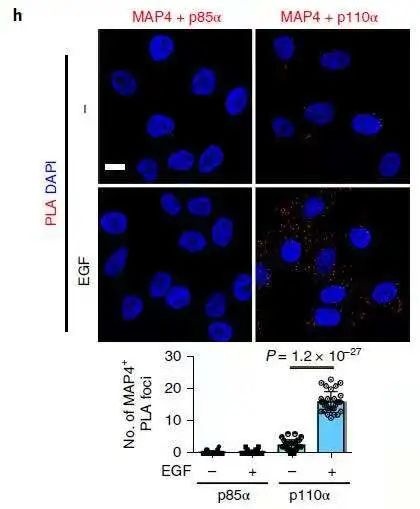
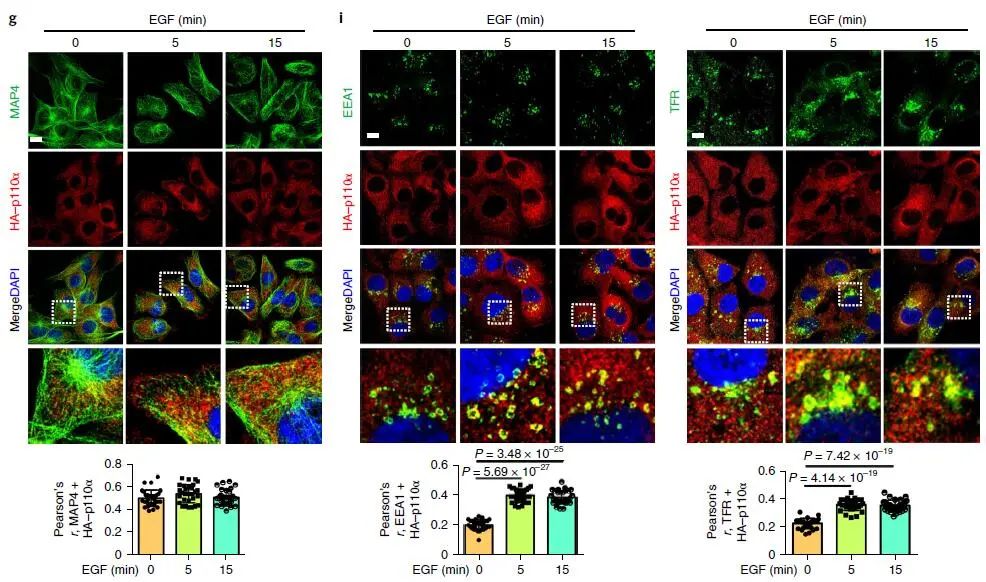
(4)MAP4 对于 Akt 活化是必须的
通过 WB 对细胞质膜组分和内体组分验证 MAP4 敲低对 EGF 刺激细胞内体中 Akt 活化的影响(下图 f)。Akt 的活化主要发生在细胞内体中,MAP4 的缺失会降低 Akt 活化,进而影响细胞的增殖以及侵袭。
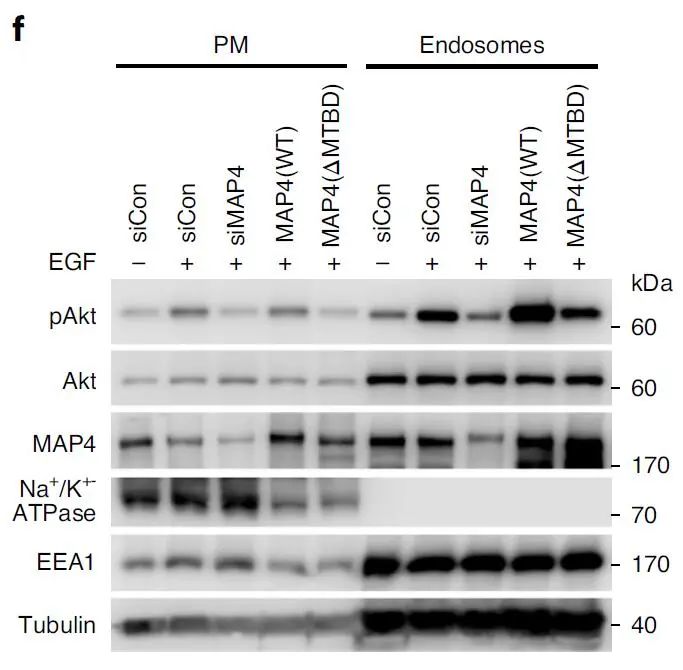
作者最终验证 MAP4 的敲低可以减少多种肿瘤细胞系中 Akt 介导的细胞增殖以及侵入性,提示其在癌症治疗中潜在的靶向性。
这项工作揭示了 MAP4 是内体中 PIP3-Akt 信号传导的关键调控子,并揭示内体与微管的密切关系,同时这项发现拓宽了我们对空间上和时间上磷酸肌醇信号传导的理解。
在这里我们需要重点提出一点:细胞外大分子、配体/受体复合物、功能膜蛋白和膜脂等通过内吞作用内化进入细胞,随后在胞内的囊泡状或管状膜性内体结构中进行一系列分选和定向运输。无论货物分子内吞进入细胞的方式如何,通常都运送到早期内体进行分选后进行转运。验证信号传导,蛋白转运过程,我们通常需分离得到相对纯净的亚细胞结构。INVENT 始终致力于柱式法亚细胞分离工具的开发,助力研究者精准而又简便地获得交叉污染较少的亚细胞结构,本文中使用了 Invent 柱式法分离了质膜组分(Cat#SM-005)和内体组分(早期内体,Cat#ED-028),从而验证质膜和内体上信号传导过程的假设。
Invent 柱式法快速蛋白提取及亚细胞结构分离,助力信号传导,蛋白转运研究好帮手!(点击文末「阅读原文」了解更多)
|
Invent 亚细胞结构分离全攻略 | |
|
SM-005(质膜及组分分离) |
Minute™ Plasma Membrane Protein Isolation and Cell Fractionation Kit |
|
ER-035(肝脏内质网) |
Minute™ High Fidelity ER Isolation Kit for Liver Tissue |
|
ER-036(内质网) |
Minute™ ER Enrichment Kit For Tissues and Cultured Cells |
|
GO-037(高尔基体) |
Minute™ Golgi Apparatus Enrichment Kit |
|
LY-034(溶酶体) |
Minute™ Lysosome Isolation Kit for mammalian cells/tissues |
|
ED-028(早期内体) |
Minute™ Endosome Isolation and Cell Fractionation Kit |
参考文献:
[1] NarendraThapa, Mo Chen, Hudson T. Horn1,et al.Phosphatidylinositol 3-kinase signalling is spatiallyorganized at endosomal compartments by microtubule-associated protein 4.NatureCell Biology.22,1357-1370(2020).
[2] Alex G.Batrouni, Jeremy M. Baskin.A MAP for PI3K activation on endosomes. NatureCell Signalling.22,1289-1294(2020).
[3] 林珑, 史岸冰. 细胞内吞循环运输通路及其分子调控机制.[J] 遗传.41,451-468(2019).
微信搜索“泽平科技”公众号进入咨询Invent产品报价。




















 672
672

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








