目录
案例 1:t-LiP-MS 锁定大肠杆菌的“能量开关”,为食品防腐提供新方案
案例 2:LiP-MS 挖出阻止大肠杆菌 “抱团” 的秘密,解决生物膜难题
导语
提到大肠杆菌,你肯定不陌生 —— 吃剩的饭菜放久了可能滋生它,没洗干净的厨具上有它的踪迹,甚至肠道里也有它的 “身影”。作为我们身边最常见的细菌之一,大部分大肠杆菌很 “安分”,但有些菌株(比如O157:H7)会污染食品引发腹泻,更麻烦的是,它还会抱团形成生物膜,附着在食品加工设备、冰箱密封条等表面,耐药性翻倍,常规清洁根本搞不定。
最近,《Food Chemistry》和《Nature Communications》两项研究采用LiP-MS(有限蛋白酶解耦合质谱)技术,直接挖出了大肠杆菌的两个 “致命软肋”—— 不仅搞懂了怎么精准杀它,还找到了阻止它 “抱团” 的方法。今天就从我们最关心的大肠杆菌问题出发,看看 LiP-MS 是怎么帮我们解决这些麻烦的!
为什么大肠杆菌这么难对付?
我们对大肠杆菌的 “头疼”,主要集中在两点:
1. 食品污染难防:它常藏在肉类、乳制品里,传统防腐剂要么有健康风险(比如亚硝酸盐可能产生致癌物),要么只能 “广谱杀菌”,无法针对大肠杆菌的特异性机制起效;
2. 生物膜难清:一旦大肠杆菌在厨具、管道上形成生物膜,就像穿上了 “防弹衣”,消毒剂渗不进去,还会不断释放细菌,成为持续污染的源头。
而这两个问题的核心,其实都是 “没摸清大肠杆菌的关键弱点”—— 而 LiP-MS 的出现,帮我们把这些 “弱点” 精准揪了出来。
LiP-MS“显微镜”:看穿大肠杆菌的“蛋白软肋”
先简单说下 LiP-MS 的逻辑,其实特别好理解:当蛋白质与配体(如抗菌肽或代谢物)结合后,其构象发生变化,对蛋白酶的敏感性降低。这就像握住一根绳子:被握住的部分不易断裂,未握住的部位则容易被剪断。
LiP-MS 就是用少量蛋白酶 “剪绳子”,对比 “加了小分子” 和 “没加小分子” 的两组蛋白 —— 那些没被剪断的片段,就来自大肠杆菌的 “软肋蛋白”(小分子的靶蛋白),连结合的具体位置都能找出来。这项技术无需标记或修饰蛋白质,最大限度地保持了相互作用的天然状态,为靶点识别提供了可靠方法。
案例 1:t-LiP-MS 锁定大肠杆菌的“能量开关”,为食品防腐提供新方案
大家买肉时最担心什么?怕大肠杆菌超标。之前发现一种叫 RiLK1 的抗菌肽,既能杀大肠杆菌,又对人体细胞无害,堪称 “食品防腐神器”—— 但它到底怎么杀死大肠杆菌的,一直没被搞懂。
研究团队直接把目标锁定在 “大肠杆菌的膜蛋白”(毕竟抗菌肽要先接触细菌膜),用t-LiP-MS(靶向版 LiP-MS) 做了对比实验:
- 将大肠杆菌膜蛋白分为两组,一组添加RiLK1,另一组作为对照;
- 用蛋白酶温和切割后,通过 t-LiP-MS 看哪些肽段 “没被剪断”—— 这些就是 RiLK1 结合的靶蛋白片段;
- 结果一出来,真相大白:RiLK1特异性结合ATP合成酶的b亚基和δ亚基。
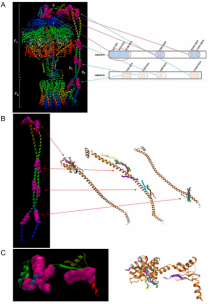
图1. ATP synthase结构图,展示b和δ亚基的位置及RiLK1结合区域。
【这俩蛋白是什么?】
ATP合成酶是大肠杆菌的“能量工厂”,负责合成ATP(细胞的能量货币)。RiLK1通过与b亚基的N/C端和δ亚基的N端结合,破坏了该酶的结构稳定性,导致细菌能量代谢紊乱,最终死亡。
这一下就解决了食品防腐的关键问题:不用再靠 “广谱杀菌”,而是精准打击大肠杆菌的 “能量开关”!研究还验证了,在肉类基质里,RiLK1 照样能通过这个机制抑制大肠杆菌,为安全的天然食品防腐剂提供了实打实的依据。
案例 2:LiP-MS 挖出阻止大肠杆菌 “抱团” 的秘密,解决生物膜难题
比单独的大肠杆菌更难对付的,是它形成的生物膜。生物膜是细菌群体粘附于表面后分泌多糖基质形成的保护性结构,能够抵抗消毒剂和抗生素。
研究发现,,代谢物MEcPP能够抑制大肠杆菌生物膜的形成,但它是怎么 “说服” 大肠杆菌不抱团的,一直是个谜。
这次团队用 LiP-MS 做了 “全局筛查”,对比了 “高 MEcPP”菌株和普通菌株的蛋白质组,结果发现了一个关键蛋白 ——H-NS,在高 MEcPP 的大肠杆菌里,H-NS 的某些肽段 “没被剪断”,说明 MEcPP 和 H-NS 结合了;
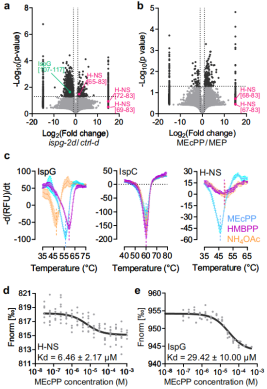
图2. MEcPP与H-NS相互作用,H-NS是fimE的转录抑制因子。
进一步研究发现:
- H-NS 本来是大肠杆菌的 “基因看守”,会盯着 fimE 基因不让它表达;但 MEcPP 一结合 H-NS,H-NS 就 “失职” 了,fimE 基因开始活跃;
- fimE 基因一活跃,就会让大肠杆菌的 “菌毛”(用来黏附、抱团的 “小爪子”)变少 —— 没了 “小爪子”,大肠杆菌没法黏附,自然形不成生物膜。
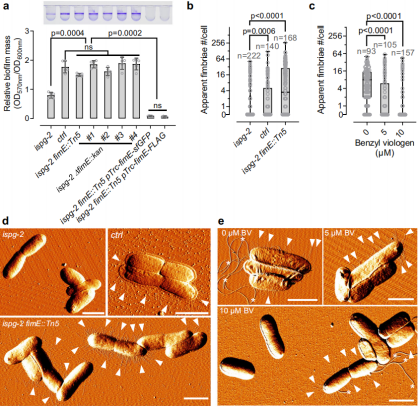
图3. MEcPP高水平菌株的菌毛减少。
原来 MEcPP 是通过 “策反” H-NS,断了大肠杆菌的 “抱团工具”!而这一切的起点,正是 LiP-MS 发现的 “MEcPP-H-NS 互作”。生物膜是细菌耐药性和持续感染的重要因素,能够理解并调控这一过程对于开发新型抗感染策略具有重要价值。
LiP-MS技术的双重应用价值
通过以上两个案例,可以看出LiP-MS技术在微生物研究中的共同价值:
1. 技术优势显著
LiP-MS具备高通量、高灵敏度和无需标记的特点,能够直接鉴定天然状态下的蛋白质-配体相互作用,甚至发现弱结合或瞬时结合的位点。
2. 机制研究的互补性
案例一从外源抗菌肽的角度揭示了如何通过靶向关键酶抑制细菌生长;案例二则从内源代谢物角度阐明了细菌如何调控群体行为。两者共同构建了对细菌生存策略的全面理解。
3. 应用前景广阔
- 新型抗菌药物开发:RiLK1及其作用靶点的发现为解决抗生素耐药性问题提供新思路。
- 生物膜控制策略:MEcPP通过调控H-NS抑制生物膜的形成,为相关感染治疗提供新方向。
- 食品保鲜技术:天然抗菌肽替代化学防腐剂,符合食品安全与健康需求。
未来展望:开启微生物研究的新纪元
LiP-MS技术的应用前景不仅限于基础研究,还拓展到多个实际领域:
1. 精准医疗:通过解析微生物的分子机制,设计更具针对性的抗感染策略。
2. 工业防污:在食品加工、医疗器械等领域抑制生物膜形成,降低污染风险。
3. 环境保护:处理水体及环境中的细菌污染,减少生物膜对设施的损害。
结语:技术驱动下的微生物学研究新范式
LiP-MS技术以其高精度、高效率的特点,成为微生物学研究中的强大工具。从RiLK1精准抑制能量代谢到MEcPP调控群体行为,这项技术不仅揭示了大肠杆菌的分子弱点,还为抗菌策略的开发提供了深入见解。
随着技术的不断完善,LiP-MS有望在更多领域发挥重要作用,为解决抗生素耐药性、食品安全和公共卫生等全球性挑战提供科学支持。通过从分子机制到实际应用的连贯创新,LiP-MS技术正在推动微生物学研究进入一个新的时代。
参考文献
[1] Capuano A, Cocca E, Montone AMI, et al. Disclose ATP-synthase as a protein target of the antimicrobial peptide RiLK1 in Escherichia coli: An alternative receptor-mediated bactericidal mechanism. Food Chem. 2025;479:143838. doi:10.1016/j.foodchem.2025.143838
[2] Guo J, Van De Ven WT, Skirycz A, et al. An evolutionarily conserved metabolite inhibits biofilm formation in Escherichia coli K-12. Nat Commun. 2024;15(1):10079. Published 2024 Nov 21. doi:10.1038/s41467-024-54501-w





















 1542
1542

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








