Lonza Clonetics & Poietics始于1984年,有着30多年的历史,现在可以提供上百种不同类型组织细胞,并且为每一种类型的细胞都优化了最佳的培养基系统以支持细胞在低血清或无血清环境中维持正常的细胞功能。
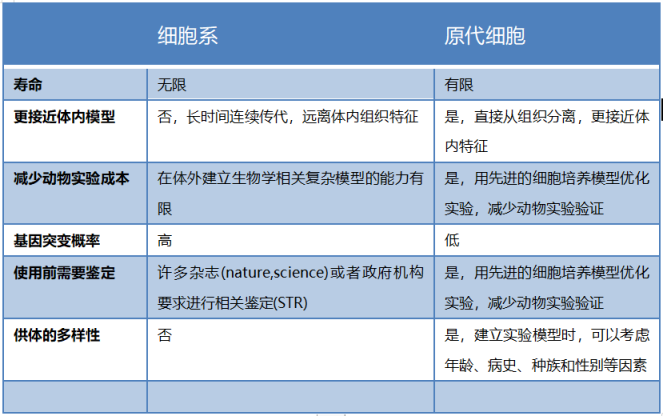
细胞系 VS 原代细胞
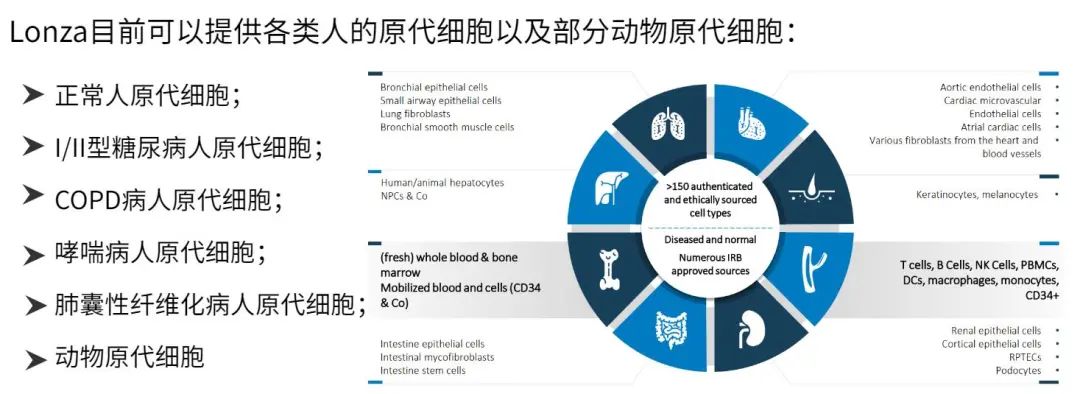
原代细胞培养解决方案

原代细胞
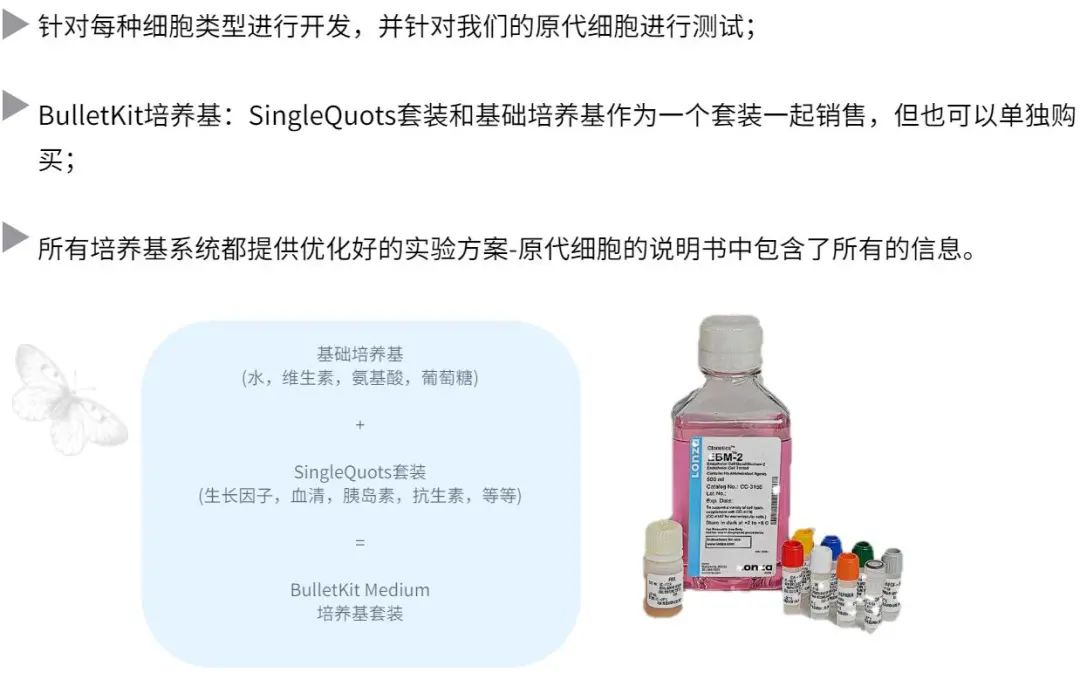
培养基套装
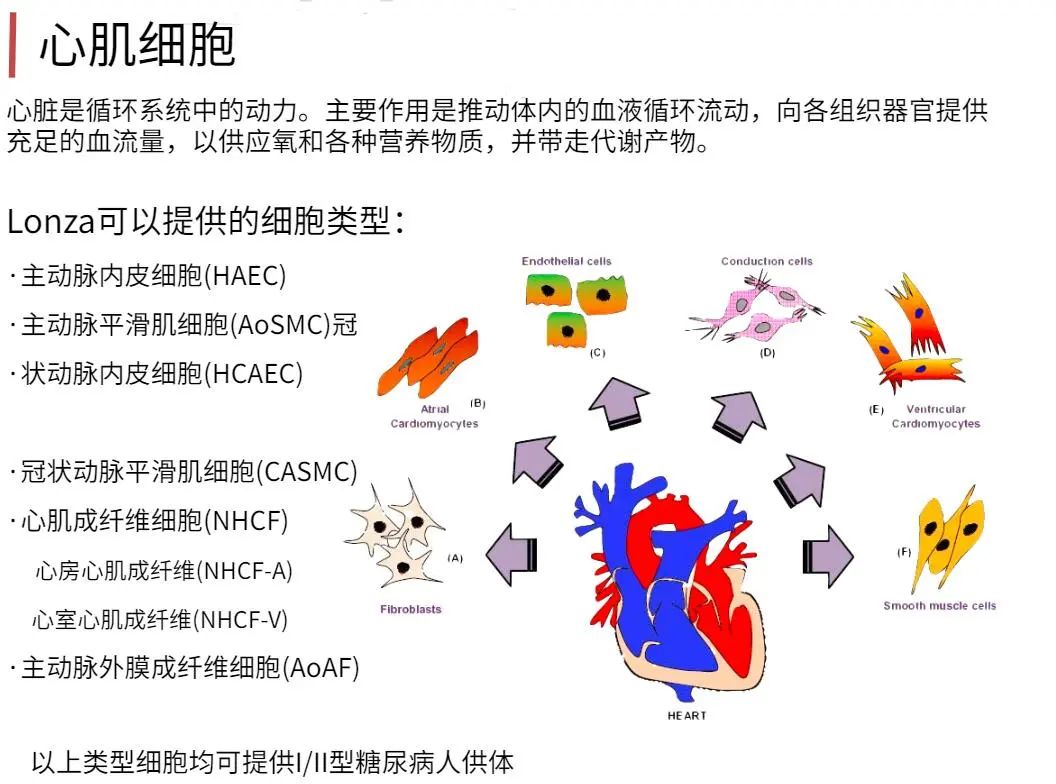
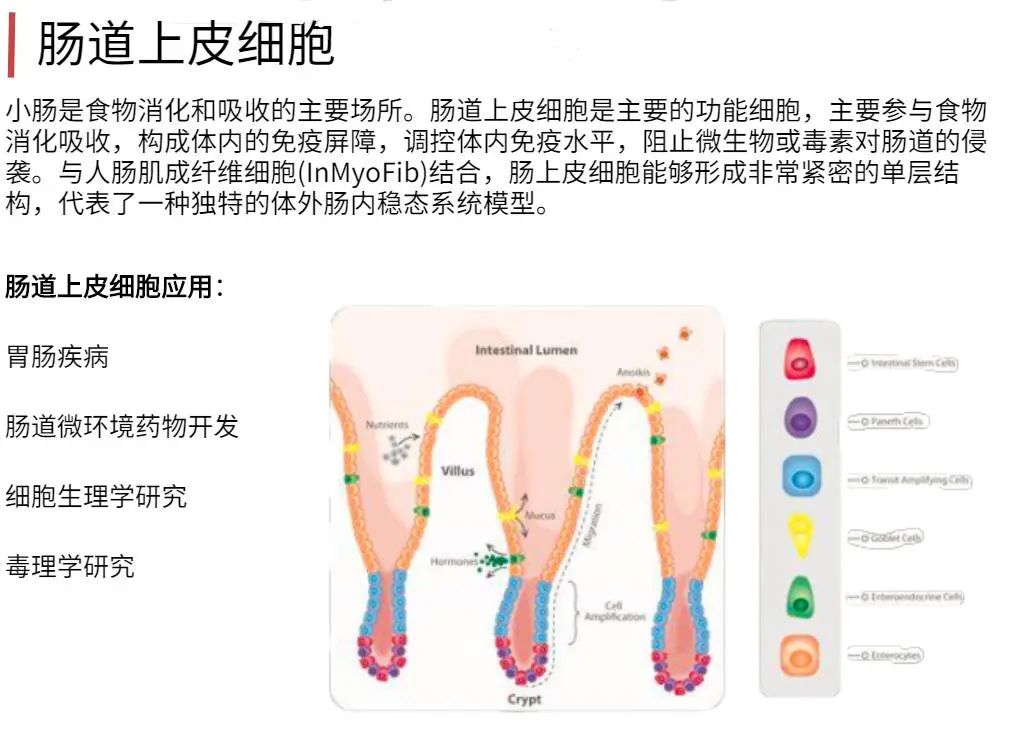
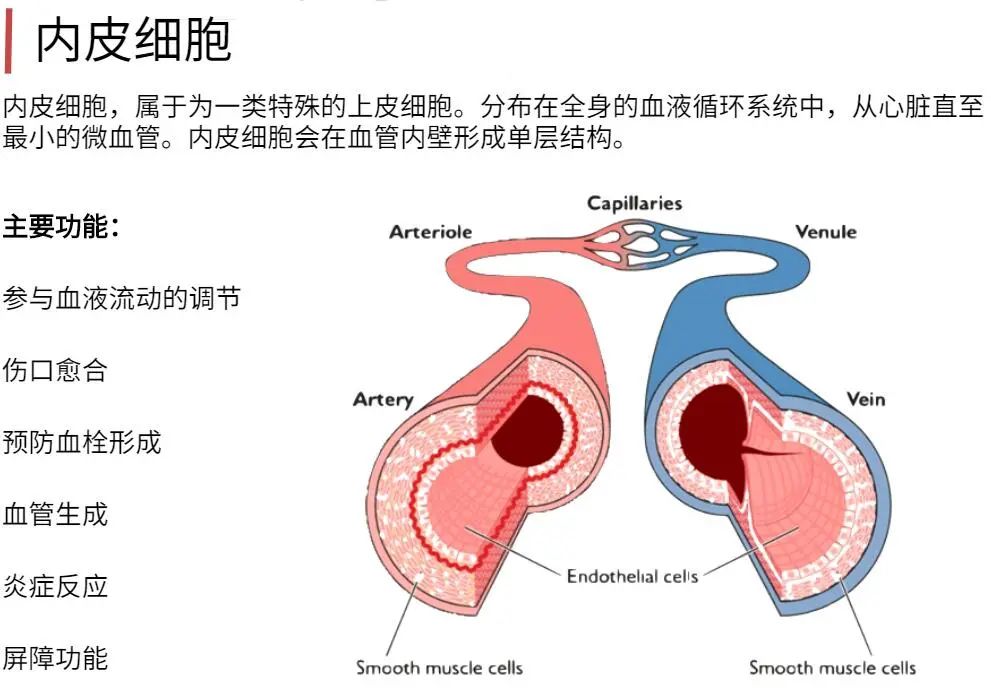
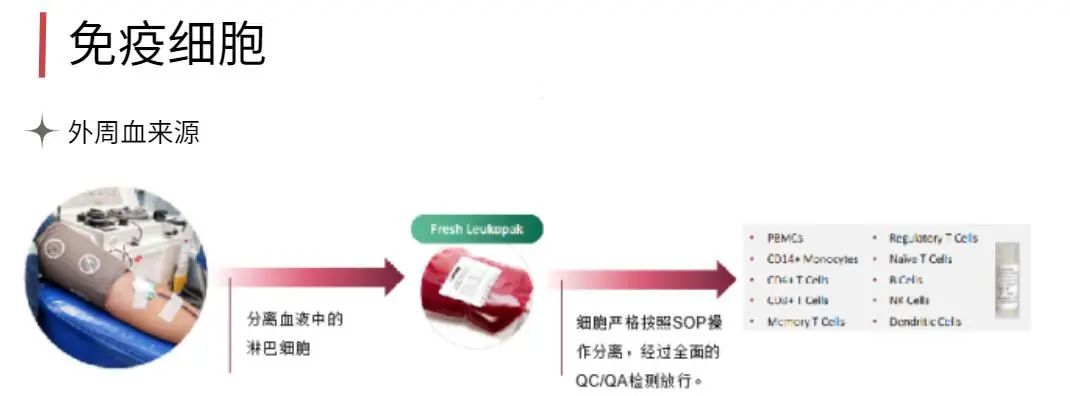
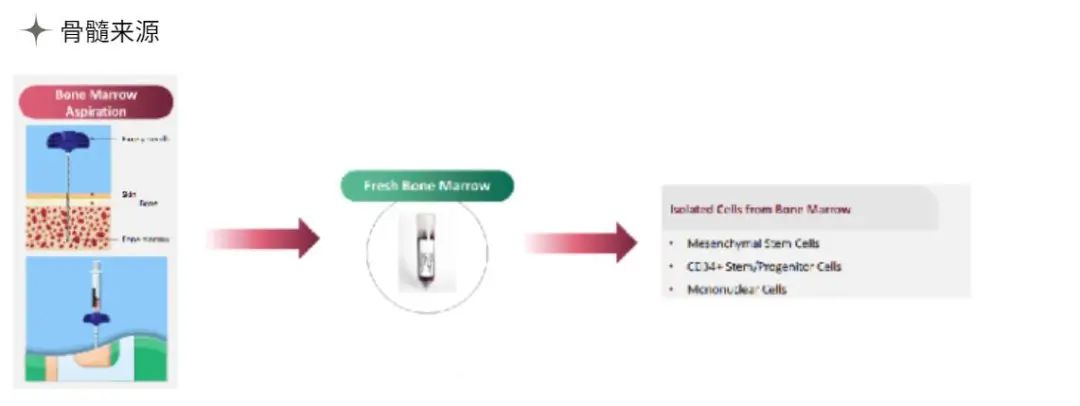
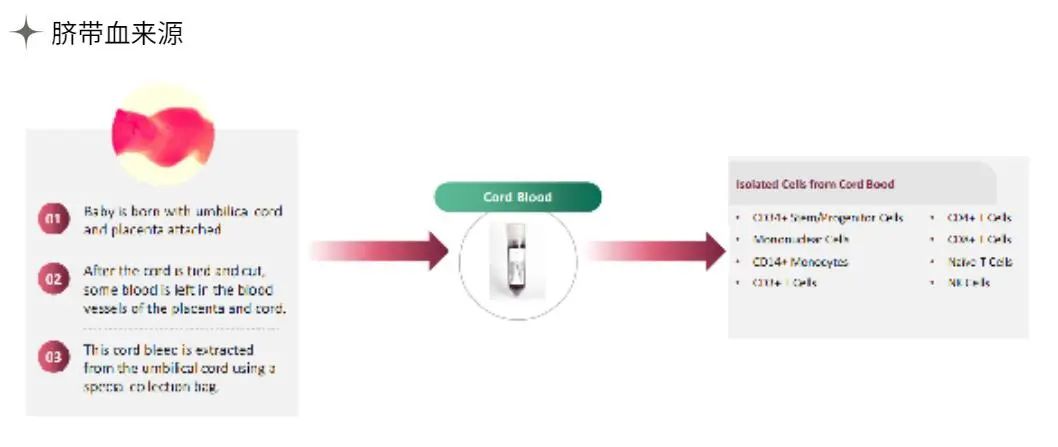
为什么要用Clonetics & Poietics 原代细胞?
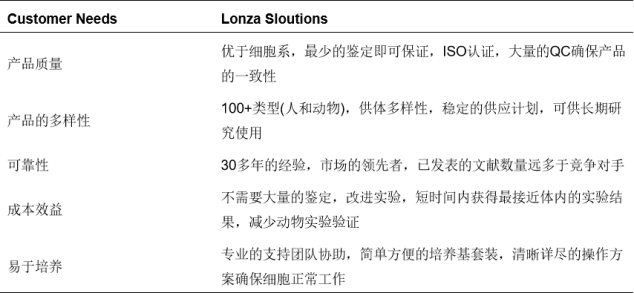
✔每一批次都有全面的质量控制
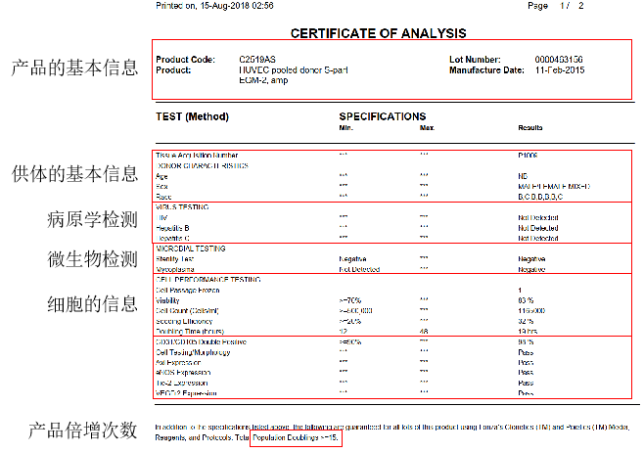
✔合法的研究用途许可



Lonza Clonetics & Poietics始于1984年,有着30多年的历史,现在可以提供上百种不同类型组织细胞,并且为每一种类型的细胞都优化了最佳的培养基系统以支持细胞在低血清或无血清环境中维持正常的细胞功能。
细胞系 VS 原代细胞

原代细胞培养解决方案

原代细胞

培养基套装











为什么要用Clonetics & Poietics 原代细胞?

✔每一批次都有全面的质量控制

✔合法的研究用途许可


 4218
4218

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?


