引言:高丰度陷阱下,功能修饰位点何处寻?
质谱仪一跑,数万条修饰位点数据瞬间到手,可屏幕上密密麻麻的修饰记录,到底哪些才是真正能调控蛋白质功能、影响细胞生理活动的“关键选手”?
有时,我们聚焦多个名列前茅的修饰位点,开展一系列功能验证实验,耗费数月构建点突变载体、干预修饰酶活性,最终却发现这些“高丰度候选者”只是占据数据榜单的“无效修饰”,白白浪费了大量精力。
难道高丰度就等同于高功能?面对海量修饰数据,我们该如何快速筛除 “伪功能位点”,精准锁定真正调控蛋白结构与细胞生理活动的 “关键选手”?希望今天读完这篇发表于《Nature Methods》的技术解析,能带给大家新的答案!

01 以热稳定性为探针,穿透丰度迷雾解码修饰功能
这篇文献提供了一个全新的研究方法 —— 热点热分析(HTP)技术。
其核心逻辑源于一个基础生物学现象:蛋白质的功能依赖其三维结构,而结构变化必然会体现在热稳定性(熔解温度 Tm)的偏移上。
这一特性让热稳定性成为区分功能修饰与无效修饰的 “黄金标准”—— 无论修饰位点丰度高低,只要能调控蛋白功能,就会引发特征性的 Tm 变化;反之,仅占据丰度优势的无效修饰,往往不会对热稳定性产生显著影响。
基于这一原理,HTP 将修饰位点富集、同位素标记与质谱分析完美串联,构建出一套精准规避高丰度干扰的功能筛选流程:
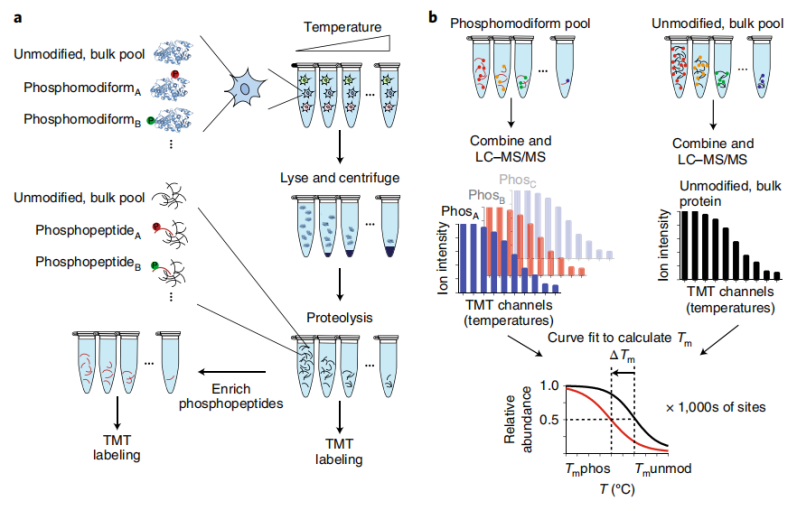
1. 温度梯度筛选:将活细胞分装后暴露于 37-67℃梯度温度中短暂处理,如同给蛋白质做 “热稳定性体检”—— 结构不稳定的蛋白会受热变性沉淀,仅保留结构稳定的可溶性蛋白,为后续分析奠定基础;
2. 双轨并行处理:将保留的可溶性蛋白分为两部分,5%用于检测未修饰总蛋白(作为“基准线”),95% 通过 TiO2树脂富集目标修饰肽段(如磷酸化肽段),精准聚焦修饰位点而非被总蛋白丰度干扰;
3. 同位素标记与质谱分析:用串联质谱标签(TMT)为不同温度组样品打上 “专属标记”,通过 LC-MS/MS 检测肽段丰度并拟合熔解温度(Tm),最终计算修饰位点与未修饰蛋白的 Tm 差值(ΔTm)。
这篇论文最让我们惊喜的是 HTP 技术的 “穿透性”—— 即便某一修饰形式在蛋白中仅占少数比例,其独特的热稳定性特征也能被清晰捕捉,彻底解决了低丰度功能位点被高丰度无效修饰“掩盖”的核心难题。
02 修饰位点的功能密码,藏在局部环境而非丰度中
深入拆解论文实验数据后,一系列颠覆 “丰度决定功能” 认知的规律浮出水面:蛋白质修饰的功能与位点丰度无关,而由其局部环境共同决定:
位点特异性调控,丰度参考价值不足
我们曾默认高丰度的磷酸化位点更可能具备功能,或推测功能与氨基酸类型(丝氨酸、苏氨酸、酪氨酸)、激酶基序相关。
但HTP数据显示,修饰对蛋白稳定性的影响与位点丰度基本无关,且不存在统一的 “修饰功能密码”—— 真正起决定作用的是位点的局部环境,无论丰度高低,每个位点的功能都需 “具体情况具体分析”。
结构语境的关键作用
数据揭示了明确的结构 - 功能关联:位于螺旋或 β 折叠区域的磷酸化位点,往往会降低蛋白稳定性;而暴露在蛋白表面的位点,则更倾向于提升稳定性,更以详实数据证明:结构语境对功能的影响远大于修饰丰度。
功能位点的“热信号”特征
更具说服力的是,已知的关键功能位点(如 CDK1 的 pY15、KIF11 的 pT926),无论其丰度如何,在 HTP 检测中均表现出显著的 Tm 偏移;而那些高丰度却无功能的修饰位点,其 Tm 值与未修饰蛋白几乎无差异。这表明,热稳定性变化是判断位点功能的 “普适性信号标签”,不受丰度干扰。
03 HTP技术的三大实用场景,从验证到发现全覆盖
这篇文献的案例清晰展现了HTP技术穿透高丰度陷阱的实用价值,无论是验证已知功能,还是挖掘未知机制,都表现出独特优势:
验证已知分子互作:4EBP1与EIF4E的结合调控
4EBP1 是翻译起始关键调控因子,其 N 端区域的磷酸化一直被认为与 EIF4E 结合相关,但部分高丰度磷酸位点的功能验证始终无果。通过 HTP 技术,我们发现 4EBP1 N 端功能相关磷酸位点(而非高丰度无效位点)的热稳定性显著下降(ΔTm≈-4.7℃),与 “磷酸化破坏 4EBP1-EIF4E 复合物” 的已知机制完全吻合 —— HTP 用热稳定性数据为功能位点提供了全新佐证,同时排除了高丰度无效修饰的干扰。
发现全新功能位点:vinculin的S721磷酸化
vinculin 是调控细胞黏附的结构蛋白,其 S721 位点在质谱检测中丰度并不突出,此前从未被注释过功能。但 HTP 数据显示,S721 磷酸化导致 vinculin 的热稳定性显著升高(ΔTm=7.6℃)。进一步功能验证证实,该位点磷酸化会破坏蛋白闭合构象,减少其向黏着斑的募集,抑制细胞黏附功能 —— 这正是我们梦寐以求的“突破性发现”,HTP 让低丰度但高功能的位点摆脱了高丰度无效修饰的 “压制”。
揭示代谢调控机制:GAPDH的S210磷酸化
GAPDH 是糖酵解关键酶,其部分高丰度磷酸位点经功能验证后未发现调控作用,而 HTP 技术发现低丰度的 S210 磷酸化会导致蛋白不稳定,且这种不稳定性具有代谢物依赖性:葡萄糖充足时,未磷酸化的 GAPDH 因结合底物而稳定,S210 磷酸化则降低底物结合能力;葡萄糖剥夺时,热稳定性差异消失。这一发现表明,HTP 能精准捕捉低丰度功能位点的动态调控细节,为代谢相关修饰研究提供了新工具。
04 技术价值:从“发现位点”到“解析功能”的跨越
对于长期从事蛋白质组学研究的科研人员,HTP 技术的核心价值在于彻底打破了“丰度至上”的研究误区:
▶ 高通量筛选:一次实验可并行分析数千种蛋白的修饰位点功能,效率较传统逐一验证提升百倍,无需依赖丰度排序,直接聚焦具有 Tm 偏移特征的功能位点;
▶ 原位性优势:在活细胞内进行检测,保留了蛋白质天然的相互作用网络,结果更贴近生理状态,避免了体外实验的局限性;
▶ 无偏性发现:无需预设目标位点,可从海量修饰中筛选出功能热点,打破了现有注释的局限——要知道,人类蛋白质组中90%以上的修饰位点都缺乏功能注释。
值得一提的是,HTP技术并非仅限于磷酸化修饰,其原理可拓展到乙酰化、泛素化等多种PTM类型,适用于不同物种和细胞类型。而其背后的热蛋白质组分析(TPP)技术框架,还可应用于药物靶点确证、脱靶效应分析、蛋白复合物动态研究等多个领域,展现出广阔的应用前景。
结语
研读这篇论文后,我们深刻感受到HTP技术为蛋白质修饰研究带来的范式变革。它以热稳定性为物理探针,成功搭建了“修饰位点”与“蛋白质功能”之间的桥梁,让我们能够更高效、更精准地破解蛋白质修饰的功能“迷雾”。
在精准医疗与深度生物学机制探索并行的时代,HTP技术无疑为我们提供了一把破解蛋白质功能调控的“金钥匙”。我们期待这一技术能够在更多研究中得到应用,助力我们更系统地解码蛋白质修饰网络,为生命科学研究和药物研发开辟新的道路。
首个蛋白质组水平无偏倚靶点筛选方法⬅️⬅️⬅️
▶ 全面直接筛选真实药靶组合:蛋白质组水平筛选药物结合的蛋白靶点,全面覆盖治疗靶点与脱靶靶点;使用药物分子本体进行试验,无需设计合成分子探针,药靶结合更真实
▶ 多种数据分析策略:结合蛋白热变性曲线分析和非参数分析方法(NPARC),全面捕获潜在药物靶点
▶ 多种生信分析数据库挖掘辅助筛选:对潜在药物靶点进行生信分析与数据库挖掘,辅助最终药物靶点的确认
▶ 多种衍生技术可选:除常规温度范围(TPP-TR)、药物浓度范围(TPP-CCR)、两者结合(2D-TPP)的常规热蛋白组分析方法外,还可进行单温度点(ITSA)、多温度点混合(PISA)等高通量热蛋白组分析方法
参考文献
Huang JX, Lee G, Cavanaugh KE, et al. High throughput discovery of functional protein modifications by Hotspot Thermal Profiling. Nat Methods. 2019;16(9):894-901. doi:10.1038/s41592-019-0499-3





















 4160
4160

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








