期刊名称:International Journal of Biological Sciences
影响因子:8.2
期刊分区:JCR 1区/中科院1区
发表时间:2025年4月
作者单位:澳门中药质量研究国家重点实验室
相关疾病:乳腺癌
样本类型:细胞
相关产品:TPP药物靶点筛选解决方案
样本数量:57
其他信息:药物靶点筛选、ITSA、TPCA
- 前言
今天和大家分享一篇聚焦于药物靶点筛选的前沿研究。该文章于2025年4月荣登《International Journal of Biological Sciences》(影响因子IF = 8.2)杂志,题为“Integrated thermal proteome and thermal proximity co-aggregation profiling identifies ATP6V1C1 as a novel anti - cancer drug target”。此研究开创性地提出了一种整合热蛋白质组分析(ITSA)与热邻近共聚集(TPCA)的创新策略,成功实现了功能靶点筛选以及下游蛋白质复合体功能验证,为同类型的药物靶点及作用机制研究提供了极具价值的参考范例。

2.研究背景
2.1 TPP-TPCA研究策略:
热蛋白组分析技术(Thermal Proteome Profiling,TPP)是一种经典的药物靶点筛选技术,本研究采用单温度点的等温位移分析(isothermal shift assay,ITSA)技术进行药物靶点筛选。热邻近共聚集(Thermal Proximity Co-Aggregation ,TPCA)技术是建立在TPP技术基础上的一种研究蛋白复合体功能变化的生物技术。相互作用的蛋白质会在热变性时凝聚,导致其不同温度的溶解度相似(热变性曲线相似),失去互作的蛋白(复合体解离后的单体)热熔曲线相似性降低(图1 A)。基于这一特性,利用TPP技术可以检测到蛋白质组中的功能蛋白复合体及其在不同条件下的功能变化(聚合/解离状态)(图1 C-F)。
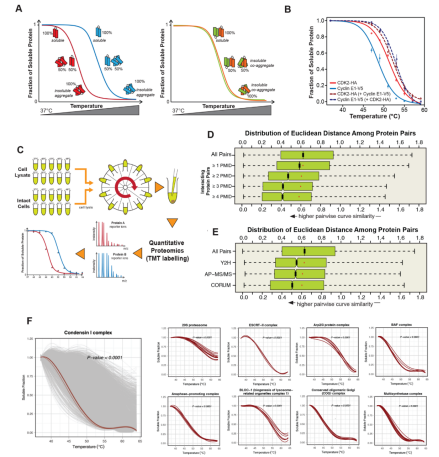
图1 TPCA技术
2.2 研究背景:
黎芦胺(Veratramine,VAM)是从藜芦根茎中分离出来的一种生物碱,前期研究表明VAM具有广泛的抗癌细胞增殖和转系作用。在本研究的前期实验中,也证实VAM在时间和浓度依赖性实验中,对三种人类三阴性乳腺癌(TNBC)细胞系呈现出显著的抗增殖效果。鉴于此,本研究创新性地尝试整合TPP-TPCA技术,旨在深入探究VAM抗癌效应的分子机制。
3.研究样本与实验设计
3.1 研究样本
细胞系选取人类三阴性乳腺癌细胞系MDA-MB-231和MDA-MB-436;动物模型采用小鼠(肿瘤异种移植模型)。
3.2 质谱检测样本数量
在ITSA药物靶点筛选实验中,设置20/100μM两种药物处理浓度以及对照组,每组进行3次重复实验,共计9个样本。TPCA实验设置0/2/4/6h四个时间点,每个时间点的样本分别在37/46/55/61℃四个温度点进行处理,同时每个条件设置3次重复,共计48个样本(如图2所示)。
3.3 实验设计
本研究运用TPP-TPCA策略开展VAM靶点筛选以及分子机制研究。后续结合多种分子生物学技术手段,对筛选出的靶点及其作用机制进行全面验证。
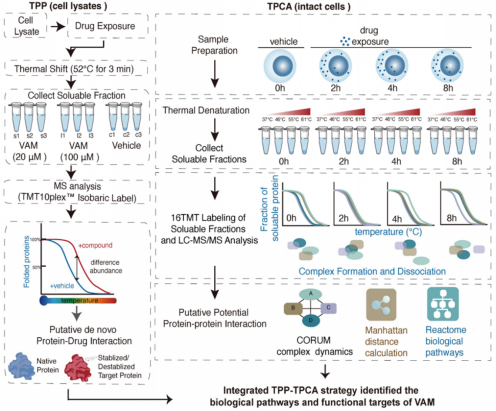
图2 研究实验设计
4.实验结果
4.1 TPP-TPCA策略识别VAM靶点和生物学过程
在ITSA实验中,研究共鉴定出5170个蛋白。通过对三个比较组进行ANOVA分析,成功筛选出68个差异蛋白。在TPCA实验中,借助CORUM数据库分析,识别到3550个蛋白(复合体),其中有126个蛋白(复合体)在2/4/8h时发生了显著变化。TPP-TPCA策略发现了20个相同的靶蛋白以及下游受扰动的蛋白质复合物。多个蛋白复合体的功能与囊泡介导的转运密切相关,尤其是V-ATPase,作为胞内溶酶体系统的pH传感器,极有可能与VAM的作用机制存在关联。因此,作者选定ATP6V1C1靶点及其复合体展开后续的验证分析。
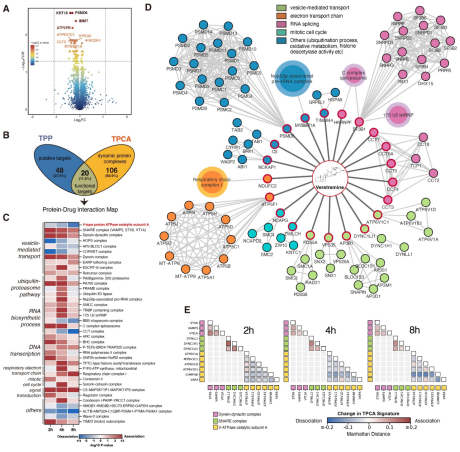
4.2 ATP6V1C1靶点验证
研究通过CETSA、ITDRF实验,有力地验证了VAM与ATP6V1C1的结合。利用ITC技术,精确测定了ATP6V1C1与VAM的结合常数。为了深入分析VAM作用于ATP6V1C1并导致V-ATPase解聚对溶酶体功能的影响,研究采用纯化的溶酶体测定VAM对V-ATPase活性的影响,结果发现VAM能够以剂量依赖的方式抑制V-ATPase的活性。
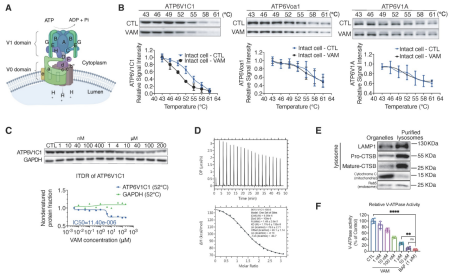
图4 ATP6V1C1靶点验证
4.3 VAM损伤溶酶体酸化和溶酶体酶活性
V-ATPase是维持溶酶体酸性环境的关键质子泵。本研究旨在检测VAM抑制V-ATPase活性是否会对溶酶体酸化和货物降解产生影响。研究采用红荧光染料DND-99示踪活细胞中的酸性细胞器,结果显示,经VAM处理后,溶酶体失去酸性特征。使用分子探针DQ™红色BSA,它可在酸蛋白酶的作用下水解为单个染料标记的肽,并在溶酶体酸性环境中产生明亮的荧光产物。在BAF和VAM处理组中,观察到红色荧光显著降低,这表明溶酶体蛋白水解活性受到损害。此外,研究还分析了负责驱动蛋白水解的溶酶体蛋白酶,即组织蛋白酶B(CTSB)和D(CTSD)的蛋白质水平。CTSB和CTSD最初以非活性前体形式存在,它们在酸性环境下通过顺序酶促裂解被激活。研究发现,VAM显著降低了CTSB和CTSD的成熟程度。总体而言,VAM通过与ATP6V1C1结合,有效阻止了溶酶体酸化,抑制了蛋白水解活性。
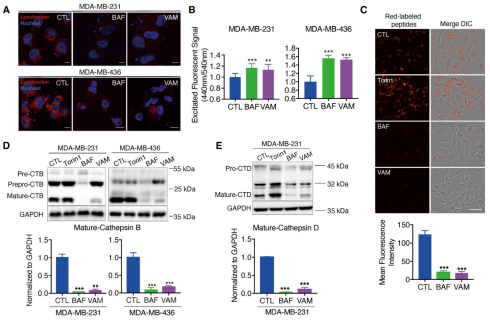
图 5 VAM损伤的溶酶体酸化和溶酶体酶活性
由于溶酶体与自噬过程紧密相关,研究进一步探究VAM是否会对自噬产生影响。如图6所示,对LC3和SQSTM1等自噬标志蛋白的检测以及免疫荧光实验结果表明,VAM通过抑制自噬体和溶酶体的融合,破坏了自噬过程,阻碍了自噬底物的降解。
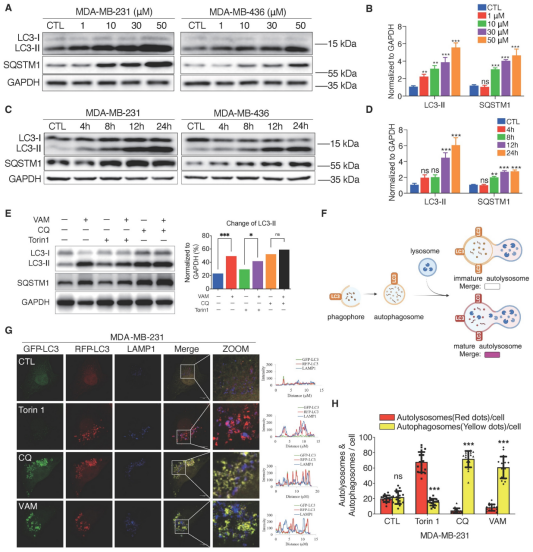
图 6 DIPY机制研究-CREB1
4.4 VAM增强了阿霉素的治疗功效
自噬调节在肿瘤化学抗性中起着至关重要的作用。因此,研究进一步分析了VAM与抗癌剂阿霉素(DOX)联合使用时,是否能够提高抗肿瘤效率。结果显示,DOX单独作用会诱导乳腺癌细胞启动保护性自噬;而VAM和DOX联合使用,显著阻碍了自噬体的成熟,增强了DOX的促凋亡功效。在异种移植实验中也观察到了相同的现象。总体而言,这些发现表明,乳腺癌细胞上调自噬是化疗期间的一种防御机制,而VAM抑制自噬/溶酶体功能能够在体内外提高肿瘤对化学药物的敏感性。
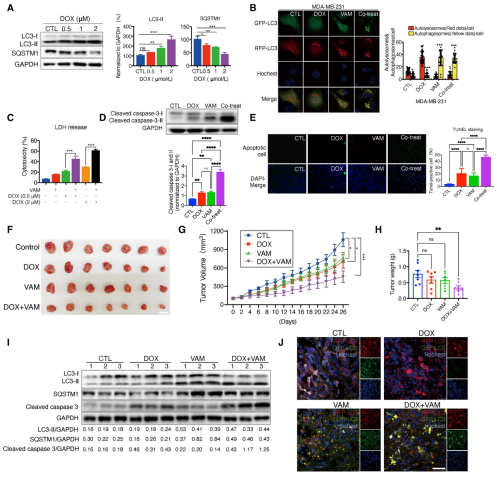
图7 VAM在体内外增强DOX的抗肿瘤作用
4.5 ATP6V1C1的表达水平与多种肿瘤的进展相关
研究利用TCGA和GTEX数据集,对33种肿瘤及相应的正常(或相邻癌症)组织的ATP6V1C1表达水平进行了评估。结果显示,ATP6V1C1在大多数(n=25)肿瘤中呈现高表达状态。KM分析表明,ATP6V1C1高表达患者的预后明显恶化。
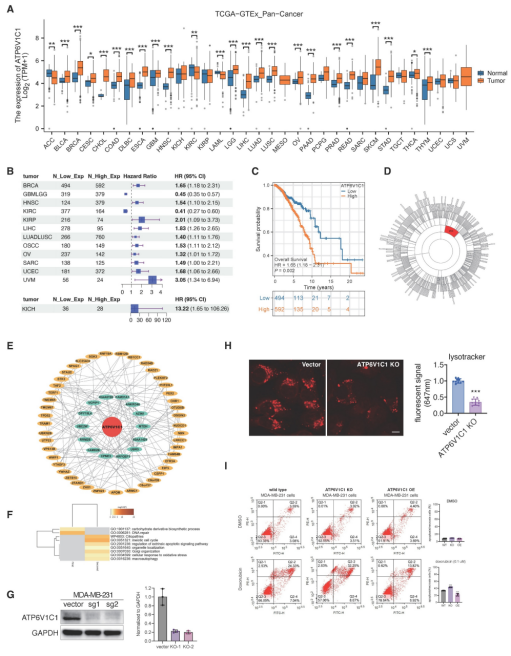
图8 ATP6V1C1的表达水平与肿瘤进展相关
5.结论
本研究成功应用TPP-TPCA策略,精准识别出天然化合物VAM的靶标ATP6V1C1。研究证实,该药物通过直接与ATP6V1C1结合,有效抑制V-ATPase催化活性,进而破坏溶酶体酸化,最终干扰了对癌细胞存活至关重要的自噬-溶菌体途径。进一步的数据集分析显示,ATP6V1C1在多种肿瘤中表达上调,这暗示其有可能成为多种癌症治疗的潜在靶点。
6.总结
研究开创了一种整合热蛋白质组分析和热邻近共聚集(TPP-TPCA)的研究策略,实现了对天然产物VAM的靶点筛选和作用机制研究。
研究亮点:蛋白质组分析和热邻近共聚集(TPP-TPCA)策略巧妙地将功能靶点与下游扰动蛋白质复合物联系起来,实现了高效的靶标识别与功能验证。同时,研究从ATP6V1C1靶点出发,深入探究了V-ATPase蛋白复合体、溶酶体以及肿瘤细胞自噬整个功能通路,研究脉络清晰。
不足之处:TPCA方法依赖于现有的蛋白复合体数据库,且仅适用于研究复合体的结构/功能变化。此外,其他靶点对VAM抗增殖作用的潜在贡献尚不明确,这也反映了剖析天然产物多目标机制的内在复杂性。
谱度众合推出的TPP药物靶点筛选解决方案,提供6-10个温度点的经典流程和单温度点的简化流程供客户选择,适配多种药物类型分子和体内外给药实验设计。实验体系经反复测试优化,数据分析围绕目的设计,提供药物靶点的筛选分析、候选靶点的功能注释、以及候选靶点的分子对接初步验证。TPP药物靶点筛选解决方案致力于直接回答客户的研究目的,助力客户更轻松高效的完成科研目标。如果各位老师对药物靶点筛选感兴趣的话,欢迎与我们取得联系~
文献原文:
Zhang S, Li FM, Wang J, Dong Y, Luo JF, Huang XF, Li Y, Zhu GY, Qi SQ, Shen HM, Zhong Q, Ming C, Zeng KW, Yao XJ, Tan CSH, Lu JH. Integrated thermal proteome and thermal proximity co-aggregation profiling identifies ATP6V1C1 as a novel anti-cancer drug target. Int J Biol Sci. 2025 Apr 28;21(7):3197-3213. doi: 10.7150/ijbs.106843 PMID: 40384877.




















 2484
2484

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








