用于可穿戴和医疗设备的卷对卷凹版印刷电化学传感器
马利卡·巴里亚1,2,3*, 齐巴·沙帕尔1,2,3*, 朴惠珍4,孙俊峰4,郑延洙4,高伟1,2,3 , 尼因因奈1,2,3,蒂芙尼·孙·刘1,2,3,戴立家1,2,3,阮玉英 1,2,3, 赵明汉1,2,3,赵英博1,2,3,马 克·赫蒂克1,2,3,曹教真4,‡, 阿里·贾维1,2,3‡
1电气工程与计算机科学系,加州大学伯克利分校,加利福尼亚州伯克利,美国,邮编 94720。2伯克利传感器与执行器中心,加州大学伯克利分校,加利福尼亚州伯克利,美国,邮编 94720。3材料科学部,劳伦斯伯克利国家实验室,加利福尼亚州伯克利,美国,邮编 94720。4印刷电子工程系,顺天国立大学,韩国顺天市中区 Jungang‐ro 255 号。*这些作者对本工作有同等贡献。 ‡电子邮件: ajavey@berkeley.edu, gcho@scnu.ac.kr
关键词 可穿戴生物传感器,柔性电子,卷对卷加工,凹版印刷,多路复用传感,原位分析
摘要
随着无创生物传感器的最新发展推动个性化健康与健身监测的进步,人们迫切需要高通量、低成本制造柔性传感组件。为实现这一目标,我们提出了在多种电化学传感应用中均表现出良好稳定性的卷对卷(R2R)凹版印刷电极。我们采用专为电化学和机械稳定性设计的油墨和电极形貌,在150米长的柔性基底卷材上实现了具有均匀氧化还原动力学的器件。我们展示了这些电极可被功能化为性能始终优异的传感器,用于检测无创获取的生物流体中的离子、代谢物、重金属和其他小分子,包括在运动过程中用于实时、原位汗液监测的传感器。这种坚固且多功能的卷对卷凹版印刷电极的发展,是实现一次性可穿戴传感器大规模、低成本制造的关键转化步骤,有望应用于个性化健康监测。
近年来,能够从分子水平探测人体生理状态的可穿戴生物传感器蓬勃发展,为实现个性化的即时检测健康与健身监测展现出巨大前景。1–13 特别是,可穿戴电化学传感器的进步使得无创检测多种物质成为可能,这些物质包括离子、代谢物、酸、重金属和醇类,可在汗液、唾液、泪液和尿液等生物流体中进行检测。4,10,14 一些最成功的平台采用混合电子器件,将可贴合人体的柔性传感组件与传统硅基集成电路在信号调理和传输方面的高性能、低功耗优势相结合。1–3 ,5,7,13 在医学筛查或运动监测的许多应用中,传感组件在一次性体内使用后丢弃较为方便。在这种情况下,同类型的传感器必须具有一致性性能,以确保每次将新的传感组件插入设备时,只需最少的校准即可准确地将传感器信号转换为有意义的浓度读数。这可以最大限度地减少传感器使用相关的额外开销,是推动可穿戴原型设备走出研究环境的重要实际考量。因此,开发具有高均匀性的高通量、成本有效的方法来制造传感组件,对于可穿戴电化学器件的商业可行性至关重要。
卷对卷(R2R)印刷技术具有增材特性和高加工速度,相较于光刻技术等传统方法,在柔性基底上实现电子元件的高通量制造方面具有优势。在现有的各种印刷技术中,卷对卷凹版印刷表现出显著的实用性,因其本质上具有良好的鲁棒性和大面积兼容性,非常适合低成本元件或器件的工业化规模生产。15,16此外,卷对卷凹版印刷简单的印刷机械结构使其相比丝网印刷、胶版印刷或柔版印刷能够实现更快的印刷速度,并具备更高分辨率和一致性。15正因如此,卷对卷凹版印刷此前已被用于打印柔性电子器件,包括薄膜晶体管、无线循环伏安法标签以及基于碳纳米管的触觉传感器有源矩阵,但在近年来可穿戴电化学生物传感器的发展背景下,该技术的应用仍显不足。17–20具体而言,为了推进近年来提出的可穿戴传感平台,有必要将传感器制造转向高通量技术,以在大尺寸基材上实现一致的器件性能,同时在同一器件上支持多重和复杂的检测机制。尽管过去已有利用凹版印刷进行生物传感器制造的研究,但针对卷对卷凹版印刷的相关工作仍然有限,且缺乏对大尺寸基材上性能差异的评估。21–24与传统卷对板技术相比,卷对卷凹版印刷涉及张力下的移动薄膜以及刮刀所受更大的剪切应变;因此必须针对这些更严苛的条件调整印刷条件和油墨,以确保沉积图案的保真度。其次,先前研究主要集中在仅需打印两个简单金属电极的阻抗式器件。为了支持多种安培法和伏安法技术,特别是使用低成本油墨时,有必要打印更复杂、多层的图案,以实现具有稳定参比电极的三电极系统并导电且惰性的工作电极和对电极。最后,关键是要证明这些电极可以功能化为传感器,并在延长的测量时间内原位可靠地工作。在此工作中,我们优化了油墨流变性、印刷条件和电极形貌,以解决上述问题,从而能够在大尺寸基材上进行可靠且稳健的卷对卷凹版印刷电化学电极阵列,且性能差异有限。
我们展示了可功能化为传感器的卷对卷凹版印刷电极,适用于多种电化学传感应用 (图1)。该电极阵列实现了包含工作电极、参比电极和对电极的标准三电极系统(图2), 可用于检测离子、代谢物、重金属和其他小分子。在长达150米的柔性基底上进行大规模、 高通量制造,使这些电极可作为低成本一次性试纸用于医学诊断或筛查。它们还设计为与 先前报道的原位汗液监测平台兼容,可用于可穿戴传感应用,包括在运动期间连续追踪生 理指标。1这些印刷电极具有惰性、柔韧性和在佩戴使用过程中承受机械应变的坚固性, 并具备稳定的电化学性能,这对于可靠提取生理数据至关重要。
需要特殊的油墨配方,以在卷对卷凹版印刷的物理限制下实现可打印性。一个重要 的结果是,与丝网印刷(可达100 μm)相比,沉积的油墨层相对较薄(最多约10 μm), 从而形成电阻特性更强的结构。25由于丝网印刷仅通过厚碳层即可制造导电且惰性电极, 而卷对卷凹版印刷所沉积的薄碳层则无法满足要求。为解决这一问题,我们设计了一种 双层工作电极形貌,其底层为银油墨层,以赋予导电性,并通过上层碳层进行钝化,以获得用于检测化学物质或氧化还原过程的电 化学惰性表面。参比电极单独使用银墨,而开发了一种绝缘聚乙烯树脂基油墨,用于包 覆暴露的电极丝,防止在水环境中发生串扰或短路。这种改进的电极结构弥合了稳定电 化学功能需求与良好可打印性在卷对卷凹版印刷中的差距。
我们设计了具有毫米级尺寸的电极,以满足三个标准:用户舒适度、足够的生物流 体获取以及与卷对卷凹版印刷系统的兼容性。毫米级传感器足够小,佩戴时不易察觉, 同时又足够大,能够有效接触汗腺等生物流体分泌部位。在额头或手臂上,汗腺密度通 常约为1.5个腺体/平方毫米2 ,运动期间每个腺体产生数十纳升/分钟/腺体的汗液26 。因 此,一个3毫米直径的传感器每隔几分钟便可获取数微升新鲜汗液,足以提供稳定且近实 时读数所需的液体体积。基于这些原因,并考虑到卷对卷凹版印刷技术在打印毫米级特 征时具备优异的图案保真度和产量,我们设计并评估了直径分别为3毫米、1.5毫米和 0.75毫米的电极,应用场景包括汗液监测。15随后,我们选择1.5毫米电极进行更全面的 器件性能变异性研究。
结果与讨论
我们对油墨流变性进行定制,以结合可打印性要求与机械和电化学稳定性。在综合 考虑表面张力、粘度、润湿特性以及其他打印参数的基础上,实现最少缺陷或针孔的涂 层(表S1)。通过扫描电子显微镜和轮廓仪测量,我们确定印刷银墨层平均为250纳米厚, 表面粗糙度20纳米。碳层为1.3微米厚,粗糙度为0.5微米,绝缘层厚度为1.5微米,粗糙度低于10纳米。电极的表面粗糙度在图 2(d)‐(e)的表面扫描电子显微镜图像中明显可见,显示出由油墨中纳米颗粒成分引起的亚 微米特征。这些纳米颗粒并未显著增加电极总体表面积,因此对传感性能影响有限。27–29相反,它们主要用于确保油墨的稳定性和可加工性。30,31银层主导了电极的电导率, 在最终打印形态下其电阻率为1.8 x 10-4 Ω·cm,与其他用于凹版印刷的导电银油墨相当。32
固态电化学电极的性能在很大程度上取决于活性电极区域的表面特性和状态。预处 理步骤,包括热处理和电化学过程,常用于通过去除电极表面的杂质并提高对氧化还原 事件的表面敏感性来激活碳基电极。33为了在测量前激活凹版印刷的电极阵列,我们采 用了一种优化的预处理序列,包括在160 °C下退火1小时,随后在稀盐酸中通过循环伏安 法(CV)进行电化学清洗。为了研究这些程序中的每一步如何影响电极表面组成,我们 在预处理过程的不同阶段停止代表性样品,并使用单色Al源进行XPS核心能级测量。同 时,我们探索了这些样品对[ Fe(CN6)] 4-/[ Fe(CN6)] 3-氧化还原电对的电化学灵敏度。补 充信息中的图S1总结了这些结果,以展示预处理对电极表面组成和电化学性能的影响。 图S1(a)‐(c)显示,在预处理过程中,电极传递氧化还原事件的能力逐步增强,这体 现在[ Fe(CN6)] 4-/[ Fe(CN6)] 3-氧化和CV测量中的还原峰。预处理过程中碳电极表面组成的变化包括碳‐碳键与碳‐氧键的比例 增加,这通过其相对的C 1s子峰面积得以证明(图S1(d)‐(f))。银电极表面氧含量的组 成变化则不那么显著,如Ag 3d子峰的相对面积比所示(图S1(g)‐(i))。总体而言,预处 理通过热处理和电化学方式去除印刷过程中的溶剂和残留物,从而提高电化学灵敏度并 调节表面组成。
预处理电极阵列表现出一致的电化学性能,且在不同电极尺寸和整个凹版印刷卷材 上均保持稳定(图3)。选择在10 mM铁氰化钾(K3[ Fe(CN)6])溶液中进行循环伏安法 测试,以验证电极对[ Fe(CN6)] 4-/[ Fe(CN6)] 3-氧化还原电对之间发生氧化和还原事件的 响应能力。图3(a)显示了不同直径电极的CV结果。氧化峰与还原峰之间的分离大于能斯 特理想值60 mV,并随电极表面积增加而增大。这种行为在碳电极中较为常见,历史上 碳糊电极表现出较宽范围的峰间分离。34–37这源于碳糊电极相比金属电极更慢的电子转 移动力学,以及工作电极堆和周围溶液中的电阻损耗。峰位置受多种因素影响,包括电 极表面形貌和组成、预处理过程以及未补偿电阻损耗。34,35,38在图3(a)中,尽管阴极峰特 别明显,CV氧化和还原峰相对于斜坡基线具有相似的面积,表明阳极和阴极电荷相当。 面积上的微小差异可归因于电极和实验参数引入的电化学不可逆性。然而,峰值电流随 电极面积呈线性变化,符合预期。此外,在初始稳定后,CV响应曲线在多个扫描周期内漂 移较小,表明系统具有稳定的传感性能(图3(b))。
为了更全面地分析电极均匀性,选择了1.5毫米直径电极,以比较来自印刷卷材不同 位置的电极的CV结果。具体而言,我们测试了印刷卷材20米段内的52个电极阵列;即, 每个凹版滚筒完整图案单元各取一个电极阵列,以评估印刷单元之间的差异。还原峰电位 和电流这两个关键参数以直方图形式对52个电极进行比较,显示出紧密的分布,平均峰 值电流为‐17.2 ± 1.6微安,电位为0.38 ± 0.01 V(图3(c)‐(d))。这些参数的低离散度表 明,电极在印刷卷材的大面积区域上具有均匀特性及性能。总体而言,CV测量的稳定性 和重复性突显了这些电极在即时检测应用中的实用性,因为在这些应用中可靠的传感器性 能至关重要。
生物流体含有丰富的分析物,包括电解质、代谢物、重金属和其他小分子。检测这 些物质需要采用不同的电极功能化方法以引入选择性识别元件,以及不同的电化学检测 方案。为了证明印刷电极适用于多种传感模式,我们将其功能化为用于检测pH值、钾离 子(K+)、钠离子(Na+)、葡萄糖、铜(Cu2+)和咖啡因的传感器。离子传感需要通 过电沉积形成离子‐电子转导膜,并涂覆选择性膜层,以优先将目标离子富集到电极表面, 采用电位检测法。葡萄糖传感器制备涉及在涂覆包埋在水凝胶中的酶之前沉积介体层, 并依赖安培检测。重金属传感则结合预富集技术与方波溶出伏安法(SWSV),以检测 与氧化还原峰相关的信号。
目标金属离子的电沉积。咖啡因检测采用差分脉冲伏安法(DPV)来类似地检测目标分 子的氧化还原转化。39图4展示了利用这些制备工艺和检测方案在不同分析物浓度的缓冲 溶液中制备和表征传感器的结果。在与每种分析物相关的生理相关浓度范围内,传感器 保持线性校准曲线。此外,在每个浓度下的测量过程中表现出良好稳定性,表明这些器 件性能优异,在宽电位范围内具有强健性,可用于多种传感应用,证明了底层电极的高 质量。
为了进一步表征在卷对卷印刷电极阵列上制备的传感器的性能,我们选择一种类型 的传感器,并对其在长期和重复使用条件下的鲁棒性进行广泛测试。同时,我们评估一 批类似制备的传感器之间的性能一致性。在这些测试中,我们使用来自整个印刷卷材上 的1.5毫米直径电极,并通过在工作电极上进行苯胺的电聚合将其功能化为pH传感器。图 5(a)显示了一个代表性pH传感器在不同pH值的麦克伊尔文缓冲溶液序列中的长期测量结 果。在45分钟间隔内,其接近能斯特响应的灵敏度保持为‐54.2 mV/pH,漂移幅度低于 3.5 mV/小时。图5(b)表明,当在不同pH值的缓冲溶液中循环时,该传感器响应一致, 浓度循环之间的信号差异小于1 mV,显示出良好的重复性。图5(c)描绘了来自整个凹版 印刷卷材上制备的40个pH传感器灵敏度的直方图,整体平均灵敏度为‐53.8 ± 0.9 mV/pH,而图5(d)则比较了它们在单一pH值下的电位响应,以展示其电压信号的基线 变化。灵敏度的低离散度证实,单点校准足以将任意一个pH传感器的电信号转化为有意义的pH测量,使这些传感器在实际应用中易于使用且准备成本低。
在缓冲溶液中进行台式表征后,我们证明了基于印刷电极的传感器在汗液、尿液和 唾液等生物流体中同样表现出高性能。选择钠+作为目标分析物,因为其在这些生物流 体中的浓度与评估肾病、心力衰竭及其他健康并发症相关,同时也可用于监测运动过程 中电解质流失或脱水情况。1 , 40–43钠+传感器被制备在印刷电极阵列上,并通过多点校 准进行表征以确定其浓度‐电位曲线。该信息用于将传感器信号准确转换为汗液、尿液和 唾液样本的浓度测量值。传感器结果与电感耦合等离子体光谱法(ICP‐MS)进行了比 较,后者是测量离子含量的标准方法(表1)。对于所有测试样本以及钠+浓度跨越多 个数量级的情况,传感器与ICP‐MS结果之间均表现出良好的一致性。这凸显了基于打 印阵列的传感器在多种生物流体中对分析物进行准确且宽范围定量的可靠性。
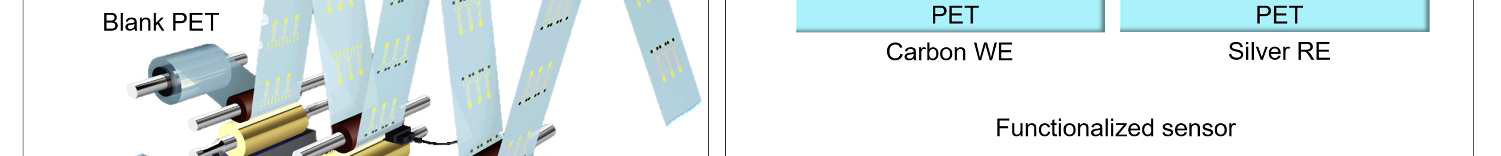
 在柔性PET上卷对卷凹版印刷生物相容性电极阵列 基底可实现高通量、低成本的传感电极生产,且电极具有可控的尺寸和密度。为打印电 极阵列,需依次沉积三层油墨,包括银、碳和绝缘层。b) 卷对卷凹版印刷系统的图像, 各层对应的模块化单元已标注。c) 凹版印刷的碳和银电极在打印后以及功能化后的截面 示意图。在工作电极(WE)上沉积用于选择性靶向分析物的膜,同时银电极也可进行修 饰以实现稳定参比(RE)。d) 凹版印刷电极可功能化为传感器,用于原位传感应用,例 如对汗液中的分析物谱型进行连续实时监测。这些传感器可与定制印刷电路板集成,实 现现场信号处理与传输,并将整个设备作为‘智能’腕带在运动期间佩戴,以便方便获 取汗液。)
在柔性PET上卷对卷凹版印刷生物相容性电极阵列 基底可实现高通量、低成本的传感电极生产,且电极具有可控的尺寸和密度。为打印电 极阵列,需依次沉积三层油墨,包括银、碳和绝缘层。b) 卷对卷凹版印刷系统的图像, 各层对应的模块化单元已标注。c) 凹版印刷的碳和银电极在打印后以及功能化后的截面 示意图。在工作电极(WE)上沉积用于选择性靶向分析物的膜,同时银电极也可进行修 饰以实现稳定参比(RE)。d) 凹版印刷电极可功能化为传感器,用于原位传感应用,例 如对汗液中的分析物谱型进行连续实时监测。这些传感器可与定制印刷电路板集成,实 现现场信号处理与传输,并将整个设备作为‘智能’腕带在运动期间佩戴,以便方便获 取汗液。)
 在150米长的聚对苯二甲酸乙二醇酯(PET)基底上卷对卷凹版印刷的电极, 插图为直径从3毫米到0.5毫米的电极。红色框出的电极阵列在下一图中放大显示。b) 光学显微镜图像显示直径为3毫米的电极阵列,包括碳工作电极、银参比电极、碳对电 极和绝缘层。c) 碳工作电极截面的伪彩色扫描电子显微镜图像,显示碳油墨(黄色) 在银墨(蓝色)之上、PET基底上的分层结构。层边缘的轻微变形是为暴露截面切割时 产生的伪影。d) 碳电极表面的扫描电子显微镜图像,以及e) 银电极表面的扫描电子显 微镜图像,显示出纳米结构的油墨组分。)
在150米长的聚对苯二甲酸乙二醇酯(PET)基底上卷对卷凹版印刷的电极, 插图为直径从3毫米到0.5毫米的电极。红色框出的电极阵列在下一图中放大显示。b) 光学显微镜图像显示直径为3毫米的电极阵列,包括碳工作电极、银参比电极、碳对电 极和绝缘层。c) 碳工作电极截面的伪彩色扫描电子显微镜图像,显示碳油墨(黄色) 在银墨(蓝色)之上、PET基底上的分层结构。层边缘的轻微变形是为暴露截面切割时 产生的伪影。d) 碳电极表面的扫描电子显微镜图像,以及e) 银电极表面的扫描电子显 微镜图像,显示出纳米结构的油墨组分。)
 3 mm、1.5 mm和0.75 mm直径凹版的循环伏安图(CV) e 10 mM K3[ Fe(CN)6]中的印刷电极。碳电极构成工作电极和对电极,银电极作为参比电 极。插图:还原峰电流iP与电极直径的平方之间的线性关系,表明信号与电极表面积之间 存在线性关系,证实了不同电极尺寸下的一致性性能。该曲线取每种直径5个电极的CV响 应平均值,iP的标准偏差分别为0.75毫米电极2.2微安、1.5毫米电极2.0微安和3毫米电极 3.1微安。b) 3毫米电极阵列的多循环CV显示良好稳定性,经过初始稳定过程后,每次扫 描得到几乎相同的电流特性。插图:各循环间的还原峰电流比较,循环间漂移小于0.2微 安。c) 对整个印刷卷材中采集的52个1.5毫米直径电极阵列的CV性能进行直方图比较。 (c) 还原峰电流和(d) 还原峰电位的变化均较小,表明大面积区域的印刷卷材上电极质量 均匀性良好。)
3 mm、1.5 mm和0.75 mm直径凹版的循环伏安图(CV) e 10 mM K3[ Fe(CN)6]中的印刷电极。碳电极构成工作电极和对电极,银电极作为参比电 极。插图:还原峰电流iP与电极直径的平方之间的线性关系,表明信号与电极表面积之间 存在线性关系,证实了不同电极尺寸下的一致性性能。该曲线取每种直径5个电极的CV响 应平均值,iP的标准偏差分别为0.75毫米电极2.2微安、1.5毫米电极2.0微安和3毫米电极 3.1微安。b) 3毫米电极阵列的多循环CV显示良好稳定性,经过初始稳定过程后,每次扫 描得到几乎相同的电流特性。插图:各循环间的还原峰电流比较,循环间漂移小于0.2微 安。c) 对整个印刷卷材中采集的52个1.5毫米直径电极阵列的CV性能进行直方图比较。 (c) 还原峰电流和(d) 还原峰电位的变化均较小,表明大面积区域的印刷卷材上电极质量 均匀性良好。)
 pH传感器,b) 钾 (K+) 传感器, c) 钠 (Na+) 传感器,d) 葡萄糖传感器,e) 铜 (Cu2+) 传感器,以及 f) 咖啡因传感器。每 次浓度变化之间允许 30 秒 的静置时间以达到稳定。)
pH传感器,b) 钾 (K+) 传感器, c) 钠 (Na+) 传感器,d) 葡萄糖传感器,e) 铜 (Cu2+) 传感器,以及 f) 咖啡因传感器。每 次浓度变化之间允许 30 秒 的静置时间以达到稳定。)
 将pH传感器浸入一系列不同pH值的缓冲溶液中,并在每种溶液中测量15分钟。该传感器在长期测量中表现出良好稳定性且漂移较小,同时保持接近能斯特响应的灵敏度。b) 传感器在pH值为5、6和7的溶液中循环测试,对每个pH值均显示出稳定的信号,证明了其重复性。c) 制备了40个pH传感器,并使用pH值为5、6和7的校准溶液测量其灵敏度。平均灵敏度为‐53.8 ± 0.9 mV/pH,基于印刷电极的pH传感器表现出高均匀性的灵敏度和接近能斯特响应的性能。d) 将40个pH传感器在pH值为5的溶液中返回的电位值以直方图形式进行比较。标准偏差为16.0 mV,表明需要进行单点校准以获得精确的传感器测量结果。)
将pH传感器浸入一系列不同pH值的缓冲溶液中,并在每种溶液中测量15分钟。该传感器在长期测量中表现出良好稳定性且漂移较小,同时保持接近能斯特响应的灵敏度。b) 传感器在pH值为5、6和7的溶液中循环测试,对每个pH值均显示出稳定的信号,证明了其重复性。c) 制备了40个pH传感器,并使用pH值为5、6和7的校准溶液测量其灵敏度。平均灵敏度为‐53.8 ± 0.9 mV/pH,基于印刷电极的pH传感器表现出高均匀性的灵敏度和接近能斯特响应的性能。d) 将40个pH传感器在pH值为5的溶液中返回的电位值以直方图形式进行比较。标准偏差为16.0 mV,表明需要进行单点校准以获得精确的传感器测量结果。)
 在试验开始时,骑行功率逐渐增加,然后保持稳定。b) 实时汗液pH测量显示初始阶段逐渐上升,随后在整个运动过程中保持稳定,与使用商用pH计对收集的汗液样本进行的离体测量结果一致。骑行11分钟后开始出汗,但由于积聚的汗液量过少,传感器在前14分钟内未显示读数,无法产生有效响应。c) 通过将传感器阵列配置定制PCB以实现信号处理和向智能手机的无线传输,从而实现连续pH分析。)
在试验开始时,骑行功率逐渐增加,然后保持稳定。b) 实时汗液pH测量显示初始阶段逐渐上升,随后在整个运动过程中保持稳定,与使用商用pH计对收集的汗液样本进行的离体测量结果一致。骑行11分钟后开始出汗,但由于积聚的汗液量过少,传感器在前14分钟内未显示读数,无法产生有效响应。c) 通过将传感器阵列配置定制PCB以实现信号处理和向智能手机的无线传输,从而实现连续pH分析。)
| 生物样本 汗液1 汗液2 尿液1 尿液2 唾液1 唾液2 | 测量 Na + |
|---|---|
| 生物样本 汗液1 汗液2 尿液1 尿液2 唾液1 唾液2 | Na+传感器 电感耦合等 离子体质谱 法 101.2 101.8 65.2 65.2 137.6 137.4 109.3 110.4 11.8 11.9 4.7 5.0 |
表1. 使用卷对卷印刷电极基钠+传感器与电感耦合等离子体光谱法(电感耦合等离子体质谱法)对采集的生物流体样本进行离体钠含量检测。该传感器在汗液、尿液和唾液样本中的测量结果与电感耦合等离子体质谱法结果一致,覆盖宽浓度范围。对于电感耦合等离子体质谱法,样品在测量前经过稀释,并对所得浓度信号进行了适当补偿。钠+ 传感器事先通过多点校准进行表征,以将电压信号转换为浓度测量值。
尽管连续在体传感展示了这些基于打印电极的生物传感器的应用潜力,但它们也适用于医学筛查应用中的一次性使用。卷对卷凹版印刷电极具有高通量、低成本生产的优势,并且能够轻松与定制PCB等信号调理器件连接,因此非常适合作为低成本一次性试纸,应用于囊性纤维化诊断或汗液葡萄糖监测。此外,大规模生产高度均匀的传感器有助于研究无创获取的生物流体的生理相关性。性能一致的卷对卷印刷电极使得开展人群研究成为可能,从而深入了解汗液、唾液、尿液或泪液生物标志物如何反映整体健康与体能。未来,凹版印刷技术可进一步拓展为直接在底层电极上打印功能传感膜。通过提高对准精度和分辨率,可以制造出高度微型化的微电极,以实现植入式设备和体内传感。15还可以实现更复杂的分层结构,包括将氧化还原缓冲剂集成到电极堆叠中,以提高电位的可重复性,实现免校准传感。45最终,这些传感器制造工艺可与微流控和电子元件的卷对卷集成相结合,从而实现完整的可穿戴传感器件的高速、大规模生产。
结论
总之,我们设计了用于多种无创生物传感应用的卷对卷凹版印刷电极,旨在实现即时健康监测和诊断。通过精确调控的油墨配方和印刷层堆叠,这些电极表现出稳定的氧化还原动力学,并在多种传感模式下均具有优异性能。它们可被功能化为针对离子、代谢物和重金属等分析物的传感器,既适用于生理指标的连续原位监测,也适用于医学筛查的离体单次测量。我们展示了在大面积柔性基底上的高通量制造,能够低成本、大规模生产一次性传感组件,用于可穿戴混合电子器件,从而推动分子水平的个性化健康监测惠及更广泛人群。
方法
油墨配方
电极油墨的配制旨在克服银墨在水环境中的溶解、功能化传感器的漂移以及电极脱层等问题在体表穿戴的机械应变下保护各层。为此,需要优化粘结剂和溶剂含量,并改善绝缘油墨的可打印性,以沉积足够厚的涂层来封装电极丝,并在原位使用期间防止其受到磨损。最终成功满足稳定性和可打印性要求的油墨配方如下所述。从韩国InkTec公司购买的原始银分散液(TEC‐PR‐041)经过重新配制,以实现在水环境中的稳定性。通过添加聚合物粘结剂优化了银油墨的粘度和润湿性能。具体而言,将2 g分子量为272.341 g/mol的聚乙烯醇缩丁醛(PVB)(西格玛奥德里奇)溶解于18 g萜品醇中,制成PVB溶液用于调节粘度和润湿性。通过向银分散液(TEC‐PR‐041;韩国InkTec公司)中加入10 重量百分比的PVB粘结剂溶液,将粘度和表面张力分别调整至100 cp和31 mN/m,从而获得高质量银印电极。对于碳工作电极和对电极,采用碳浆(DC‐15;韩国Dozen TECH公司)稀释于ECA(二乙二醇单乙醚醋酸酯)中,调节至粘度为350 cp后,在银层上印刷碳油墨。用于钝化印刷银线路的绝缘油墨是通过将20 g聚乙烯树脂(韩国大正化学)溶解于80 mL ECA中配制而成,所得油墨粘度为210 cp,表面张力为31 mN/m。
卷对卷凹版印刷
为了打印带有银、碳和绝缘油墨层的电极阵列,采用宽250毫米、厚100微米、长度可达150米的聚对苯二甲酸乙二醇酯(PET)薄膜(AH71D,韩国SKC公司)进行卷对卷凹版印刷。为实现连续印刷,使用了配备两个印刷单元的卷对卷凹版印刷设备(由韩国 I‐PEN公司制造),并结合自制的伺服机构系统,薄膜张力为5 ± 0.3 kgF。在印刷过程中,进行了叠印在温度为23 ± 2 °C、湿度为35 ± 2%的条件下,保持了± 20 μm的印刷注册精度。在第一个印刷单元,通过干燥室(150 °C)以6米/分钟的印刷速度印刷银电极并干燥1分钟。随后,在已印刷的银电极上印刷碳层以形成工作电极和对电极,并通过干燥室(150 °C)干燥1分钟。印刷卷材被复卷后,再以2米/分钟的速度通过150 °C加热室3分钟,进一步固化银和碳油墨。最后,在复卷的PET卷材上以相同的6米/分钟速度印刷绝缘层。完成150米PET基材上150,000个电极的三层印刷和固化所需的总印刷时间约为30分钟。卷对卷凹版印刷系统用于印刷电极阵列的参数总结见补充信息表S1。
电极预处理
为了提高电化学性能,需要进行预处理以通过增强电子转移动力学来激活碳电极表面。调整热退火和电化学酸预处理参数会影响电极CV曲线的稳定性,本文报道的最终预处理条件可提供优化的电极稳定性以及对氧化还原事件的灵敏度。为激活碳电极,预处理工艺分两个阶段进行。首先,将来自卷对卷凹版印刷卷材的阵列在160 °C下退火1小时,并使其冷却至室温。然后在0.1 M 盐酸中使用循环伏安法(CV)从0 到 0.8 V以100 毫伏/秒的速度进行10 个循环的电化学清洗,以进一步去除印刷过程中残留的残留物和溶剂。
传感器功能化
功能化传感层采用与我们先前研究1–3中所述相同的程序和配方在印刷阵列上沉积或生长。对于pH传感器,苯胺在使用前于100°C温度和13毫米汞柱蒸气压下进行蒸馏纯化。聚苯胺(PANI)在工作电极表面通过循环伏安法在0.1 M 苯胺/1 M H2SO4溶液中进行聚合和电沉积,电位范围为−0.2至1 V,扫描25个循环,速率为100 毫伏/秒。该程序与文献中先前报道的相同。3对于钠传感器,膜溶液由钠离子载体X(1%质量分数(w/w))、 Na‐TFPB(0.55% w/w)、聚氯乙烯(33% w/w)和DOS(65.45% w/w)组成。将 100毫克膜混合液溶解于660微升四氢呋喃中。对于钾传感器,膜溶液由缬氨霉素(2% w/w)、NaTPB(0.5%)、聚氯乙烯(32.7% w/w)和DOS(64.7% w/w)组成。将 100毫克膜混合液溶解于350微升环己酮中。对于钠和钾传感器,均选用PEDOT:PSS作为离子‐电子转换器,以最小化离子选择性电极(ISEs)的电位漂移,并通过恒电流电化学聚合将PEDOT:PSS沉积到工作电极上,所用溶液为0.01 M EDOT/0.1 M NaPSS。施加 14微安(2 mA cm−2)的恒定电流,在每个电极上产生10毫库仑的聚合电荷。在 PEDOT:PSS生长完成后,将10微升钠膜混合液和4微升钾膜混合液分别滴涂到对应的3毫米电极上,对于更小尺寸的传感器,混合液体积按面积缩小。对于两种传感器,印刷银电极均通过以下溶液制备成PVB参比电极:将79.1毫克PVB和50毫克NaCl溶解于1毫升甲醇中,加入36.2毫克F127和0.2毫克多壁碳纳米管以减少电位漂移。将10微升该溶液滴涂在3毫米银参比电极上,但对于更小尺寸的传感器则按面积进行缩放。该程序与文献中先前报道的功能化离子选择性电极。1对于葡萄糖传感器膜溶液,将1%壳聚糖溶液与2%乙酸在磁力搅拌下配制成。该膜溶液与葡萄糖氧化酶溶液(1毫克酶溶于pH 7.2的100微升磷酸盐缓冲液)按 1:1体积比混合。普鲁士蓝介体通过循环伏安法从0到0.5伏特相对于印刷银参比电极以 20毫伏/秒扫描一个循环,在含有2.5毫摩尔/升FeCl3, 100毫摩尔/升KCl、2.5毫摩尔/升 K3[ Fe(CN)6],和100毫摩尔/升盐酸的电镀溶液中沉积到碳工作电极上。将3微升膜溶液滴涂在3毫米电极上,并在室温下过夜干燥。对于较小电极尺寸,膜溶液体积根据电极面积进行相应调整。此步骤与文献中先前报道相同。1铜传感器通过直接使用预处理电极实现。在‐0.2伏特下进行30秒的预富集以使铜离子在电极上富集,随后采用方波溶出伏安法(SWSV)进行检测,如先前文献所报道。2咖啡因传感器通过在预处理电极上依次滴加 0.8微升乙醇中的0.01%多壁碳纳米管溶液和0.8微升0.01%纳氟离子交换膜溶液制备,方法如文献中先前报道。39
运动期间的在体测量
在加利福尼亚州加州大学伯克利分校进行的固定骑行期间的传感器测量,符合由伯克利机构审查委员会(IRB)批准的人体研究方案(CPHS 2014‐08‐6636)。所有受试者均签署了书面知情同意书。固定骑行使用电子制动式腿部功率计(凯特勒 E3 直立式健身车)。在固定传感贴片之前,受试者手腕用清水清洁并用纱布擦干。




















 67
67

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








