01 研究背景
子宫内膜癌中LATS1/2的高频突变与MHC-I表达下调的关联,提示了这两个Hippo通路核心激酶可能参与了免疫调控。然而,传统认知中LATS1/2主要通过磷酸化YAP/TAZ发挥作用,其是否以及如何调控MHC-I表达完全未知。STAT1作为干扰素信号通路的核心转录因子,已知可被JAK1/2磷酸化Tyr701,但其Ser727的磷酸化调控机制一直不明确。这两条线索交汇,催生了一个关键科学问题:LATS1/2是否直接磷酸化STAT1,从而影响MHC-I的表达?
02 验证策略
第一步:建立互作关系(细胞层面证据)。
研究团队首先在细胞环境中验证了LATS1/2与STAT1的物理相互作用。
内源性互作:在KLE子宫内膜癌细胞中,使用特异性抗体成功共沉淀出内源性LATS1/2-STAT1复合物;
外源性验证:293T过表达系统中,FLAG-LATS1/2与MYC-STAT1的双向免疫共沉淀确认互作特异性;
排除间接效应:后续的GST pull-down实验证明这种互作是直接的,无需其他哺乳动物蛋白辅助。
第二步:功能相关性验证(细胞表型关联)。
磷酸化水平检测:LATS1/2敲除显著降低细胞内STAT1 Ser727的基础及干扰素γ诱导的磷酸化水平;
功能挽救实验:回补野生型LATS1/2可恢复磷酸化,而激酶死亡突变体无效;
抑制剂验证:LATS1/2特异性抑制剂TDI-011536处理产生类似敲除效果。
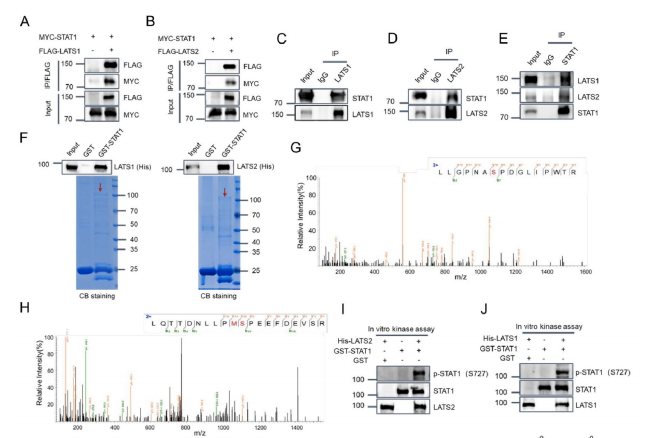
图1 验证LATS1/2可催化STAT1蛋白磷酸化(Yang et al., 2025)。
03 核心突破:体外激酶实验的设计与执行
1.蛋白制备策略
激酶选择:表达纯化LATS1/2的催化结构域(LATS1: 589-1130aa;LATS2: 480-1088aa),确保激酶活性
底物设计:采用STAT1全长蛋白及分段策略(N端1-650aa,C端650-750aa),精确定位磷酸化区域
2.反应体系优化
标准激酶缓冲液:20mM Tris-HCl (pH 7.5),5mM MgCl₂,5mM MnCl₂,2mM DTT
ATP浓度:10μM生理相关浓度
反应条件:30℃孵育30分钟,确保线性反应阶段
3.磷酸化位点鉴定
(1)质谱分析:将反应产物进行LC-MS/MS分析;鉴定到C端肽段TALISPMGSPR(S727磷酸化),首次发现N端肽段VLDGSLQEIQR(S532磷酸化);
(2)免疫印迹验证:使用p-STAT1(S727)特异性抗体,只有当LATS1/2存在时,STAT1的S727位点才发生磷酸化。
参考文献
1、Yang Q, Lv Z, Wang M, et al. LATS1/2 loss promote tumor immune evasion in endometrial cancer through downregulating MHC-I expression[J]. Journal of Experimental & Clinical Cancer Research, 2024, 43(1): 54.




















 1951
1951

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








