WB即Western Blot,蛋白质免疫印迹。是一种基于抗原抗体的特异性结合,半定量检测样品中某种蛋白的技术。作为分子生物学、生物化学和免疫遗传学中常用的一种经典实验方法,WB虽看似简单,却常因各种因素做不出好看的结果图,甚至拿不到结果。今天,伯小医就带领大家从头开始,一整个过一遍超详细的实验流程,保管你一学就会,结果图好看的让人敬佩!
1、实验原理
WB是一种把电泳分离的组分从凝胶转移到一种固相支持物(NC膜或PVDF膜),并以针对特定氨基酸序列的特异性试剂作为探针检测。WB采用抗体作为探针,抗体可以与附着在固相支持物的靶蛋白的抗原表位发生抗原-抗体免疫反应。这种技术的作用是对细胞或组织提取的蛋白混合物(即总蛋白混合物)中的某一特异蛋白进行鉴别和半定量分析,旨在鉴别特异性蛋白的类型(如亚型、聚体、剪切体等)和蛋白表达量的变化。
2、实验步骤
2.1蛋白提取
(1)准备:明确所检测目的蛋白的表达情况,有些蛋白可能只在部分细胞或者组织中表达,有些蛋白可能需要刺激才能表达或表达量增加,可通过已发表文献或者在线数据库如Uniport、NCBI和BIOGPS等,了解所研究蛋白的特点,正确选择和处理样本。
(2)蛋白提取:蛋白提取是WB实验的开端,裂解液的选择、样本的破碎方法、温度和变性等都会影响样本蛋白是否提取成功。蛋白提取整个过程都需严格在冰上操作,以减少高温造成的蛋白降解;若是磷酸化蛋白检测,提取液中需加磷酸酶抑制剂混合物。
下表是一些常见的不同类型样品的处理方法:

2.2蛋白浓度测定
取少量裂解液,用于蛋白质定量分析。蛋白质浓度测定的方法有凯氏定氮法、双缩脲法、Folin-酚试剂法(Lowry法)、BCA法和胶体金法。目前BCA法是广泛使用的蛋白定量方法,原理是在碱性环境下蛋白质分子中的肽链结构能与Cu2+生成络合物,同时将Cu2+还原成Cu+。BCA试剂可敏感特异地与Cu+结合,形成稳定的有颜色的复合物。在562nm处有高的光吸收值,颜色的深浅与蛋白质浓度成正比,可根据吸收值的大小来测定蛋白质的含量。
2.3制备SDS-PAGE凝胶
SDS-PAGE的目的是根据蛋白质的大小分离蛋白质。
SDS(十二烷基硫酸钠)是一种阴离子洗涤剂,由亲水的头基和疏水的尾基组成。因此,当溶解时,它的分子在很宽的pH范围内形成净负电荷。将SDS添加到蛋白质中使蛋白质变性,并使其具有均匀分布的净负电荷。这就使蛋白质在电泳过程中向正极迁移。
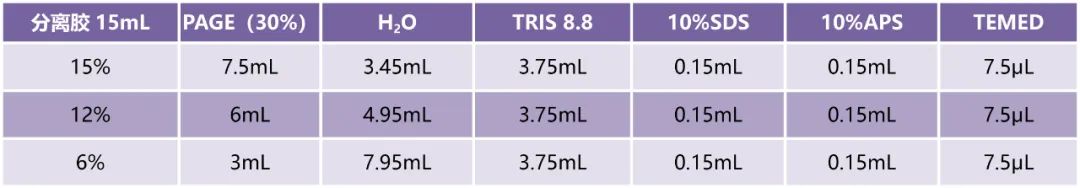
PAGE(聚丙烯酰氨凝胶电泳)是丙烯酰胺单体的聚合物,当这种聚合物形成时,它会变成凝胶,用电将蛋白质拉过凝胶,就会根据蛋白的大小很好的将蛋白分开。凝胶是由两种不同的凝胶层组成。上层为浓缩胶,下层为分离胶。浓缩胶为大孔胶,缓冲液pH6.8,分离胶为小孔胶,缓冲液pH8.8。
根据目标蛋白分子量大小、表达位置和样本数量确定分离胶和浓缩胶浓度、凝胶厚度和数量。
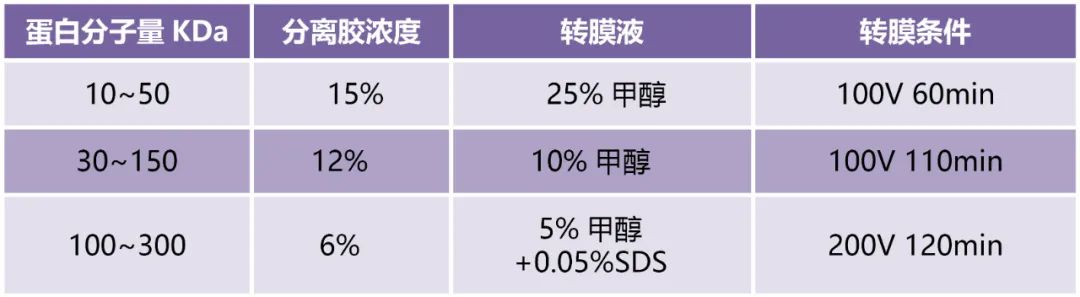

2.4上样电泳
知道每个样的蛋白浓度后,在上样时候保证一个泳道的蛋白总量为30μg(根据具体情况而定,一般不超过30μg)。同时需要保证每一个泳道上样体积保持一致,可用loadding buffer补足(可上30μL)。浓缩胶使用100V电压进行电泳,一般是30min(具体根据buffer是否到达浓缩胶与分离胶的交界处),进入分离胶以后可提高电压至150V进行电泳(一般1h),然后轻轻的将SDS-PAGE多余部分切割,浓缩胶与分离胶的交界处即可。

2.5转膜
目前WB转膜方法有湿转法和半干转法。半干转法,转膜时间短,速度快,所需缓冲液更少,但是干燥条件下转膜容易失败。湿转法,是比较常用的转膜方法,相较于半干转法,条带更稳定。
湿转法转膜一般是在转膜仪的负极(黑面),依次放入海绵、3层滤纸、凝胶、PVDF膜、3层滤纸、海绵(类似三明治结构),每放一层都要赶尽气泡,使滤纸与胶、胶与膜、膜与滤纸完全贴合。放好后,加满4℃预冷的转膜液,设置转膜仪,充分把握好转膜的时间,时间过长会导致蛋白条带从PVDF膜上穿透除去。
注意:转膜时胶在负极,膜在正极,不能放反,接通电源时亦不能反,否则蛋白就转到滤纸上了;冰浴湿转效果更好;制作转膜三明治时,一定要赶尽气泡,否则有气泡的地方蛋白结合不到膜上,显影时膜上会出现气泡。

WB转印膜有硝酸纤维素膜(NC)、尼龙膜和PVDF膜,目前常用的有NC膜和PVDF膜。在转膜过程中,膜的选择非常重要,PVDF膜有各种孔径尺寸,最常见的是0.45μm和0.2μm,对于蛋白理论大小大于20KDa,一般建议使用0.45μm的PVDF膜,反之选择0.22μm的PVDF膜。
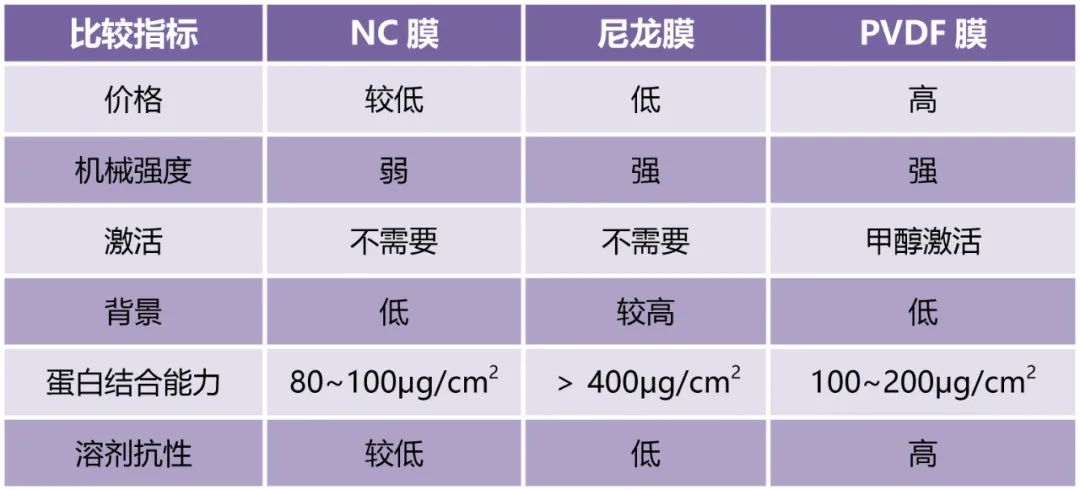
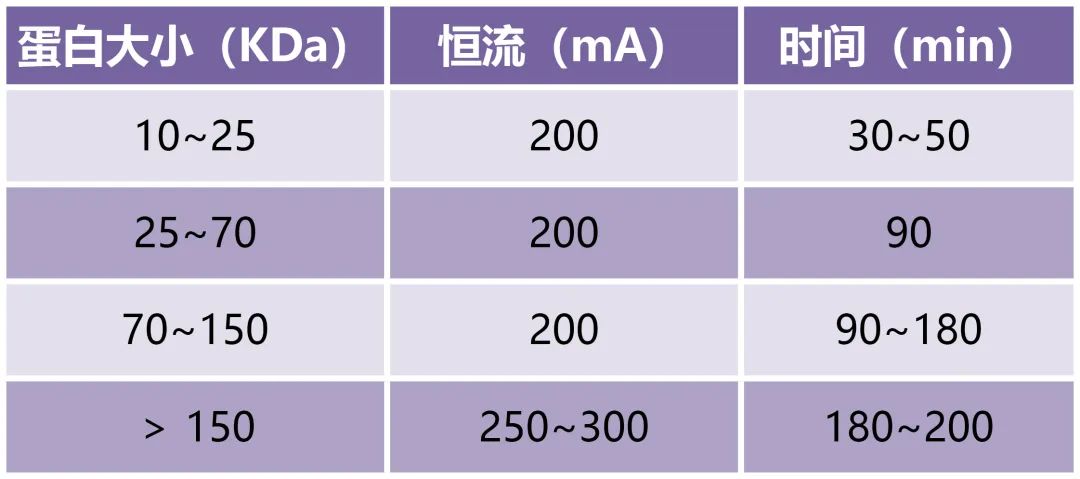
转膜时间太长或太短,蛋白质已经转走或还未吸附到膜上。做WB实验前,需要明确目标蛋白的分子量,根据文献确定转膜的时间。
2.6封闭
转膜完成后,将PVDF膜取出,放入TBST中洗涤5min,转入封闭液(5%脱脂奶粉或BSA)中室温封闭1h。

2.7一抗孵育
参照抗体说明书的WB稀释比例,用抗体稀释液稀释好一抗,将膜从封闭液中夹出用滤纸吸去多余液体,放入抗体孵育盒中,倒入稀释好的一抗,过夜孵育。

2.8二抗孵育
根据一抗来源选择合适的二抗,参照抗体说明书的WB稀释比例,用抗体稀释液稀释好二抗。将一抗孵育的PVDF膜用TBST洗涤3次,每次5min,将膜从洗涤液中夹出用滤纸吸去多余液体,放入抗体孵育盒中,倒入稀释好的二抗,室温孵育1h。

2.9洗涤
TBST洗膜3次,每次5min。
2.10显影曝光
取等体积ECL发光液A液与B液,混匀后避光保存备用。将PVDF膜放入盛有显影液的暗盒中孵育5min,孵育的过程中不停的轻轻摇晃暗盒。然后置于仪器中曝光拍照。
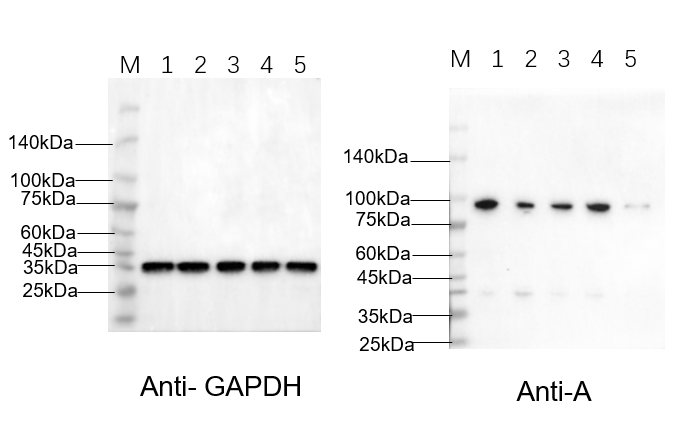
2.11结果展示
参考文献
Lin JS, Lai EM. Protein-Protein Interactions: Co-Immunoprecipitation. Methods Mol Biol. 2017;1615:211-219.
Isono E, Schwechheimer C. Co-immunoprecipitation and protein blots. Methods Mol Biol. 2010;655:377-87.




















 5850
5850

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








