
蛋白丰度
元素丰度即元素的相对含量,是在证认的基础上根据谱线相对强度或轮廓推算出来的。
蛋白质丰度即某种蛋白质在蛋白质组中含量的高低。生命体的遗传稳定性在于基因组,功能多样性在于蛋白质组。蛋白质组是由若干蛋白质所构成的集合体,其构成原则即其丰度整体分布规律是科学界长期研究的重大理论问题。
在进化上蛋白质丰度与其起源时间和序列保守性呈正相关;从结构角度而言,蛋白质丰度与其结构域数目呈负相关,而与其结构域的覆盖度呈正相关;蛋白质的功能决定其丰度。蛋白质丰度分布规律的揭示对于深入认识生命体的蛋白质构成原则具有重要意义,同时也为从海量数据到知识归纳提供了有效的实践模式。
Q:磷酸化和对应的总蛋白均降低,然后作者得出结论说该蛋白活性被抑制?
经常看到一些中文文章里面做某蛋白活性时,做出来的结果是磷酸化和对应的总蛋白均降低,然后作者得出结论说该蛋白活性被抑制!但很多外文期刊基本上都是做磷酸化与总蛋白的比值,基本是在同一总蛋白水平来检测磷酸化水平,如果这样,中文期刊里面很多结果如果做比值的话就没有统计意义了,请问各位同仁,有关磷酸化这一问题到底怎么看待呢?
(1)内参一致,总蛋白不变,磷酸化蛋白表达升高或者降低:说明经过某种处理(外部操作,抑制剂,上游蛋白基因敲除或者siRNA等)后,对该蛋白(及其代表的信号通路)的活性产生影响(促进或抑制);(2)内参一致,总蛋白升高或者降低:说明经过实验组的处理方法能够诱导总蛋白的表达或者降解。至于磷酸化活性的变化,和总蛋白的表达高低有关,该种处理方式可能同时影响该蛋白的表达与磷酸化形式,对该蛋白代表的信号通路发挥作用
蛋白质磷酸化:指由蛋白质激酶催化的把ATP的磷酸基转移到底物蛋白质氨基酸残基(丝氨酸、苏氨酸、酪氨酸)上的过程,或者在信号作用下结合GTP,是生物体内一种普通的调节方式,在细胞信号转导的过程中起重要作用。磷酸化(由激酶催化)和去磷酸化(由磷酸酶催化)是控制细胞周期的关键.它们都被用来控制调控途径自身活性和执行调控途径决定的底物活性,磷酸化和去磷酸化是一种分子开关形式。一些蛋白平时处于失活状态,必须被激酶磷酸化之后才才可以发挥活性,进一步转导各种生命过程。而有些正好相反,某些蛋白磷酸化时是失活的,必须经过磷酸酶去磷酸化才可以激活。
一般通路蛋白是要做磷酸化的,跟总蛋白比较。但是,如果测得总蛋白都已经减少或者增加了,那就没必要再测其磷酸化水平了吧。
中科 TMTpro标记试剂从11通道至16通道的提升,不仅仅是增加通量,降低分析时间;而且TMTpro通过减少标记批次,增加实验设计灵活性,消除/降低定量缺失值,推动蛋白组学实现更高通量与更深覆盖度。
通量是单位时间内能产生的数据量,是测序速度和测序数量的综合体现。测序技术四个指标:读长、成本、准确度、通量。高通量测序NGS
定量磷酸化蛋白质组学
蛋白提取之后酶解成肽段,对肽段进行富集,然后将磷酸化肽段进行LC-MS/MS定量分析。 在LC-MS/MS定量分析阶段,又分为Label free和iTRAQ/TMT标记两种方法。
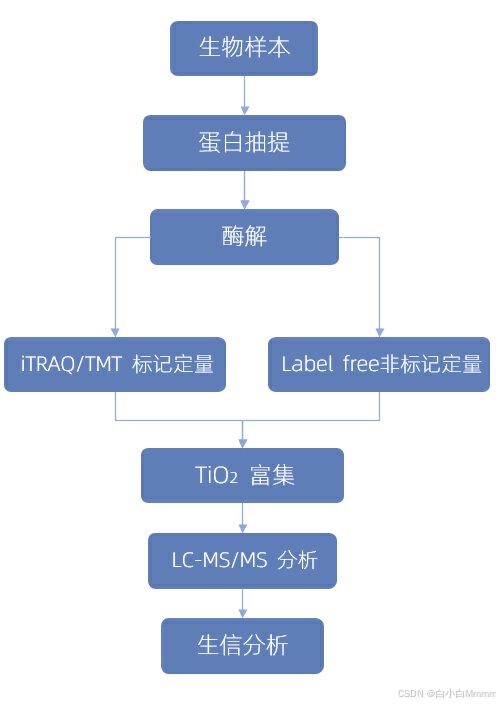
iTRAQ/ TMT
技术优势
1、iTRAQ可同时对8个样本进行分析,TMT可同时对10个样本进行分析
2、定量更准确,重复性高
3、蛋白检测范围广
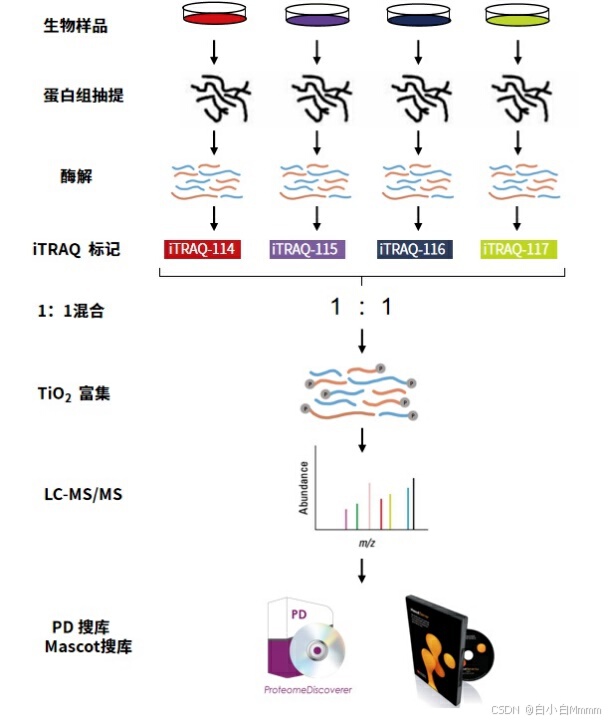
原理:根据报告离子的峰面积计算同一蛋白质同一磷酸化肽段在不同样品间的比值,从而实现磷酸化蛋白的相对和绝对定量。不同标记试剂与来源于不同样品胰酶消化后的肽段结合,经过色谱分离,并通过一级质谱和二级质谱。平衡基团在二级质谱发生中性丢失,报告基团在二级质谱低质量区域产生多个报告离子,其信号强度分别代表该标记样品的表达量。
Label free
1、无需昂贵的同位素标记试剂,实验耗费低
2、不受样本数量限制,克服了标记定量技术在对多个样本进行定量方面的缺陷
3、对样本的操作少,从而使其最接近原始状态
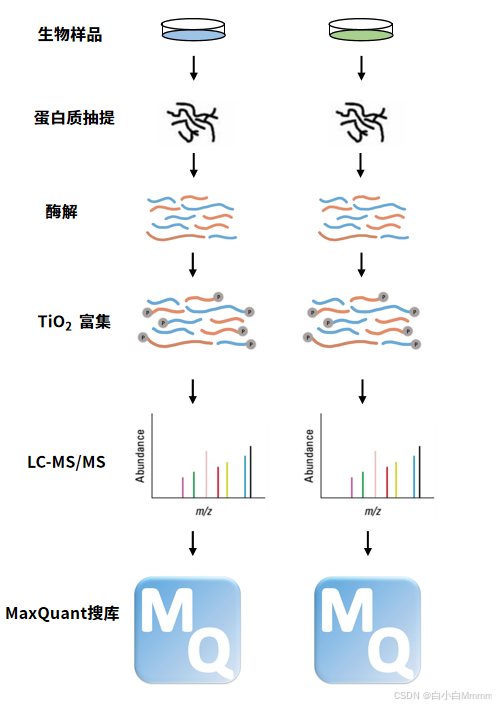
原理:根据一级质谱相关的磷酸化肽段峰强度、峰面积、液相色谱保留时间等信息,基于磷酸化肽段母离子强度(或色谱离子流的峰面积),以一级质谱MS1为定量基础,计算每个磷酸化肽段的信号强度在LC-MS色谱上的积分,进行磷酸化定量。
为什么检测了磷酸化蛋白质组,还要再检测蛋白质组呢?
可以解决单组学无法解释的问题。
转录组+蛋白组的分析
mRNA水平≠蛋白水平,蛋白才是真实事件的反应
由于转录后调控以及翻译后调控的存在,所以mRNA的表达水平并不能代表蛋白质的水平,这也是我们实验中常常会遇到的PCR结果和WB结果不符的原因。当前的研究表明,mRNA和蛋白的相关性约在0.3-0.5之间,因此单独只研究mRNA的表达是不充分或偏倚的。而蛋白质作为细胞功能的主要执行者,它是最终参与细胞生物学过程的主要效应分子。因此,蛋白表达水平才是真实的基因表达情况的反应。
蛋白质组TMT、4D和DIA的区别
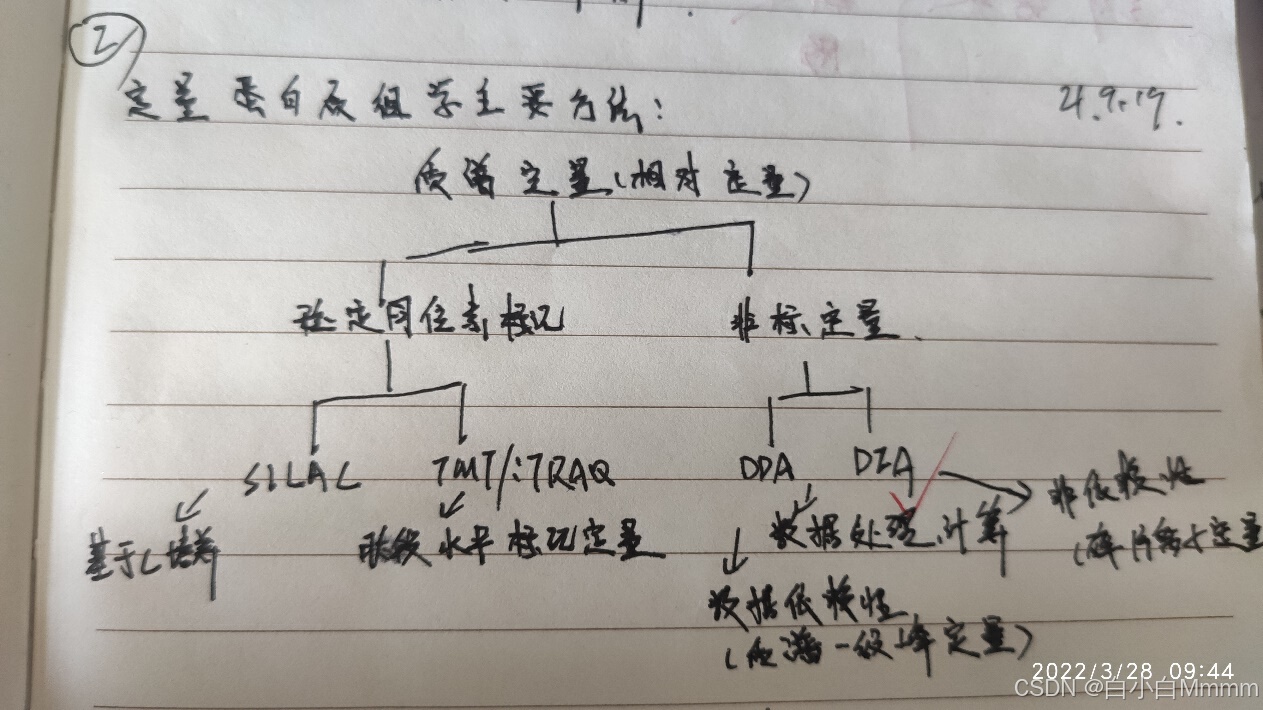
iTRAQ/TMT和label free的区别
iTRAQ/TMT分别是由美国 Thermo 公司和 AB SCIEX公司研发的多肽体外标记定量技术,是目前运用最广泛的两种标记定量蛋白质组技术,具有相似的原理,两主要区别在于:TMT最高可同时标记16组不同的生物样品,iTRAQ最高可同时标记8组不同的生物样品。
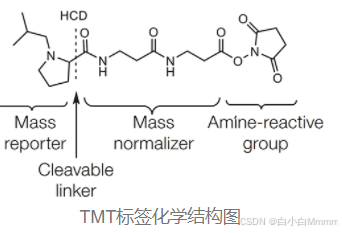
以TMT为例,一组TMT标签试剂里的所有标签,均带有相同的质量。化学结构则由质量报告基团、质量平衡基团和肽反应基团构成,其中肽反应基团可以和肽段的N-term或末端赖氨酸侧链基团的游离氨基共价结合,从而使全部肽段标记上TMT标签。不同的TMT标签有不同质量的报告集团,通过质量平衡基团的平衡保持不同的TMT标签总分子质量相同。肽段在进入二级质谱时,质量报告基团因碎裂而被释放,在质谱低质量区产生报告离子峰,该质谱信号强度即反应了某一种肽段在不同样本中的相对表达量。
因此使用同位素可以对不同样品进行标记,然后将同一批样品一起上机进行检测,根据不同的同位素标记来区分各个样品中不同蛋白的表达量。这种技术方法的优势是:定量准确,数据重现性好,灵敏度高对样品要求量低,检测蛋白数量多。缺点是由于同位素标记最多只有16种,样品量大的时候需要在每次上机时加内参样品,增加了成本。另外,无法剔除离群样本进行重新分析,这也是TMT蛋白质谱应用的限制。
Label free无需使用昂贵的稳定同位素标签做内部标准,每个样品单独上机,只需分析大规模鉴定蛋白质时所产生的质谱数据,比较不同样品中相应肽段的信号强度,从而对肽段对应的蛋白质进行相对定量。Label free的优势是无需依赖同位素标记,每例单独检测,因此实验设计灵活,适合临床大几十例、上百例样本的检测,同时也能看到样本中的 “有还是无”的蛋白。缺点是对仪器的稳定性、实验人员的操作等可能产生系统误差的因素要求极高
4D蛋白质组技术是新一代蛋白质组学分析技术,由布鲁克公司与蛋白质组学领域的领军人物Matthias Mann,Ruedi Aebersold,Ben Collins和Hannes Roest等科研团队合作推出的技术。布鲁克的4D蛋白质谱TimsTOF Pro,基于双Tims和PASEF的数据采集模式,具有更高的采集速度、灵敏度和特异性,引领临床蛋白质组学在鉴定准度、鉴定深度、定量准确性、检测周期等性能上全面提升
了解DIA和DDA之前,我们先要简要了解下当前基于LC-MS/MS蛋白质谱的基本流程:准备样本——抽提和纯化蛋白质——胰酶消化成肽段——液相色谱分离(LC)—— 一级质谱检测(母离子信号)——肽段破碎进入二级质谱检测(用于确定氨基酸序列)——数据分析。
DIA和DDA指的就是两种进行二级质谱的数据采集模式。DDA是一种选择性数据采集方式,而DIA是数据全扫描采集方式
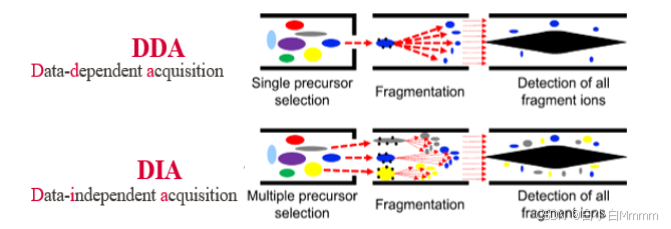
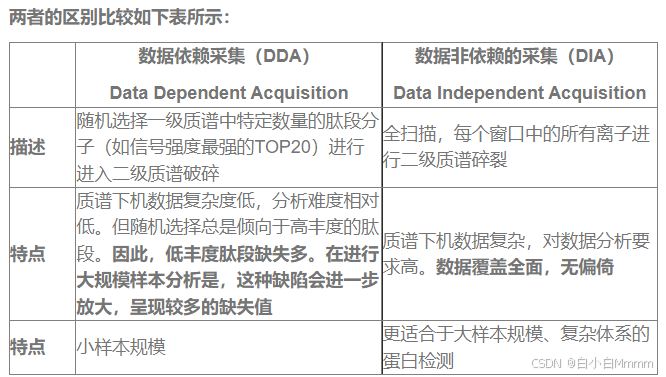
因此,相对于传统的是DDA,DIA具有如下技术优势:
1. 全景式扫描,数据无遗漏,蛋白质覆盖率、定量准确性高;
2. 样本无需分馏分上机,极大缩短了每个样品的检测周期;不受样本量限制,可用于大规模样本数量检测;
3. 相比于DDA模式,DIA缺失值更少,鉴定与定量结果的可重复性更高,数据可回溯。


























 499
499

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








