在短短几年时间里,CRISPR/Cas9作为一种稳定、高效、简单、广泛应用的基因编辑技术迅速出现并发展起来。事实上,CRISPR/Cas9已经从根本上影响了许多领域,如农业、生物技术和生物医学,但从快速增长的出版物中积累的数据可以证明,没有哪个领域比癌症研究受到的影响更深远。本文将盘点近期CRISPR/Cas9的技术应用进展和突破,以供大家参考:
【1】Nat Commun:利用CRISPR/dCas9靶向阻断DNA甲基转移酶,可揭示特定启动子上DNA去甲基化的功能作用
2021-11-22报道,在一项新的研究中,来自加拿大麦吉尔大学的研究人员展示了他们如何通过使用CRISPR/dCas9基因组编辑技术,在体外培养的小鼠和人类细胞中成功地去除特定基因的DNA甲基化。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Unraveling the functional role of DNA demethylation at specific promoters by targeted steric blockage of DNA methyltransferase with CRISPR/dCas9”。
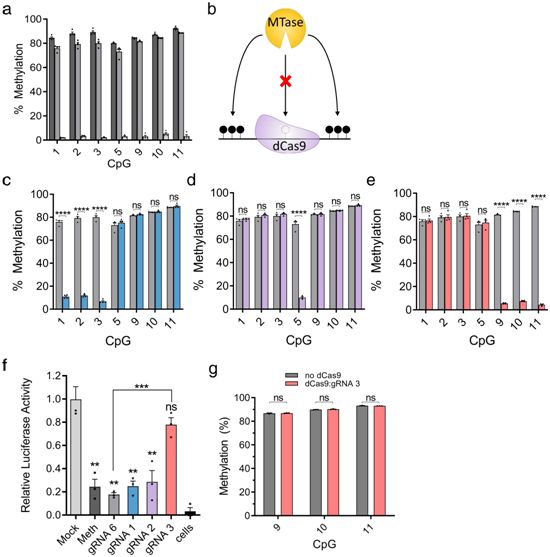
在体外,利用CRISPR/dCas9阻断DNA甲基转移酶
他们发现,这种DNA“去甲基化”活动可以靶向DNA中的任何地方---任何感兴趣的基因---而无需编辑遗传密码,并且在DNA中不希望出现的位置没有脱靶编辑。他们还描述了完全去除DNA甲基标记所需的方法,希望世界各地的科学家们能够利用这种新技术开始发现本应开启的因发生DNA甲基化而被关闭的基因---例如,糖尿病患者中的胰岛素编码基因,并利用这种技术建立疾病治疗的新模式。
原文:Daniel M. Sapozhnikov et al. Unraveling the functional role of DNA demethylation at specific promoters by targeted steric blockage of DNA methyltransferase with CRISPR/dCas9. Nature Communications, 2021, doi:10.1038/s41467-021-25991-9.
【2】CRISPR/Cas9组合筛选揭示了人类乳腺癌中相互作用的肿瘤抑制基因和治疗靶点的上位性网络
2021-10-27报道,最近,将聚合CRISPR筛选与单细胞转录组读数结合在一起的高含量表型方法已经出现,使得基于生长的表型效应可以与转录组范围的变化并行分析。这些工具和技术为人们提供了一个机会,系统地分析灭活的抑癌基因组合如何改变人类乳腺上皮细胞的生长特性和基因表达谱,以确定驱动基因合作的一般机制。人类乳腺癌基因组数据指导了作者的研究,也被用来作为实验转录组结果的基准。

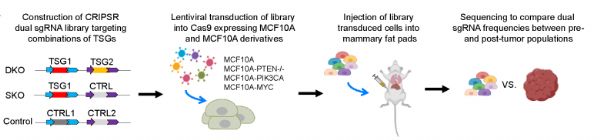
TSG对的扰动促进体内肿瘤的发生。
该研究的一个重要结果是,它证明了任何癌症的驱动基因相互作用可以系统地绘制,使用组合CRISPR筛选肿瘤生长或其他与转录组广泛变化并行的生理相关的生长效应。虽然可以不经筛选就发现上位性表达变化,但可以相信未来的工作是系统性的是很重要的。
作者发现,通过TP53和其他肿瘤抑制基因的改变,在乳腺癌细胞中协同上调的基因之一是CDK4,它编码FDA批准用于治疗转移性ER+/HER2乳腺癌药物的靶标。然而,目前没有数据表明TP53状态是否可以作为CDK4抑制剂的有用生物标志物。作者承认,该工作目前只是开放这一领域的第一步,并理解临床应用还有很长的路要走。在不就的将来期,严格测试协同改变基因的功能影响和药物性将是重要的,以确定它们是否可能成为抑制致瘤性的有用靶点。
原文:https://pubmed.ncbi.nlm.nih.gov/34561273/
【3】基于CRISPR/Cas9的基因编辑技术在癌症基础研究、诊断和治疗中的应用
2021-10-12报道,近年来,CRISPR/Cas9系统在癌症研究和治疗中得到越来越多的应用,并取得了显著的成果。本文主要介绍了基于CRISPR/ cas9的基因编辑系统的机制和发展,并对该技术在肿瘤基础研究、诊断和治疗中的应用现状进行了综述。此外,还讨论了CRISPR/Cas9在肿瘤研究新热点中的潜在应用,并指出了面临的挑战和未来的方向。

图片来源:https://doi.org/10.1186/s12943-021-01431-6
癌症是一种死亡率高且受到全球关注的难治性疾病。恶性肿瘤导致全球六分之一的死亡,从而威胁到成千上万人的生命。尽管在癌症治疗领域,包括手术、放疗、化疗、靶向生物治疗和新型联合治疗等方面取得了许多令人振奋的成果,但高的术后复发率、放疗/化疗耐药性和有害的毒副作用仍然是生存时间和生活质量的障碍。研究表明,癌症是一种潜在的致命疾病,它积累了多个基因,并改变了整个基因组的表观遗传学。癌症中基因的突变通常会推动癌症的进程并影响肿瘤发生的未来。在过去的二十年中,高通量测序技术鉴定了大量与癌症发生和发展相关的基因。基于这些进展,基因编辑技术有望通过调节基因表达和纠正基因突变来治疗癌症,这可能导致精准肿瘤领域的进一步突破。
在本文中,作者重点介绍了CRISPR/Cas基因编辑技术如何为癌症基础研究、诊断和治疗开辟新途径。作者还讨论了CRISPR/Cas技术目前的局限性,并展望了未来CRISPR/Cas技术在癌症生物学中的发展方向。
原文:Huimin Zhang et al. application of the CRISPR/Cas9-based technique in basic research, diagnosis and therapy of cancer. Mol Cancer 2021 Oct 1;20(1):126. doi: 10.1186/s12943-021-01431-6.
【4】eLife:利用CRISPR-Cas9进行起始密码子中断有望治疗富克斯角膜营养不良
2021-08-09报道,在一项新的研究中,来自美国俄勒冈大学、弗吉尼亚大学、犹他大学、马萨诸塞大学医学院和约翰霍普金斯大学的研究人员使用CRISPR-Cas9基因编辑技术中断起始密码子,以阻止小鼠的富克斯角膜营养不良(Fuchs' corneal dystrophy)。这是首次证明使用这种称为起始密码子中断(start codon disruption)的技术来治疗有丝分裂后组织所患的遗传疾病,并有潜力通过取代角膜移植的需求而引发富克斯角膜营养不良治疗变革。它还可能导致针对其他遗传疾病甚至影响非生殖细胞的疾病的新疗法。相关研究结果近期发表在eLife期刊上,论文标题为“Start codon disruption with CRISPR/Cas9 prevents murine Fuchs’ endothelial corneal dystrophy”。论文通讯作者为俄勒冈大学的Balamurali Ambati教授。
Ambati说,“我们确定,我们可以破坏起始密码子,从而通过向角膜提供基因疗法,有选择地抑制这种蛋白质的表达。” 这些作者通过将编码酿脓链球菌Cas9(SpCas9)和向导RNA(gRNA)的腺病毒注射到直接面对角膜内皮细胞的小鼠眼睛前房进行治疗。在检查这种治疗的安全性的研究中,他们确定周围组织没有受到基因治疗的影响。他们研究了其他的非靶基因,以确保它们没有受到影响,并确定最大耐受剂量对视网膜、虹膜和眼睛的其他部分是安全的。
这些作者发现,他们的方法不仅可以保留角膜内皮细胞的密度和结构,而且还可以拯救它们的功能。在诱发肿胀的功能拯救试验中,他们对角膜有了一些令人惊讶的发现。在角膜上加水并没有像科学家们预期的那样诱发肿胀。相反,他们确定肿胀是由眼房水通过角膜内皮(角膜的背面)进入角膜而诱发的,因此,在摘除上皮后角膜表面的高渗溶液挑战导致了最大的角膜肿胀。
这项研究为未来在动物和非人类灵长类动物中使用COL8A2基因敲除治疗富克斯角膜营养不良的可行性研究并最终在涉及人类的临床试验中使用奠定了基础。Ambati说,减少富克斯角膜营养不良患者对角膜移植的需求可以间接帮助其他需要角膜组织的患者。未来的研究还可以探索Cas9介导的基因敲除对携带单点突变的有丝分裂后细胞的其他遗传疾病的影响,包括神经系统疾病、免疫疾病和影响关节的某些疾病。
原文:Hironori Uehara et al. Start codon disruption with CRISPR/Cas9 prevents murine Fuchs' endothelial corneal dystrophy. eLife, 2021, doi:10.7554/eLife.55637.
【5】新疆野苹果再生及CRISPR/Cas9基因编辑体系研究取得进展
2021-08-01报道,中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点实验室张道远研究组创制了新疆野苹果组培体系,使得再生体系缩短至2~3个月,此方法可用于大批量扩繁新疆野苹果克隆苗。相关研究成果以An efficient in vitro regeneration system from different wild apple (Malus sieversii) explants为题,发表在BMC Plant Methods上。
研究人员在获得最优野苹果再生体系的基础上,将基因编辑工具CRISPR/Cas9基因编辑体系应用于本物种,并取得良好的编辑效果。相关研究成果以Application of CRISPR/Cas9 Technology in Wild apple (Malus sieverii) for gene editing为题,发表在BMC Plant Methods上。新疆野苹果再生体系及遗传转化体系的建立将为基因功能研究、新种质的创制奠定基础,CRISPR/Cas9基因编辑技术的成功应用也将加速新疆野苹果的现代分子育种进程。
原文:An efficient in vitro regeneration system from different wild apple (Malus sieversii) explants
1.野生型化脓性链球菌Cas9核酸酶,从表达核酸酶的大肠杆菌菌株中纯化。 包含核定位序列NLS)和C -末端6-His标签。 浓度为10µg/µL。 Cas9核酸酶100µg = 610 pmol。

2.Alt-R S.p. HiFi Cas9 核酸酶 V3 是一种高保真化脓性链球菌 Cas9 蛋白,显著降低脱靶效应,是常规实验的最佳选择,且非常适合棘手的基因组编辑应用情况。

3.Alt-R Sp Cas9-GFP V3 和Sp Cas9-RFP V3 核酸酶是高纯度的重组化脓性链球菌Cas9 酶,具有核定位序列 (NLS) 和 C 端 6-His 标签。专为需要蛋白质转染后可视化或使用荧光激活细胞分选 (FACS) 富集编辑细胞的应用而设计。
4.SpCas9 核酸酶(不含甘油,包含核定位序列 (NLS) 和 C 端 6-His 标签。以 10 µg/µL 的无甘油溶液形式提供。100 µg Cas9 核酸酶 = 610 pmol。

5.Cas9 切口酶只允许在 DNA 靶位点特异性切割一条链;dCas9 蛋白的主要用途是阻断基因组特定位点的转录。

6.Alt-R As Cas12a (Cpf1) Nuclease V3 酶是一种高纯度的重组酸胺球菌属。当 Cas9 特定的 PAM 序列 (NGG) 不可用时,它可用于靶向富含 AT 的区域,识别TTTV PAM位点。该酶包括核定位序列 (NLS) 和 C 端 6-His 标签。

7.Alt-R Cas12a (Cpf1) Ultra 核酸酶可用于靶向富含 AT 的区域,它们比野生型As Cas12a (Cpf1)具有更高的靶向效力。除了 TTTV 基序之外,Alt-R Cas12a (Cpf1) Ultra还可以识别 TTTT PAM 位点,从而增加了基因组编辑研究的目标范围。

北京泽平各类CRISPR cas9、cas12酶,请搜索“北京泽平”进入咨询。




 本文概述了CRISPR/Cas9技术在癌症领域的重要应用,如DNA甲基化调控、肿瘤抑制基因筛选、治疗策略创新及基因编辑治疗角膜营养不良的前景。研究者揭示了基因编辑技术在基础研究、诊断和治疗中的潜力,展示了其在癌症防治中的关键作用。
本文概述了CRISPR/Cas9技术在癌症领域的重要应用,如DNA甲基化调控、肿瘤抑制基因筛选、治疗策略创新及基因编辑治疗角膜营养不良的前景。研究者揭示了基因编辑技术在基础研究、诊断和治疗中的潜力,展示了其在癌症防治中的关键作用。
















 477
477

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








