LSM 淋巴细胞分离液
用途:
用于体外分离外周淋巴血细胞
方法概述: 分离混合血液白细胞早期的方法,总是伴随红细胞聚集,只轻微影响白细胞。通过离心,红细胞密度增加聚集,同时可以从离心管上部收集白细胞。
Böyum提出了一种更方便,通过使用Ficoll® 甲泛影钠溶液离心快速分离方法。稀释的血液在Ficoll?甲泛影钠溶液中分层,低速短时离心。红细胞和沉降到管底的粒细胞,和单个核细胞(淋巴细胞)和血小板可以从两个分层之间收集。
许多研究者不断努力,修订了Böyum方法,MP生物医学公司生产的LSM,方法的独特之处是运用,泛影钠成功的代替了甲泛影钠。
程序原理: 除去血液中的纤维蛋白或肝素处理血液以1:1的比例用生理盐水或平衡盐溶液稀释,在分离溶液中分层,低速离心30分钟。通过离心,迁移能力不同最终形成不同的细胞层。
大部分的红细胞和粒细胞通过梯度迁移形成颗粒状。由于其密度不同,淋巴细胞和其他单个核细胞(单核细胞和血小板)分布在在血浆和LSM两层中间。淋巴细胞可以通过回抽分层回收,在进一步去除血小板,LSM和血浆。
试剂: LSM® is a sterile filtered solution which contains 6.2g Ficoll and 9.4 g sodium diatrizoate per 100 ml. The density is 1.0770-1.0800 g/ml at 200C.
LSM® 是一种灭菌过滤溶液,每100毫升包含6.2克聚蔗糖和9.4克钠胺。密度是1.0770-1.0800克/毫升20℃。
使用说明: 以下的操作步骤是最初由Böyum.设计的程序的众多改良版本中的一种。此程序的改良是通过运用除去血液中的纤维蛋白或抗凝血剂处理人体血液;这种改良对于其他物种来源血液或者其他组织非常有必要。
1. 轻轻颠倒瓶子使LSM充分混合
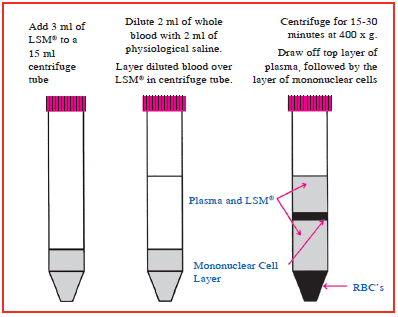
2. 无菌转移3 mlLSM到15 ml离心管中。
3. 混合2 ml除纤维蛋白血液或肝素处理血液 和2 ml 生理盐水
4. 仔细的将稀释血液加入3 mlLSM(室温)于15ml离心管中,在血液和LSM中形成一个明显的分层。不要将稀释血液混合入LSM中。
5. 室温下400g离心15-30分钟,离心可以沉淀红细胞和多核白细胞同时可以再LSM上形成一层单核淋巴细胞,如上图所示。
6. 吸出淋巴细胞上方2-3mm的血浆。
7. 吸取淋巴细胞层以及它下面一半的LSM和转移到另外的一个离心管。加入等体积的平衡盐缓冲液至淋巴细胞离心管中,室温离心10分钟,离心速度设定在既不损伤细胞又能沉淀细胞即刻,例如160 - 260 x g(去除LSM和降低血小板的百分比)。
8. 用平衡盐缓冲液清洗细胞,用适当的培养基重悬细胞。
实验步骤
1. 新鲜血(肝素抗凝20u/ml)+1640(无血清)培养液或PBS按照1:1 稀释;
2.在15ml或50ml塑料离心管中预先加入淋巴细胞分离液,使分离液:稀释后血液=1:1;
3.小心的将稀释后的血液加到分离液的上面;
4.室温 2600rpm 离心20分钟;
5. 取出离心管,小心吸出白白的那一层,重悬于5倍体积的不完全培养液或PBS中,混匀;
6.室温 1500rpm 离心5分钟;
7.吸弃上清,再加4ml不完全培养液,混匀;
8.室温 1000rpm离心5分钟;
9.弃上清,用完全培养液稀释至2ml;
10.淋巴细胞记数;
11.按所需浓度及实验目的稀释细胞,种板。
北京泽平科技代理全球各大品牌淋巴细胞分离液,微信搜索“泽平科技”进入公众号咨询报价。
分离外周血中的单个核细胞
1.抽取正常人静脉血加到肝素抗凝管中,加等量含5~10IU/ml肝素的无血清缓冲液悬浮细胞。将细胞悬液小心加在与血液等量的淋巴细胞分离液上,室温中,水平离心500×g 20分钟。此时离心管中形成5层:最上面是血浆,血浆层和淋巴细胞分离液之间是PBMC,淋巴细胞分离液层和最下面的红细胞层之间是粒细胞层,又成为棕黃层。
2.吸去最上层的血浆,收集血浆层和淋巴细胞分离液交界面的单个核细胞,尽量全部吸出PBMC。加1~2倍量含5IU/ml肝素、2%灭活小牛血清的Hanks液(洗涤液),混匀后离心200×g 10分钟,低速离心有利于去除细胞悬液中留存的血小板,去上清液。
3.再用同样洗涤液洗涤细胞2次,每次离心500×g 10分钟,洗去残留的淋巴细胞分离液。用1%台盼蓝染色检测细胞活力(应>95%)并计数细胞。再用含10%小牛血清的细胞培养液将细胞配成适当浓度。通常,每毫升外周血可得1×106~2×106PBMC。
分离关节滑液中的单个核细胞
1.将关节滑液置含肝素(终浓度5IU/ml)的离心管中,离心1000×g 15分钟。
2.用含2%灭活小牛血清的Hanks液悬浮沉淀细胞并洗涤细胞1次,每次离心1000×g 15分钟。用含2%灭活小牛血清的Hanks液悬浮细胞至原容量。
3.用淋巴细胞分离液分离关节滑液中的单个核细胞,并用含10%小牛血清的细胞培养液将细胞配成适当浓度。
分离组织中的单个核细胞
1.取外科分离的各种组织,用含1%庆大霉素和1%小牛血清的MEM培养液洗涤组织块,洗去可能的污染物。将组织块置培养皿中,加入约为组织块体积5~10倍的同样MEM培养液。用无菌外科剪刀将组织块剪碎成0.5mm3大小。
2.将组织块转移到小培养瓶中,静置片刻,吸去培养液。加入约2倍组织块体积的、滤过除菌的酶溶液。37℃水浴摇床中消化1~2小时,注意组织块的消化程度。
3.当组织块消化分散后,用手用力摇晃培养瓶3~5分钟或用大口吸管反复吹打,使细胞团进一步分散。加入30ml上述MEM培养液,终止酶反应。
4.让上述悬液通过200目的金属网或尼龙网,分离单个细胞。用上述MEM培养液洗涤细胞3次,每次离心1000×g 10分钟。用1%台盼蓝染色法检测细胞活力并计数细胞。
5.如果细胞量较多(>107),应当用上述淋巴细胞分离液分离出单个核细胞,并用含10%小牛血清的细胞培养液将细胞配成适当浓度。




















 6734
6734

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








