阅读指引
1、原代细胞与细胞系
2、原代细胞体外培养现状
3、原代细胞应用困局
4、Lonza原代细胞业务
原代细胞与细胞系
原代细胞来源于活体或是新近死亡的供体,通过机械或酶方法解离获得,其方案根据来源物种(例如人,小鼠)和所涉及的组织类型而变化。通常包含以下步骤:组织切割和切碎,酶解,反复洗涤,研磨和微滤分馏,最后重新悬浮和接种收集的细胞群1。对于松散的、被纤维结缔包围的组织,机械均质化可能足以进行解离。如果您的组织来源是外周血,差速离心便可以分离目的细胞。
由于与细胞分裂相关的染色体端粒缩短,原代细胞在体外的寿命有限。大约20到60次分裂后,端粒变得太短而无法承受另一个循环,导致细胞分裂停止。这种现象被称为Hayflick极限2。对于具有无限倍增能力的细胞系,必须通过病毒或化学诱导方法的转化使其永生化。病毒对于细胞的基因编辑引入有效促进增殖的基因(例如SV-40,E6,E7),允许细胞无限的细胞分裂1。同样地,化学诱导方法(例如电离辐射,氯化镍,苯并芘)改变原代细胞的基因组成,也可实现无限增殖。
永生化细胞系通常具有更快的倍增时间并可持续地分裂,为实验提供一致的研究工具。然而,每次分裂都会 引起遗传漂移,降低了它们的生物学相关性。其优点在于,当需要相同的遗传背景时,可以从一个细胞系产生整个克隆群体以具有相同的基因型。但是,哺乳动物原代细胞是生命科学研究中不可或缺的一环,因为它们在生理上类似于供体组织并保留其天然异质的基因组成。它们具有体内组织特异性特征并且纯度高,因此,除了应用于大规模药物筛选,越来越多地用于更可靠地研究生命科学,例如细胞代谢,信号传导,癌症和衰老等3。
原代细胞体外培养现状
原代细胞自然生长有两种方式,锚定依赖或非锚定依赖,这主要取决于它们在体内的组织来源:外周血(非锚定依赖)或固体组织器官(锚定依赖)。原代细胞一旦分离后,24-48h内需要进行贴壁或起始,开始培养。
广义地说,所有的哺乳动物细胞,无论其类型或来源,都需要在与人类生理条件(即37°C,5%CO2)非常相似的条件下生长。此外,它们还需要一个pH可调节的生长环境,并且培养基中需包含细胞类型特定的营养因子、生长因子、葡萄糖和/或激素。为了确定一种特定细胞类型在低至无血清培养基中正常生长和功能所需的最低条件,相关研究工作已经揭示了生长培养基必须包含的基本成分:胰岛素、转铁蛋白、葡萄糖和各种盐、维生素和氨基酸1。然而,除此之外培养基也可以含有组织和细胞特异性细胞因子和增殖、生存所需的生长因子。例如,原代内皮细胞和血管平滑肌细胞都需要添加L-谷氨酰胺和成纤维细胞生长因子(FGF),但是,应该添加额外的组织特异性因子,以防止成纤维细胞的生长4。
随着研究者们对细胞和分子生物学理解的进展,结合技术改进,科学家们现已成功地将人类原代细胞培养作为体外模型用于用于疾病病理和再生医学研究。原代细胞在体外仍保留其组织特异性特征,因此在培养皿中,可以提供更加有价值的信息。不仅仅是二维培养,研究者们现已开始使用3D培养技术,通过原代细胞,体外重现器官中细胞与其微环境的相互作用。随着科学家们对细胞-细胞和细胞-细胞外基质(ECM)相互作用的理解不断增长,对更复杂和真正具有组织代表性的模型系统的需求也在不断增长。
原代细胞应用困局
经过一次传代后,原代细胞培养物就会成为二级细胞培养物,也称为细胞株。然而,尽管称为细胞株,但其寿命是有限的(除非如前所述永生化)。这种有限的分裂能力体内的细胞相似,一旦细胞在体内完全分化以发挥其特殊功能,细胞将停止增殖-这是固有的癌症保护性衰老过程。此外,某些原代细胞有丝分裂后,无论是在体内或体外培养中都不增殖(例如,神经元,骨骼肌细胞,心肌细胞,周细胞,终末分化的肝细胞)。因此,每次进行实验后,原代细胞培养都需要再次从新鲜的组织中解离。
由于样品处理过程和培养条件都需要优化,建立原代细胞培养可能是一个棘手的过程。在分离和解离过程中使用抗生素可以帮助防止污染。然而,时间、技术和试剂是促成您成功的最重要因素。必须注意整个潜在的污染源、传代的最佳细胞密度(60%–80%),以及可能的细胞结块或细胞粘附不当。
Lonza原代细胞业务
1庞大的细胞种类和供者库
2易于获取
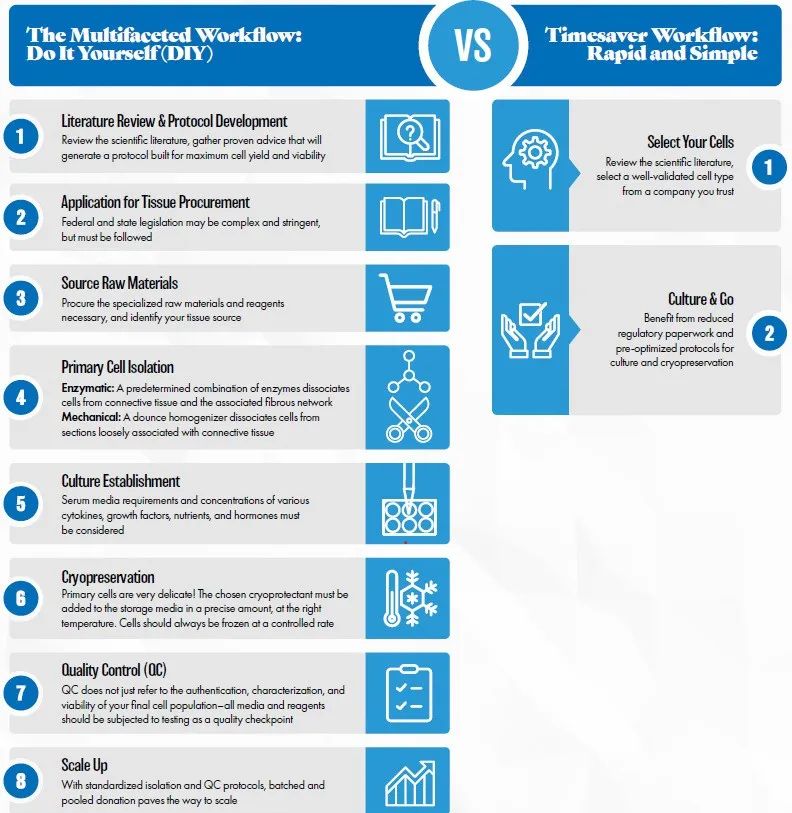
购买原代细胞与自行分离原代细胞流程对比↑↑↑↑
3易于使用|每种细胞均有适用的培养基供您选择
4定制服务
5完全合规的资质和文件
微信搜索”泽平科技”公众号,获取各类原代细胞培养方案目录!
参考文献
1.Alberts B, “Isolating cells and growing them in culture,” Molecular Biology of The Cell, ed 4, Garland Science, New York, NY, 2002.
2.Hayflick L, “The limited in vitro lifetime of human diploid cell strains,” Exp Cell Res 37:614-636, 1965.
3.ASCB Newsletter, "Advantages and difficulties of working with primary cells," November 2015.
4.Pan C et al., "Comparative proteomic phenotyping of cell lines and primary cells to assess preservation of cell type-specific functions," Mol Cell Proteomics 8(3):443-450, 2009.




 本文介绍了原代细胞与细胞系,原代细胞体外培养需特定条件,科学家已将其用于疾病病理和再生医学研究。原代细胞应用存在寿命有限、培养棘手等困局。还介绍了Lonza原代细胞业务,包括细胞种类多、易获取等特点。
本文介绍了原代细胞与细胞系,原代细胞体外培养需特定条件,科学家已将其用于疾病病理和再生医学研究。原代细胞应用存在寿命有限、培养棘手等困局。还介绍了Lonza原代细胞业务,包括细胞种类多、易获取等特点。
















 2307
2307

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








