二、平衡热力学
L9 燃料电池和铅酸电池
目录
1. Nernst 方程与开路电压
- 能斯特方程——半电池反应;开路电压——两个半电池反应 或 全电池反应
- 半电池反应:
∑ i s i M i z i → n e − . \sum_is_i\mathrm{M}_i^{z_i}\to n\mathrm{e}^-. i∑siMizi→ne−. - 方程1:电极与电解质之间的电位差(根据Nernst方程描述):
Δ ϕ = Δ ϕ Θ − k B T n e ln ∏ a i s i \Delta \phi = \Delta \phi^\Theta - \frac{k_B T}{n e} \ln \prod a_i^{s_i} Δϕ=ΔϕΘ−nekBTln∏aisi
其中 Δ ϕ Θ \Delta \phi^\Theta ΔϕΘ 是参考状态下的电位差, a i a_i ai是物质 i i i的活度, s i s_i si是化学计量系数。
- 全电池反应:
∑ i s i R i → ∑ j s j P j . \sum_is_i\mathrm{R}_i\to\sum_js_j\mathrm{P}_j. i∑siRi→j∑sjPj. - 方程2-1:电池的开路电压(1 - 由阳极和阴极的Nernst方程之差描述):
V O = Δ ϕ c − Δ ϕ a = Δ ϕ c Θ − Δ ϕ a Θ − k B T n e ln ∏ 产物 a j s j ∏ 反应物 a i s i V_O = \Delta \phi_c - \Delta \phi_a = \Delta \phi^\Theta_c - \Delta \phi^\Theta_a - \frac{k_B T}{n e} \ln \frac{\prod_{\text{产物}} a_j^{s_j}}{\prod_{\text{反应物}} a_i^{s_i}} VO=Δϕc−Δϕa=ΔϕcΘ−ΔϕaΘ−nekBTln∏反应物aisi∏产物ajsj
- 方程2-2:电池的开路电压(2 - 由全电池产物与反应物描述):
V O = V Θ − k B T n e ln ∏ products a j s j ∏ reactants a i s i , V_O=V^\Theta-\frac{k_BT}{ne}\ln\frac{\prod_\text{products}a_j^{s_j}}{\prod_\text{reactants}a_i^{s_i}}, VO=VΘ−nekBTln∏reactantsaisi∏productsajsj,
使用为全电池反应定义的化学计量系数。这里我们做了定义
V
Θ
=
Δ
ϕ
c
Θ
−
Δ
ϕ
a
Θ
V^\Theta=\Delta\phi_c^\Theta-\Delta\phi_a^\Theta
VΘ=ΔϕcΘ−ΔϕaΘ
- 注:Nernst方程:描述能斯特电压 (反应界面平衡时的电压差(电压降)) 与 活度的关系。
2. 聚合物电解质膜燃料电池(PEM燃料电池)
2.1 氢浓度电池

图 1:氢气浓差电池
-
氢浓度电池的反应为:
- 阳极: H 2 → 2 H + + 2 e − H_2 \to 2H^+ + 2e^- H2→2H++2e−
- 阴极: 2 H + + 2 e − → H 2 2H^+ + 2e^- \to H_2 2H++2e−→H2
- 总反应: H 2 ( a ) → H 2 ( c ) H_2(a) \to H_2(c) H2(a)→H2(c)
-
由于 Δ ϕ Θ = 0 \Delta \phi^\Theta = 0 ΔϕΘ=0,开路电压为:
V
O
=
k
B
T
2
e
ln
p
H
2
,
a
p
H
2
,
c
V_O = \frac{k_B T}{2e} \ln \frac{p_{H_2,a}}{p_{H_2,c}}
VO=2ekBTlnpH2,cpH2,a
在这里,我们假设活度与压力成正比:我们选择参考状态,以便活度等于在大气中测量的压力。在这种特殊情况下,我们可以用其他单位测量压力,因为当我们采用比率时,这些单位会抵消。为了实现正开路电压,我们需要
p
H
2
a
>
p
H
2
c
p_{H_2}^a>p_{H_2}^c
pH2a>pH2c
当
p
H
2
→
p
H
2
c
p_{H_2} \to p_{H_2}^c
pH2→pH2c 时,开路电压降至零。这种电池永远不会提供大电压,因为 kBT /e 只有 25 mV 并且对数永远不会变得特别大。例如,电池在等于太阳中心压力(大约 10^11 个大气压,主要是氢气)和地球大气(其中氢气含量约为 1 ppm,即分压为 10^−6 个大气压)之间运行只会产生大约 0.5V。
2.2 标准PEM燃料电池

图2. 氢气浓差电池
标准PEM燃料电池的反应为:
- 阳极: H 2 → 2 H + + 2 e − H_2 \to 2H^+ + 2e^- H2→2H++2e−, Δ ϕ a Θ = 0 \Delta \phi^\Theta_a = 0 ΔϕaΘ=0
- 阴极: 1 2 O 2 + 2 H + + 2 e − → H 2 O \frac{1}{2}O_2 + 2H^+ + 2e^- \to H_2O 21O2+2H++2e−→H2O, Δ ϕ c Θ = 1.229 V \Delta \phi^\Theta_c = 1.229 \, \text{V} ΔϕcΘ=1.229V
总反应为: H 2 + 1 2 O 2 → H 2 O H_2 + \frac{1}{2} O_2 \to H_2O H2+21O2→H2O
开路电压为:
V O = V Θ − k B T 2 e ln a H 2 O a H 2 a O 2 1 / 2 . V_O=V^\Theta-\frac{k_BT}{2e}\ln\frac{a_{H_2O}}{a_{H_2}a_{O_2}^{1/2}}. VO=VΘ−2ekBTlnaH2aO21/2aH2O.
液态水是参考状态,因此只要水与阴极保持接触,$a_{H2O}就会为1。气体的活度是在大气中测量的压力,因此
V
O
=
V
Θ
+
k
B
T
2
e
ln
(
p
H
2
p
O
2
1
/
2
)
.
V_O=V^\Theta+\frac{k_BT}{2e}\ln(p_{H_2}p_{O_2}^{1/2}).
VO=VΘ+2ekBTln(pH2pO21/2).
3. 铅酸电池
电池 (baterry:含电解液的电池) 的开路电压比燃料电池 (cell) 的开路电压更复杂。这是因为baterry的OCV必须取决于电池的充电状态,这决定了每种反应物和产物的存在量,从而决定了它们的活度。
-
铅酸电池的阳极和阴极反应分别为:
- 阳极: P b + S O 4 2 − → P b S O 4 + 2 e − Pb + SO_4^{2-} \to PbSO_4 + 2e^- Pb+SO42−→PbSO4+2e−, Δ ϕ a Θ = − 0.356 V \Delta \phi^\Theta_a = -0.356 \, \text{V} ΔϕaΘ=−0.356V
- 阴极: P b O 2 + S O 4 2 − + 4 H + + 2 e − → P b S O 4 + 2 H 2 O PbO_2 + SO_4^{2-} + 4H^+ + 2e^- \to PbSO_4 + 2H_2O PbO2+SO42−+4H++2e−→PbSO4+2H2O, Δ ϕ c Θ = 1.685 V \Delta \phi^\Theta_c = 1.685 \, \text{V} ΔϕcΘ=1.685V
- 总反应为: P b + 2 H 2 S O 4 + P b O 2 → 2 P b S O 4 + 2 H 2 O Pb + 2H_2SO_4 + PbO_2 \to 2PbSO_4 + 2H_2O Pb+2H2SO4+PbO2→2PbSO4+2H2O
-
开路电压为:
V O = V Θ − k B T 2 e ln a P b S O 4 2 a H 2 O 2 a P b a P b O 2 a H + 4 a S O 4 2 − 2 . V_O=V^\Theta-\frac{k_BT}{2e}\ln\frac{a_{PbSO_4}^2a_{H_2O}^2}{a_{Pb}a_{PbO_2}a_{H^+}^4a_{SO_4^{2-}}^2}. VO=VΘ−2ekBTlnaPbaPbO2aH+4aSO42−2aPbSO42aH2O2.
水和固体的活度为1,因此开路电压将取决于氢和硫酸根离子的活度。我们将特别关注氢离子的活性,因为它可能参与其他几种反应,包括腐蚀和电解。为了探索氢浓度的影响,我们可以将硫酸盐的活性设置为 1。如果其活性是其他值,这只会给开路电压带来一些恒定的偏移。在真实的电池中,硫酸盐活性会发生变化,但这种影响不如氢活性的变化重要,因此我们将忽略它。那么开路电压
V O = V Θ + 2 k B T e ln a H + = V Θ − 2 k B T e ln 10 ( − log 10 a H + ) . \begin{aligned} V_{O}& =V^\Theta+\frac{2k_BT}{e}\ln a_{H^+} \\ &=V^\Theta-\frac{2k_BT}e\ln10(-\log_{10}a_{H^+}). \end{aligned} VO=VΘ+e2kBTlnaH+=VΘ−e2kBTln10(−log10aH+).
2 k B T / e ∗ l n 10 2kBT /e *ln 10 2kBT/e∗ln10 为 0.12 V,而 − l o g 10 a H + − log10 a_{H^+} −log10aH+是 pH 的定义。我们经常使用 − l o g 1 0 H + − log10 _{H^+} −log10H+ 作为 pH,其中 c H + c_{H^+} cH+ 是氢离子浓度。后者实际上是 p[H] 的定义:两者经常互换使用,因为在多种条件下活性与浓度成正比。因此,下面的方程中的 pH 值是正确的,但使用 p[H] 则几乎没有什么区别。该电池的开路电压为
V O = ( 2.041 − 0.12 pH ) V V_O=(2.041-0.12\text{pH})\text{ V} VO=(2.041−0.12pH) V
为了了解该电池可以有效运行的条件范围,我们考虑铅/硫酸电池的开路电压还可能涉及其他反应,包括:
- 铅/硫酸反应:
P b S O 4 + 2 e − → P b + S O 4 2 − Δ ϕ 23 Θ = − 0.356 V ( 23 ) P b O 2 + S O 4 2 − + 4 H + + 2 e − → P b S O 4 + 2 H 2 O Δ ϕ 24 Θ = ( 1.685 − 0.12 p H ) V ( 24 ) \mathrm{PbSO}_{4}+2\mathrm{e}^{-}\rightarrow\mathrm{Pb}+\mathrm{SO}_{4}^{2-}\Delta\phi_{23}^{\Theta}=-0.356 \mathrm{V}\quad(23)\\\mathrm{PbO}_{2}+\mathrm{SO}_{4}^{2-}+4\mathrm{H}^{+}+2\mathrm{e}^{-}\rightarrow\mathrm{PbSO}_{4}+2\mathrm{H}_{2}\mathrm{O}\quad\Delta\phi_{24}^{\Theta}=(1.685-0.12\mathrm{pH}) \mathrm{V}\\(24) PbSO4+2e−→Pb+SO42−Δϕ23Θ=−0.356V(23)PbO2+SO42−+4H++2e−→PbSO4+2H2OΔϕ24Θ=(1.685−0.12pH)V(24) - 铅/水反应:
P b O + 2 H + + 2 e − → P b + H 2 O Δ ϕ 25 Θ = ( 0.25 − 0.06 p H ) V \mathrm{PbO}+2\mathrm{H}^{+}+2\mathrm{e}^{-}\rightarrow\mathrm{Pb}+\mathrm{H}_{2}\mathrm{O}\quad\Delta\phi_{25}^{\Theta}=(0.25-0.06\mathrm{pH}) \mathrm{V} PbO+2H++2e−→Pb+H2OΔϕ25Θ=(0.25−0.06pH)V
3 P b O + H 2 O → P b 3 O 4 + 2 H + + 2 e − Δ ϕ 26 Θ = ( 0.97 − 0.06 p H ) V 3\mathrm{PbO}+\mathrm{H}_{2}\mathrm{O}\to\mathrm{Pb}_{3}\mathrm{O}4+2\mathrm{H}^{+}+2\mathrm{e}^{-}\quad\Delta\phi_{26}^{\Theta}=(0.97-0.06\mathrm{pH}) \mathrm{V} 3PbO+H2O→Pb3O4+2H++2e−Δϕ26Θ=(0.97−0.06pH)V
P b 2 + + H 2 O → P b O + 2 H + p H = 6.35 \mathrm P\mathrm b^{2+}+\mathrm H_2\mathrm O\to\mathrm P\mathrm b\mathrm O+2\mathrm H^+\quad\mathrm p\mathrm H=6.35 Pb2++H2O→PbO+2H+pH=6.35
P b 2 + + 2 e − → P b Δ ϕ 28 Θ = − 0.126 − 0.03 p [ P b 2 + ] V \mathrm{Pb}^{2+}+2\mathrm{e}^{-}\to\mathrm{Pb}\quad\Delta\phi_{28}^{\Theta}=-0.126-0.03\mathrm{p}[\mathrm{Pb}^{2+}] \mathrm{V} Pb2++2e−→PbΔϕ28Θ=−0.126−0.03p[Pb2+]V
P b 2 + + 2 H 2 O → P b O 2 + 4 H + + 2 e − Δ ϕ 29 Θ = 1.45 + 0.03 p [ P b 2 + ] − 0.118 p H ) V \mathrm{Pb}^{2+}+2\mathrm{H}_{2}\mathrm{O}\to\mathrm{PbO}_{2}+4\mathrm{H}^{+}+2\mathrm{e}^{-}\quad\Delta\phi_{29}^{\Theta}=1.45+0.03\mathrm{p}[\mathrm{Pb}^{2+}]-0.118\mathrm{pH}) \mathrm{V} Pb2++2H2O→PbO2+4H++2e−Δϕ29Θ=1.45+0.03p[Pb2+]−0.118pH)V
- 水的电解:
2 H + + 2 e − → H 2 Δ ϕ 30 Θ = − 0.06 p H V ( 30 ) 1 2 O 2 + 2 H + + 2 e − → H 2 O Δ ϕ 31 Θ = ( 1.23 − 0.06 p H ) V ( 31 ) \begin{aligned}2\mathrm{H}^{+}+2\mathrm{e}^{-}\to\mathrm{H}_{2}&&\Delta\phi_{30}^{\Theta}=-0.06\mathrm{pH~V}&&(30)\\\frac{1}{2}\mathrm{O}_{2}+2\mathrm{H}^{+}+2\mathrm{e}^{-}\to\mathrm{H}_{2}\mathrm{O}&&\Delta\phi_{31}^{\Theta}=(1.23-0.06\mathrm{pH}) \mathrm{V}&&(31)\end{aligned} 2H++2e−→H221O2+2H++2e−→H2OΔϕ30Θ=−0.06pH VΔϕ31Θ=(1.23−0.06pH)V(30)(31)
半电池反应意味着电压随着 pH 值而降低(由开路电压可知),因此电池在强硫酸中运行最有效。然而,酸性条件可能会促进其他潜在的不良反应,因此从热力学角度对它们进行比较很重要。在上面的列表中,我们包括其他腐蚀和电解反应,以确定在不同条件下有利于哪种反应。
- 我们可以在普贝图(见下文)上表示这些反应,显示参与反应的物质的稳定状态,作为电位(相对于标准氢电极)和 pH 的函数。因此,普贝图是电压 pH 空间中的热力学相图,其过渡线由能斯特方程给出。 (由于 pH 值是根据 H+ 活性定义的,因此这些是直线。)上面的反应说明了几种不同类型的反应,它们在普贝图上的显示有所不同。
- ①涉及 H+ 的法拉第反应显示为倾斜线,通常随 pH 值降低。
- ②不涉及电荷转移的反应,例如(27),没有电势依赖性,因此显示为垂直线。
- ③不涉及 H+ 的反应如 (23) 和 (28) 显示为水平线。
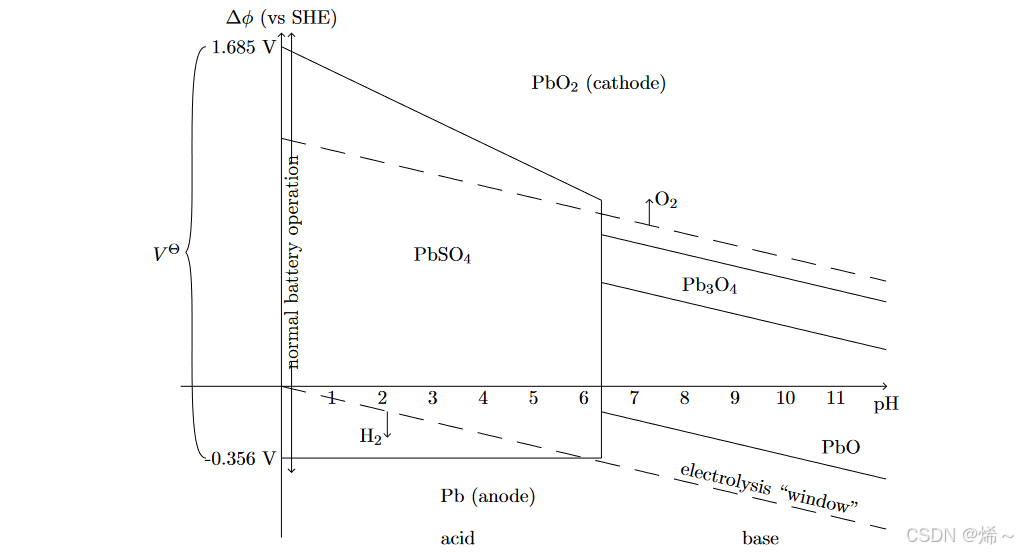
图 3:铅和硫酸系统的现有技术普贝图
从反应(28)-(29)中,我们看到在酸性溶液和低电势中,Pb2+离子比金属铅和氧化铅更受青睐,因此在这种条件下热力学上有利于电极的溶解。然而,硫酸中SO2 4 - 的存在会引发反应(23)-(24),该反应比溶解反应更有利,并最终用硫酸铅薄膜屏蔽电极。在电池循环过程中,这种固体膜以可逆的方式部分地从一个电极转移到另一个电极,从而允许将铅酸电池用作二次(可充电)电池。
当两个半电池反应发生在同一电极上时,导致化学物质之间发生净电荷转移,并且没有净电子转移到电极或从电极转移出,该净反应被称为“腐蚀反应”。在这种情况下,电极同时充当阳极和阴极。例如,(24)和(29)的组合导致腐蚀反应,
P
b
2
+
+
S
O
4
2
−
→
P
b
S
O
4
\mathrm{Pb}^{2+}+\mathrm{SO}_4^{2-}\to\mathrm{PbSO}_4
Pb2++SO42−→PbSO4
- 当同一电极上发生多个竞争反应时,通常必须考虑反应动力学,以通过总电流为零的要求来确定开路电压。
在水溶液中,必须始终考虑水的电解导致氢气和氧气的析出,(30)-(31),它定义了“电解窗口”,在该窗口之外,气体析出可能会消耗电流并与铅酸反应竞争。 (请注意,这些反应的电压差与 PEM 燃料电池中的电压差相同,并且不依赖于 pH 值。)- ①当电压低于 VO 时,在电池放电期间,水的电解通常不是问题,因为氢气氧气的产生速度很慢并且可以逸出。
- ②过度充电期间,当 V>> VO 时,氢气和氧气的产生速度快于其扩散速度,从而可能导致燃烧。
- 请注意,这些现象涉及动力学和传输(稍后将在课程中讨论),因此不能仅从平衡考虑来理解。相反,能斯特方程和普贝图仅作为实际系统中可能实际发生反应的粗略指南。
主要内容总结:
- Nernst方程 描述了电极与电解质之间的电位差,开路电压由Nernst方程计算。
- PEM燃料电池 的开路电压受氢和氧气的分压影响,最大电压约为1.229 V。
- 铅酸电池 的开路电压与溶液的pH值有关,电压随着酸度增加而下降。
- 水的电解反应 限制了电池的电压窗口,过充时可能导致氢气和氧气的产生。

























 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








