Toll 样受体 4(TLR4)作为识别革兰氏阴性菌脂多糖(LPS)的模式识别受体,在维持肠道免疫稳态中扮演重要角色。近期研究发现,TLR4 可通过改变 5-HT 受体表达影响肠道收缩反应,敲除 TLR4 能减弱 5-HT 诱导的结肠收缩,提示 TLR4 与 5-HT 系统可能存在交互调控。此外,机械敏感离子通道 PIEZO1 作为钙内流的关键调控因子,已被证实参与 5-HT 分泌的调节,但其与 TLR4 在肠道动力调控中的相互作用尚未见报道。基于此,本研究聚焦孕期 LPS 暴露对后代小鼠肠道动力的影响,深入探讨 TLR4-PIEZO1 相互作用在 5-HT 介导的肠道动力异常中的作用机制,为理解发育源性肠道功能障碍提供新的理论依据。
本研究采用体内动物实验与体外细胞实验相结合的策略,系统探究孕期 LPS 暴露对后代小鼠肠道动力的影响及分子机制。动物实验选用 Tlr4-floxed 小鼠与 Villin-Cre 小鼠杂交,构建肠道上皮特异性 Tlr4 敲除(Tlr4△IEC)小鼠模型,将 8 周龄雌性小鼠随机分为四组:Tlr4fl/fl+PBS 组、Tlr4fl/fl+LPS 组、Tlr4△IEC+PBS 组、Tlr4△IEC+LPS 组。于孕 14.5 天腹腔注射 LPS(50μg/kg)或等量 PBS,后代雄性小鼠在 3 周龄时通过尾组织 DNA 进行基因分型,6 周龄时检测肠道动力指标,8 周龄时处死并收集结肠组织用于后续分析。
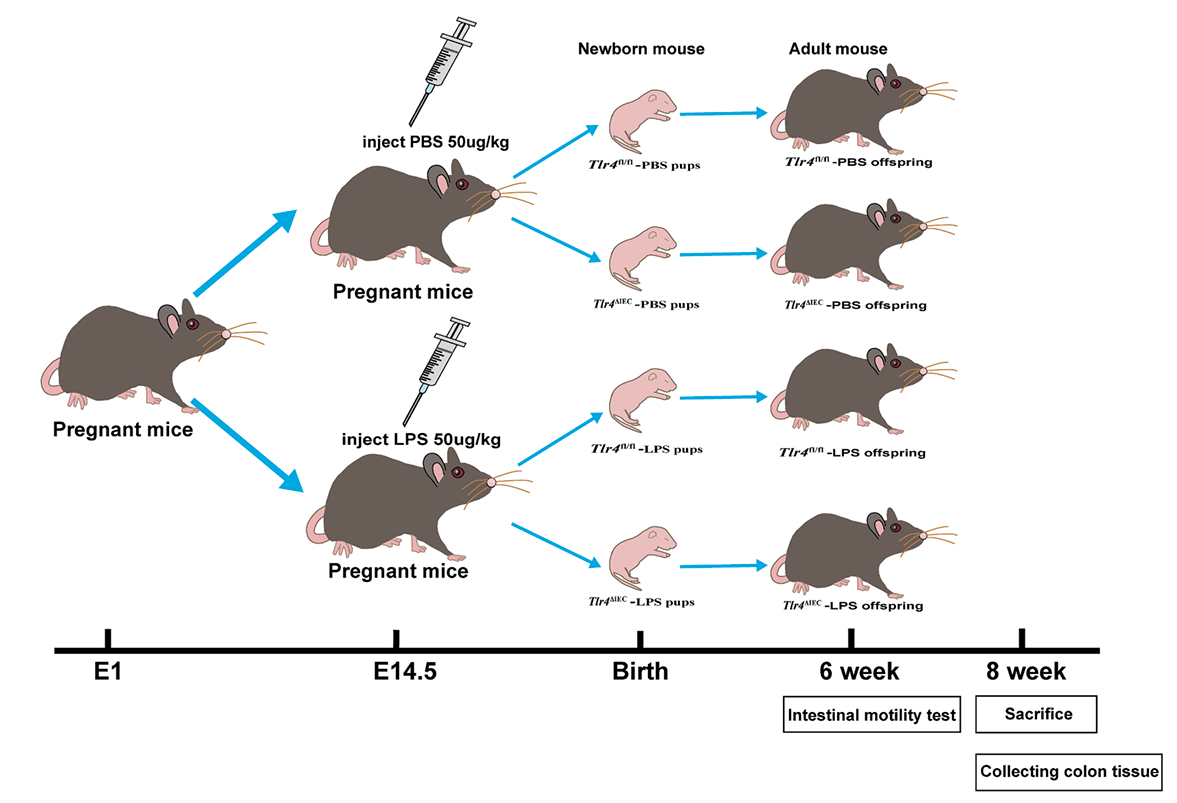
肠道动力评估采用三种方法:胃肠传输实验通过灌胃 300μL 胭脂红溶液,记录首次排出红色粪便的时间;结肠传输实验将 3mm 玻璃珠从肛门推入结肠 3cm 处,记录排出时间;粪便含水量测定则通过称量新鲜粪便与烘干后粪便的重量差计算。结肠组织形态学分析采用 HE 染色,石蜡切片厚度 5μm,通过 ImageJ 软件量化黏膜层厚度及完整性。
分子水平检测包括 RNA 测序、Western blot、qPCR 及 ELISA。RNA 测序选取四组小鼠结肠组织,采用 Illumina Novaseq 6000 平台,通过 DESeq2 筛选差异表达基因(fold change>2,P<0.05),并进行 KEGG 通路富集分析。Western blot 检测 TLR4 信号通路相关蛋白(TLR4、CHUK、RELA、p-RELA、PTGS2)及 5-HT 系统相关分子(TPH1、SLC6A4、HTR2C、HTR3A、HTR4),一抗孵育过夜后结合 HRP 标记二抗,通过化学发光底物显影,以 ACTB 作为内参。qPCR 验证关键基因表达,采用 Trizol 法提取 RNA,逆转录为 cDNA 后使用 SYBR Green 染料进行扩增,引物序列参照文献补充表 S1。ELISA 用于检测结肠组织及粪便中 5-HT 含量,严格按照试剂盒说明书操作。
体外实验选用人肠嗜铬细胞瘤细胞系 BON-1,培养于含 5% 胎牛血清的 RPMI 1640 培养基中,分为四组:PBS 组、PBS+TAK-242 组、LPS 组、LPS+TAK-242 组,其中 TAK-242(购自 AbMole)预处理 1 小时(终浓度 10μmol/L),随后 LPS 处理 12 小时。免疫荧光染色检测 TLR4 与 5-HT 的共定位,细胞固定后经 0.2% Triton X-100 透化,一抗 4℃孵育过夜,荧光二抗室温避光孵育 1 小时,DAPI 染核后通过共聚焦显微镜观察。钙成像实验使用 Fluo-4 AM 指示剂,记录不同处理组细胞内钙荧光强度变化。共免疫沉淀实验采用 TLR4 抗体结合蛋白复合物,通过 Western blot 检测 PIEZO1 的结合情况,验证蛋白相互作用。
实验结果显示,孕期 LPS 暴露显著改变 Tlr4fl/fl 后代小鼠的肠道结构与功能,而 Tlr4△IEC 小鼠无明显变化。HE 染色显示,Tlr4fl/fl+LPS 组后代结肠黏膜层厚度显著减少(P=0.0197),完整性受损,而 Tlr4△IEC 小鼠无论是否暴露于 LPS,黏膜层结构均保持完整。肠道动力检测表明,Tlr4fl/fl+LPS 组后代的结肠传输时间显著缩短(P=0.0063),粪便含水量增加(P=0.0001),胃肠传输时间加快(P=0.0149),而 Tlr4△IEC 小鼠的这些指标在 LPS 与 PBS 组间无统计学差异,提示肠道上皮 TLR4 缺失可逆转孕期 LPS 暴露诱导的肠道动力异常。
分子机制研究发现,孕期 LPS 暴露激活 Tlr4fl/fl 后代小鼠结肠中的 TLR4 信号通路。Western blot 结果显示,Tlr4fl/fl+LPS 组 TLR4 蛋白表达较 PBS 组升高(P=0.0003),下游分子 CHUK(P=0.0046)及 PTGS2(P<0.0001)的表达也显著上调,p-RELA/RELA 比值呈上升趋势,而 Tlr4△IEC 小鼠中这些蛋白的表达在 LPS 处理后无明显变化,且 LPS 暴露与 Tlr4 敲除的交互作用对 TLR4、CHUK 及 PTGS2 的表达有显著影响(P 分别为 0.0012、0.0048、<0.0001)。RNA 测序分析进一步证实,Tlr4fl/fl+LPS 组中 TLR4 信号通路及 5 - 羟色胺能突触通路相关基因显著富集,热图显示 TLR4 及 5-HT 相关基因簇表达上调,而 Tlr4△IEC 小鼠中无此现象,qPCR 验证发现 Htr4、Reg4 及 Sypl2 等基因的 mRNA 表达变化与测序结果一致,表明 TLR4 可能通过调控 5-HT 系统影响肠道动力。
5-HT 系统检测结果显示,孕期 LPS 暴露导致 Tlr4fl/fl 后代小鼠结肠及粪便中 5-HT 含量显著增加(P<0.0001 及 P=0.0092),而 Tlr4△IEC 小鼠无明显变化。Western blot 显示,Tlr4fl/fl+LPS 组中 5-HT 合成限速酶 TPH1 表达上调(P=0.0192),转运体 SLC6A4 表达下调(P=0.0139),同时 5-HT 受体 HTR2C(P=0.0014)、HTR3A(P=0.0412)及 HTR4(P=0.0019)的蛋白水平显著升高,且这些变化均依赖于 TLR4 的表达,提示 TLR4 可能通过促进 5-HT 合成、减少重吸收及上调受体表达增强 5-HT 介导的肠道动力。
体外实验进一步揭示 TLR4 与 PIEZO1 的相互作用机制。BON-1 细胞经 LPS 处理后,TLR4 与 PIEZO1 的 mRNA 表达显著上调(P=0.0004 及 P=0.0273),免疫荧光显示两者共定位增加,共免疫沉淀证实蛋白相互作用增强。钙成像实验表明,LPS 处理诱导明显的钙内流,而 TAK-242 预处理可显著抑制这一效应。ELISA 检测发现,LPS 组细胞上清中 5-HT 浓度升高(P=0.0078),TAK-242 可逆转该变化,提示 TLR4 通过与 PIEZO1 结合促进钙内流,进而刺激 5-HT 分泌。此外,孕期 LPS 暴露使 Tlr4fl/fl 后代小鼠结肠黏膜中 PIEZO1 的表达显著增加(P=0.0001),而 Tlr4△IEC 小鼠中无此现象,证实 PIEZO1 的上调依赖于肠道上皮 TLR4 的表达。
综合以上结果,本研究证实孕期 LPS 暴露通过激活后代小鼠肠道上皮 TLR4,促进其与 PIEZO1 结合,增强钙内流导致肠嗜铬细胞分泌 5-HT 增加,同时通过上调 5-HT 受体表达增强肠道动力,最终引发肠道蠕动异常。这一机制为理解发育源性肠道功能障碍提供了新的视角,提示 TLR4-PIEZO1-5-HT 轴可能成为改善相关肠道动力异常的潜在靶点。需要注意的是,本研究仅关注雄性后代,且未探讨钙非依赖的 5-HT 分泌途径,未来研究应进一步验证雌性小鼠中的作用及其他可能的调控机制。在实验过程中,AbMole 的 TAK-242 作为特异性 TLR4 抑制剂,为体外验证 TLR4 的功能提供了可靠的工具,确保了实验结果的准确性。




















 1887
1887

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








