慢性间歇性缺氧(CIH)作为 OSA 的标志性病理过程,已被证实可触发脂肪组织的氧化应激与炎症反应,而后者正是 MetS 发生发展的关键驱动因素。过往研究揭示,巨噬细胞向促炎 M1 表型的极化在脂肪组织炎症中扮演核心角色,而新型铁依赖性脂质过氧化介导的细胞死亡方式 —— 铁死亡,近期被发现可能参与这一调控过程。RNA 表观修饰作为基因表达调控的关键层,其在 CIH 诱导的脂肪组织炎症中的作用尚未被充分探索,这为本研究提供了重要的科学切入点。
本研究通过整合生物信息学分析、动物模型与细胞实验,系统探究了 RNA 甲基转移酶 NSUN6 在 CIH 诱导的脂肪组织炎症中的作用及机制。研究首先从 GEO 数据库获取 OSA 相关的两个数据集(GSE38792 与 GSE135917),前者包含 10 例 OSA 患者与 8 例对照的内脏脂肪样本,后者涵盖 58 例 OSA 患者与 8 例对照的皮下脂肪样本及 24 例 CPAP 治疗前后的配对样本。
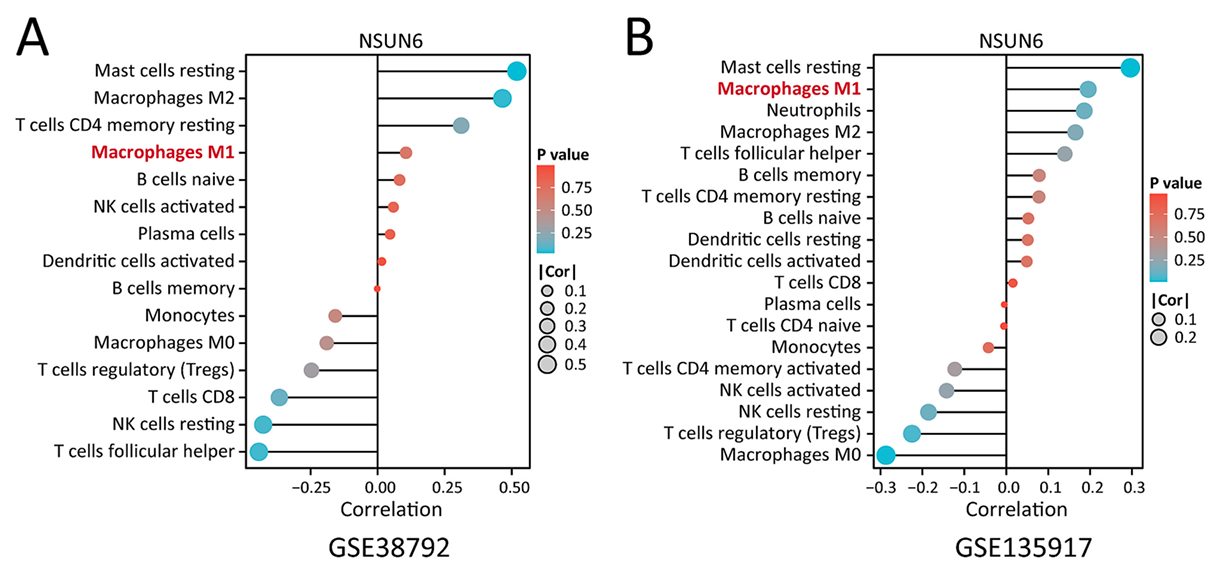
通过 “limma” R 包进行标准化与差异基因分析,筛选出 15 个差异表达的 RNA 修饰调控因子,其中 NSUN6 在 OSA 样本中呈现显著上调。进一步通过单变量 logistic 回归与 LASSO 回归构建风险模型,发现 NSUN6 与其他 6 个调控因子(IGF2BP3、ELAVL1、TRMT61A、TRMT61B、CPSF3、CSTF3)共同构成诊断模型,其中 NSUN6 的 ROC 曲线下面积(AUC)达 0.824,提示其潜在的诊断价值。
动物实验采用 6-7 周龄雄性 C57BL/6J 小鼠,随机分为 4 组(n=6):正常空气组(NA)、4 周 CIH 处理组(CIH)、CIH+Erastin 组及 CIH+Fer-1 组。CIH 模型通过定制舱室实现,每日 8 小时(8:00-16:00)将氧气浓度在 21% 与 5% 间循环切换(周期 60 秒),持续 4 周。干预试剂中,Erastin(购自 AbMole,货号 M2679)与 Fer-1(购自 AbMole,货号 M2698)均以 DMSO 溶解,再用 PBS 稀释至工作浓度(Erastin 1mg/ml,Fer-1 0.2mg/ml),分别按 5mg/kg(每 2 天一次)与 1mg/kg(每日一次)腹腔注射,对照组给予含 2% DMSO 的 PBS。实验终点处,通过过量麻醉处死小鼠,收集附睾白色脂肪组织(eWAT)与皮下白色脂肪组织(scWAT),用于后续检测。
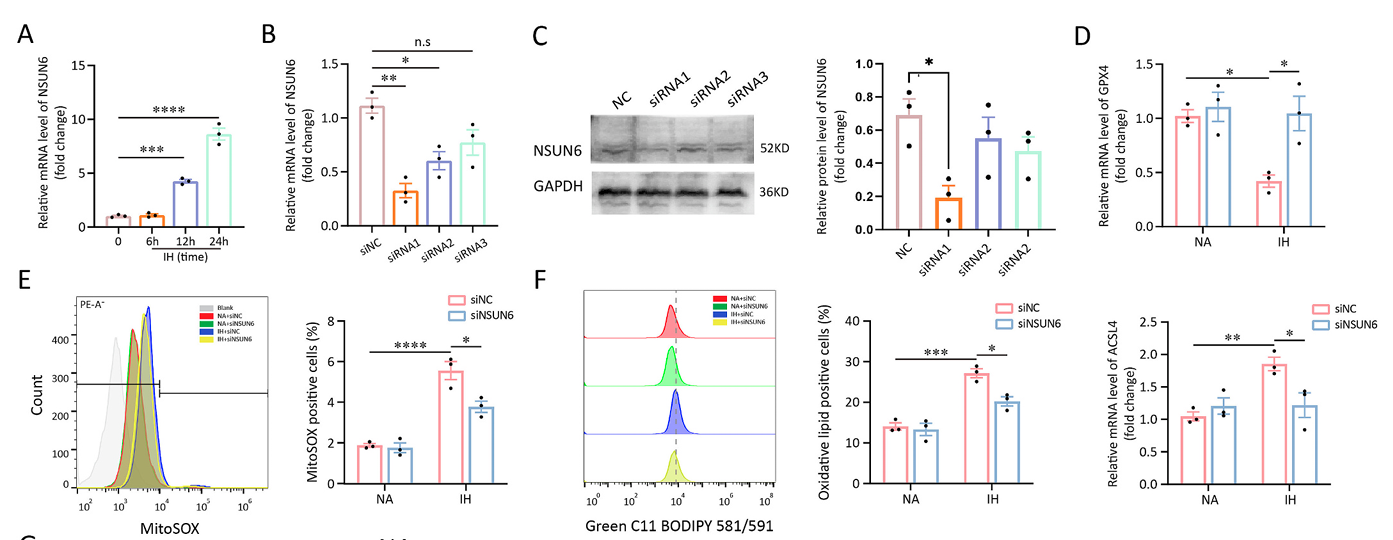
细胞实验采用 RAW 264.7 巨噬细胞系,在含 10% 胎牛血清的高糖 DMEM 培养基中培养。IH 模型通过三气培养箱实现,氧气浓度每 30 分钟在 5% 与 21% 间切换,持续 24 小时。NSUN6 敲低通过 siRNA 转染实现,转染 6 小时后换液,继续培养 24 小时后进行 IH 处理。铁死亡相关干预中,Erastin(10μM)与 Fer-1(2μM)在 IH 处理开始时加入培养基,对照组加入等量 DMSO。
组织学分析显示,CIH 组小鼠 eWAT 与 scWAT 的脂肪细胞直径显著增大,而 Fer-1 干预可逆转这一变化,提示铁死亡可能参与脂肪细胞肥大过程。免疫荧光染色发现,CIH 组脂肪组织中 F4/80 + 巨噬细胞浸润显著增加,且 NSUN6 在巨噬细胞中的表达水平同步升高,两者的共定位系数较 NA 组提高 2.3 倍;Western blot 结果进一步证实,CIH 组 scWAT 中 NSUN6 蛋白水平上调 1.8 倍,而 Fer-1 处理可使这一指标降低 40%。炎症因子检测显示,CIH 组 eWAT 与 scWAT 中 CCL2 与 IL-6 的蛋白水平分别升高 2.1 倍与 1.7 倍,Erastin 处理可加剧这一趋势,而 Fer-1 则显著抑制炎症因子的释放,提示铁死亡可能是 NSUN6 介导炎症反应的下游事件。
体外实验中,IH 处理可时间依赖性上调 RAW 264.7 细胞中 NSUN6 的 mRNA 表达,24 小时时达峰值(3.2 倍)。NSUN6 敲低后,IH 诱导的铁死亡标志物变化被显著逆转:GPX4 mRNA 水平回升 60%,ACSL4 mRNA 水平下降 45%,线粒体 ROS 生成减少 52%,脂质过氧化水平降低 48%。透射电镜观察显示,IH 处理导致巨噬细胞线粒体肿胀、嵴断裂及空泡化,而 NSUN6 敲低可显著改善线粒体形态。
表型分析发现,IH 组 iNOS+(M1 标志物)细胞比例增加 2.4 倍,CD163+(M2 标志物)细胞比例减少 58%,而 NSUN6 敲低或 Fer-1 处理可使 M1/M2 比例恢复至接近正常水平。炎症因子检测证实,NSUN6 敲低可使 IH 诱导的 CCL2 与 IL-6 分泌分别减少 42% 与 38%,同时伴随 MDA 水平下降 40%,SOD 与 GSH-PX 活性分别升高 35% 与 45%,提示其可减轻氧化应激与炎症反应。值得注意的是,在 NSUN6 敲低的基础上加入 Erastin,可部分逆转上述保护效应,进一步验证了铁死亡在 NSUN6 下游的调控地位。
综合来看,本研究首次揭示 NSUN6 通过促进巨噬细胞铁死亡与 M1 极化,参与 CIH 诱导的脂肪组织炎症过程。生物信息学分析确立了 NSUN6 作为 OSA 潜在生物标志物的价值,动物与细胞实验证实抑制 NSUN6 可通过抑制铁死亡通路,减轻氧化应激与炎症反应。这些发现不仅为理解 OSA 与 MetS 的关联提供了新视角,更为开发靶向 NSUN6 的干预策略奠定了实验基础。
在实验体系中,AbMole 提供的 Erastin 与 Fer-1 作为铁死亡的工具试剂,其稳定的化学特性与明确的作用靶点为机制验证提供了可靠支持,确保了实验结果的可重复性与准确性。后续研究可进一步探索 NSUN6 介导的 RNA 甲基化修饰对铁死亡相关基因的调控细节,以及在其他 OSA 相关靶器官中的作用,从而完善这一调控网络的生物学图景。





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








