基础疾病对新型冠状病毒感染的影响以及新型传感器和生物材料在检测与治疗中的作用
摘要
全世界正在遭受一种由严重急性呼吸综合征冠状病毒2(SARS‐CoV‐2)引起的新类型病毒性疾病。本文简要讨论了SARS‐CoV‐2的基因组测序及其与宿主细胞的相互作用。综述了糖尿病、心脏病和患者年龄等基础疾病对新型冠状病毒感染的影响。详细探讨了SARS‐CoV‐2的可能治疗方法,包括抗病毒药物、中国传统疗法和血浆疗法。目前尚无针对新型冠状病毒肺炎的特效疫苗。然而,文中简要介绍了已有抗病毒药物如氯喹/羟氯喹、瑞德西韦、利托那韦和洛匹那韦的临床试验及其结果。此外,还综述了用于新型冠状病毒感染检测和治疗的新型材料与设备的重要性。基于聚合酶链式反应(PCR)和非PCR检测设备被用于新型冠状病毒肺炎感染检测。与基于PCR的设备相比,非PCR检测设备可提供快速结果。
Key words: 新型冠状病毒肺炎, 基因组序列, 抗病毒药物, 生物材料, sensors
1. 引言
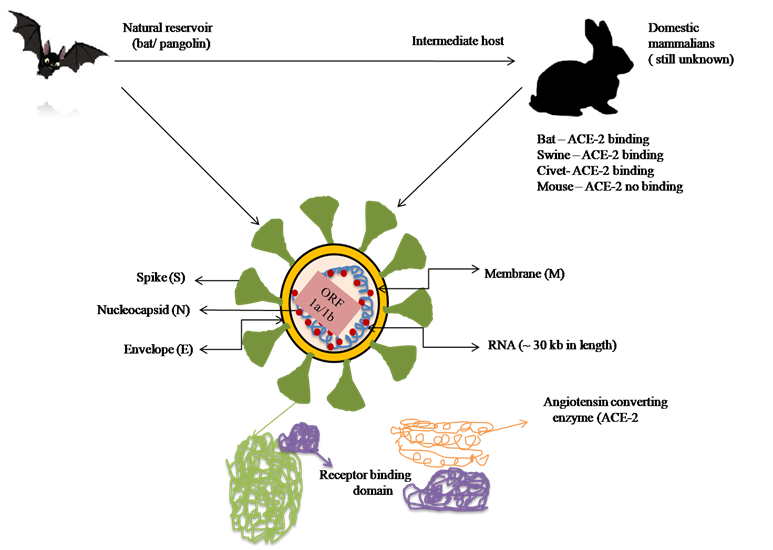
冠状病毒是冠状病毒科(Coronaviridae)和冠状病毒亚科(Coronavirinae)的成员,属于具有最大基因组(25‐32 kb)的大型包膜RNA病毒,其基因组在RNA病毒中是最大的(Richman 等人,2016)。人类冠状病毒(HCoV)的基因组序列包含四个属:α冠状病毒(α)、β冠状病毒(β), γ冠状病毒(γ)和 δ冠状病毒(δ)。在所有四种HCoV中,α和β冠状病毒具有致病性(Woo 等人,2012)。家养哺乳动物(猪、小鼠、蝙蝠等)和人类分别被认为是α和β冠状病毒的起源和宿主 (Lim 等人,2016)。然而,γ和δ冠状病毒分别起源于鸟类和白鲸(Geng 等人,2013)。目前已知有六种β冠状病毒可感染人类呼吸系统。严重急性呼吸综合征冠状病毒(SARS‐CoV)和中东呼吸综合征冠状病毒(MERS‐CoV)是六种已知HCoV中传染性最强的两种[HCoV‐229E、HCoV‐NL63、HCoV‐OC43、 HCoV‐HKU1、SARS‐CoV和MERS‐CoV] (Li 等人,2005)。SARS‐CoV于2002年起源于中国蝙蝠和鸟类,通常以普通感冒为主要症状(Kuiken 等人,2003)。有报告指出,全球约有8000名患者感染了SARC‐CoV(Gual 等人,2003)。然而,SARS‐CoV感染导致的死亡率为~ 10%(Wu 等人,2020)。2014年,在沙特阿拉伯发现了一种新的HCoV—— MERS‐CoV,与SARC‐CoV相似,其死亡率为35%(Morra 等人,2018;Terada 等人, 2014)。MERS‐CoV与SARS‐CoV一样起源于蝙蝠,随后骆驼成为中间宿主(Crossley 等人, 2003;Bermingham 等人,2012)。2019年12月,中国武汉出现了一种新型呼吸道病毒感染,被确认属于HCoV家族。HCoV家族将这种新病毒命名为SARC‐COV‐2,随后世界卫生组织(WHO)将其称为新型冠状病毒肺炎‐2019(COVID‐19)。
各种生物医学设备和生物材料的开发正在持续推进,以用于冠状病毒的检测和治疗(查哈利安等人,2020)。新型冠状病毒肺炎感染的早期识别对于减少传播以及对感染患者的治疗至关重要(波赫雷尔等人,2020)。SARS‐CoV‐2感染的检测可广泛采用现有的各类生物医学设备,如基于聚合酶链式反应(PCR)的方法和非PCR检测方法。SARS‐CoV‐2感染的检测依赖于样本量及样本中所含的分析物,同时也取决于采样来源,例如尿液、血液、肛拭子和口咽拭子已被用于SARS‐CoV‐2病毒的检测(彭等人,2020)。药物的递送在消除大流行中发挥着重要作用(库马尔等人,2020)。纳米生物材料的发展促进了蛋白质和RNA的递送。最近,壳聚糖纳米颗粒已被用于向新型冠状病毒肺炎感染患者递送药物(福缅科等人,2020)。
本文综述了宿主细胞与严重急性呼吸综合征冠状病毒2的相互作用以及既往疾病对新型冠状病毒感染的影响。本综述还详细阐述了来自不同地理区域的严重急性呼吸综合征冠状病毒2感染患者的基因组序列。文章讨论了包括使用抗病毒药物、血浆疗法以及传统治疗在内的可能治疗方法。此外,本文探讨了生物医学设备在新型冠状病毒肺炎感染检测中的重要性,以及用于其治疗的生物材料的最新进展。
2. 新型冠状病毒病‐19的基因组研究
新型冠状病毒2的基因组与严重急性呼吸综合征冠状病毒和中东呼吸综合征冠状病毒的相似性分别为~79%和51.1%(周等人,2020)。然而,它与RaTG13冠状病毒的相似性约为96.2%

表1. 严重急性呼吸综合征冠状病毒‐2(Chu 等,2020)的基因组序列
| gene | 测序 | 测序 |
|---|---|---|
| ORF1b | 正向 | 5’‐TGGGGYTTTACRGGTAACCT‐3’ |
| ORF1b | 反向 | 5’‐AACRCGCTTAACAAAGCACTC‐3’ |
| ORF1b | 探针 | 5’‐TAGTTGTGATGCWATCATGACTAG‐3’b |
| N | 正向 | 5’‐TAATCAGACAAGGAACTGATTA‐3’ |
| N | 反向 | 5’‐CGAAGGTGTGACTTCCATG‐3’ |
| N | 探针 | 5’‐GCAAATTGTGCAATTTGCGG‐3’b |
5’非翻译区和3’非翻译区负责分子间和分子内相互作用,这对于RNA‐RNA相互作用以及细胞蛋白与病毒的结合具有重要意义。在5’端,由非结构蛋白编码的SARC‐CoV、 MERS‐CoV和SARC‐CoV‐2的基因组长度分别为29751、30119和29844碱基对。然而,在3’端,它由刺突蛋白编码,据报道SARS‐CoV、MERS‐CoV和SARC‐CoV‐2分别为21493个氨基酸、1270个氨基酸和1273个氨基酸。印度医学研究理事会(ICMR)已报告印度 SAES‐CoV‐2基因组发生突变。印度SARS‐CoV‐2在ORF1ab、nsp2、nsp3、解旋酶、 ORF8蛋白和S蛋白中存在突变。对印度SARS‐CoV‐2患者的基因组分析显示,它仅靶向一种独特的微小RNA(hsa微小RNA27b)。众所周知,微小RNA存在于人类体内。对印度人群的RNA分析表明,印度人类具有一种独特的RNA,称为hsa微小RNA27b(郭等人,2020)。
hsa微小RNA27b是6种抗病毒RNA中的一种。hsa微小RNA27b的存在可能是导致新型冠状病毒感染率较低的原因之一,可能中和SARS‐CoV‐2感染(郭等人,2020)。
3. 严重急性呼吸综合征冠状病毒2与宿主细胞的相互作用及复制
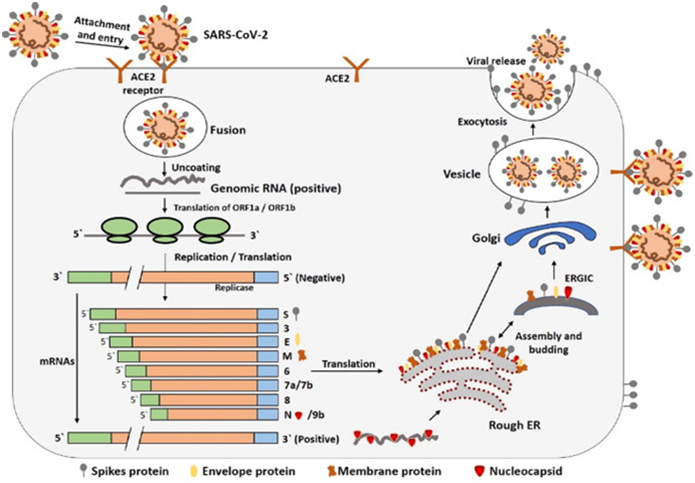
新型冠状病毒SARS‐CoV‐2与宿主细胞的相互作用与SARS‐CoV相似。宿主细胞接触后,细胞受体(ACE‐2)与刺突蛋白结合,启动感染过程(Zhou 等人,2020)。病毒与宿主细胞接触并刺激内吞作用(Kumar 等,2018)。 S糖蛋白被分为两个亚基:S1和S2。S1亚基的主要功能是决定病毒的宿主范围和细胞嗜性(通过受体结合域RBD),而膜融合则由S2亚基在内体中完成(Zhang 等人,2014)。随后,基因组RNA(gRNA)被释放到细胞质中。脱壳 RNA的主要功能是将ORF1a和ORF1ab转化为多聚蛋白pp1a和pp1ab(Xia 等人,2020)。
ORF1a编码产生16种非结构蛋白,这些蛋白在双层膜囊泡(DMV)内形成复制‐转录复合物(RTC)。此外,gRNA开始复制并形成核衣壳(Sawicki 等,2005)。新生成的病毒颗粒在内质网‐高尔基体中间区室(ERGIC)聚集,并出芽进入管腔。最终,细胞膜与之融合病毒粒子释放人类冠状病毒(侯赛因等,2005)。SARS‐CoV‐2的相互作用和复制在图2中进行了示意图表示。
 爱思唯尔许可复制])
爱思唯尔许可复制])
刺突蛋白与血管紧张素转换酶2(ACE‐2)的结合是SARS‐CoV‐2相互作用的主要因素之一(阿尼凯特等,2020)。存在多种宿主因子,例如干扰素诱导跨膜蛋白(IFITMs),可抑制人类冠状病毒(HCoV)的结合。由于IFITMs蛋白对RNA病毒具有抗病毒抵抗力,因此可抑制其与先前存在的HCoV(如SARS‐CoV、HCoV‐NL63和HCoV‐229E)的结合(王等, 2020)。最近有报道称,SAR‐CoV‐2的结合效率比SARS‐CoV高出约10‐20倍(莱特科等人, 2020)。研究结果表明,SARS‐CoV‐2比其他人类冠状病毒更容易附着(谢琳等,2020)。
4. 人类冠状病毒的先天免疫反应
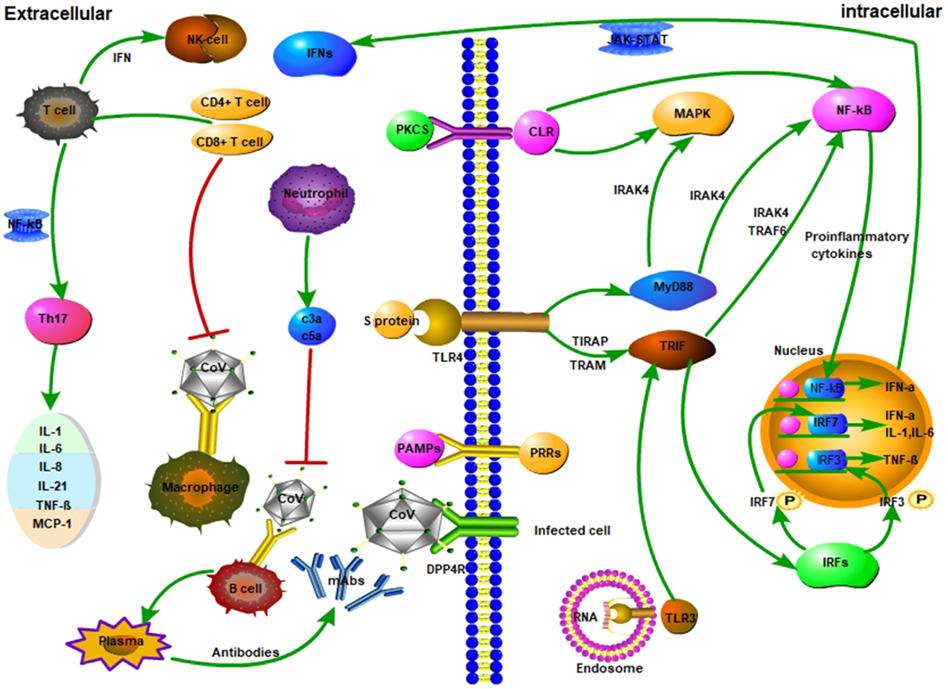
人类的先天免疫是影响人类冠状病毒感染的因素之一。宿主的先天免疫系统主要通过识别病毒发挥作用(明等人,2011)。病原体相关分子模式通过模式识别受体(PRRs)进行识别。
目前公认的PRRs包括Toll样受体(TLR)、C型凝集素样受体(CLmin)以及细胞质中的游离分子受体,如IFI16、DAI(李等人,2020年)。
在细胞外相互作用中,巨噬细胞被HCoV感染,随后T细胞呈现冠状病毒抗原(谢琳等, 2020)。 T细胞的活化和分化产生来自不同T细胞亚基的细胞因子。这些细胞因子负责刺激免疫反应(明等人,2011)。然而,这些细胞因子的过量产生可能损伤CD8 T细胞和自然杀伤细胞(NK细胞)(埃尔莫拉耶娃等人,2008)。此外,在细胞内宿主中,HCoV通过刺突蛋白与宿主细胞上的DPP4受体相互作用。这种结合使基因组RNA进入细胞质,可在HCoV复制期间部分触发针对双链RNA(dsRNA)的免疫反应(川合等人,2010)。Toll样受体(TLR)可识别病毒和细菌的核酸、脂质和脂蛋白(凯尔等人,2015)。TLR‐3被双链RNA( deRNA)激活,而IRFs和NF‐κB等信号通路则产生I型干扰素(IFNs)和细胞因子。I型干扰素增加抗病毒蛋白的产生,有助于保护健康细胞(未感染细胞)(谢琳等,2020)。 此外,辅助蛋白可能在双链RNA复制期间影响抗病毒蛋白的产生。因此,TLR‐4通过MyD88信号通路介导细胞因子的产生。大量产生的细胞因子和趋化因子可加剧HCoV感染中的感染细胞[图 3]。
 )
)
细胞外细胞因子通过人类冠状病毒与巨噬细胞相互作用后产生,随后由T细胞产生细胞因子。在细胞间区域,刺突蛋白与人类冠状病毒相互作用,显示出细胞质中的基因组RNA。双链 RNA与Toll样受体(TLR‐3和TLR‐4)相互作用,从而产生抗病毒蛋白。抗病毒蛋白通过保护未感染细胞来增强宿主细胞的免疫力。
5. 新型冠状病毒感染
新型冠状病毒患者在全世界范围内迅速增加。SARC‐CoV‐2在先前存在的HCoV中具有高度传染性。SARC‐CoV‐2的潜伏期和感染期据报道分别为4.6天和5天(弗格森等人,2020)。新型冠状病毒肺炎对心血管、糖尿病以及年龄等基础疾病有影响。
5.1 老年患者中的新型冠状病毒感染
世界卫生组织欧洲区域主任指出:“老年人面临最高的新型冠状病毒肺炎风险,但所有人都必须采取行动防止社区传播”。全球新冠肺炎患者报告表明,与年轻人相比,老年人感染的可能性更高(杨等人,2020)。根据中国疾病预防控制中心的现有报告,大约80%的死亡患者年龄超过60岁。然而,在意大利,这一年龄为~ 81岁(阿龙森等人,2020)。据报道,约三分之一的美国死亡患者(新型冠状病毒肺炎)年龄在65岁左右。在意大利,老年(< 80岁)患者的病死率较高,达到~ 20%;而中国同类患者的病死率为~ 14%(格拉塞利等人,2020)。
老年人更容易出现急性呼吸衰竭的情况,这是一种导致大量死亡的急性肺部感染(格尔斯特等人,2015)。此外,也有研究表明,该病毒更可能对心脏造成损害,患者可能因心脏病发作而死于新型冠状病毒肺炎(世卫组织团队,2020)。
5.2 新型冠状病毒感染对心血管疾病患者的影响
心血管疾病患者感染SARS‐CoV‐2的风险较高,这在SARS‐CoV和MERS‐CoV感染中已有报道。与SARS‐CoV相比,心脏病患者中MERS‐CoV感染的病例更多(巴达维等人,2016)。此外,约30%的MERS‐CoV感染患者患有心脏病(吴等人,2017)。最近一份关于重症新冠肺炎患者的报告显示,~ 58%的患者患有高血压,25%的患者患有心脏病(陈等人,2020)。早期关于新型冠状病毒肺炎的报告表明,约12%的新冠肺炎患者出现急性心脏损伤(张等人, 2020)。然而,这些患者死亡风险较高(黄等人,2020)。中国疾控中心,2020对99例患者的报告指出,~ 40%的新型冠状病毒肺炎患者患有心血管疾病。但另一项研究显示,约10.5 %的死亡患者患有心血管疾病(希等人,2020)。多项报告指出,重症新冠肺炎患者的心律失常发生率显著高于轻症和普通病例(许等人,2020)。(王等,2020)研究了138例新型冠状病毒肺炎患者,发现~ 17%的患者出现心律失常。冠状病毒可直接损害高血压患者的心脏,因为高血压会损伤动脉并减少血流
5.3 新型冠状病毒感染在糖尿病患者中的情况
糖尿病是一种无法治愈的疾病,伴有多种分子和血管异常,可改变致病反应(Knappet, 2013)。据报道,在先前出现的病毒(甲型流感病毒(H1N1)、严重急性呼吸综合征冠状病毒和中东呼吸综合征冠状病毒)感染中,糖尿病患者的死亡率显著更高(张等人,2020)。与正常人相比,糖尿病患者感染严重急性呼吸综合征冠状病毒2的风险更高(Onder 等人, 2020)。对173例新型冠状病毒肺炎阳性患者的初步研究结果表明,约16.2%的患者患有糖尿病(Onder 等人,2020)。患有糖尿病的严重急性呼吸综合征冠状病毒2感染患者的死亡率与严重急性呼吸综合征冠状病毒和中东呼吸综合征冠状病毒患者相似。根据72,314例新型冠状病毒肺炎病例报告,病死率为~ 2.3%。然而,患有糖尿病的新型冠状病毒感染者病死率上升至7.3%。在糖尿病患者中,新型冠状病毒肺炎患者的严重并发症和死亡率明显高于非糖尿病患者。感染新型冠状病毒肺炎的糖尿病患者发生高血糖、糖尿病酮症酸中毒、肺炎和脱水等并发症的风险更高。这些人群处于更高的应激状态,导致高血糖激素释放增加,从而升高血糖水平并引起异常血糖波动(王等,2020)。然而,大约10%的2型糖尿病患者在感染严重急性呼吸综合征冠状病毒2后被观察到出现低血糖(< 3.9 mmol / L)(周等人,2020)。高血糖症和胰岛素抵抗会促进糖基化终产物和炎症细胞因子的大量产生,从而
ACE‐2已被确认为SARS‐CoV‐2的有效受体。由于ACE‐2具有减轻炎症的作用,因此被建议作为糖尿病治疗的药物(Fang等人,2020年)。因此,接受ACE‐2治疗的糖尿病和新型冠状病毒感染患者感染风险更高(扎卡里,2020)。二肽基肽酶‐4(DPP‐4)已被报道为中东呼吸综合征冠状病毒的受体(莱特科等人,2020)。此外,DPP‐4可用于降低血糖水平,因此 DPP‐4可能对SARS‐CoV‐2感染具有保护作用(法迪尼尔等人,2020)。另一项研究结果表明,糖尿病患者对SARS‐CoV‐2感染并不更易感,但其病死率明显高于普通SARS‐CoV‐2患者(佐皮尼等人,2018)。总之,由于免疫系统较弱,糖尿病患者出现并发症的风险更高,从而导致病死率上升。多项报告指出,老年糖尿病患者相较于年轻糖尿病患者有更高的新型冠状病毒感染风险。值得注意的是,新冠肺炎患者的症状与流感非常相似,在许多情况下会导致患者在极短时间内死亡。因此,有效的早期治疗首先需要准确的疾病诊断。由于该疾病进展迅速、症状非特异性,且患者在短期内死亡,因此需要具备足够敏感性和特异性的检测方案以准确识别该疾病。尤为重要的是,新冠病毒为单链且快速突变的病毒,这就要求传感器必须具有强健性、对突变不敏感、快速响应,并在疾病发病初期对病毒检出高度敏感,同时假阳性结果最少。基于此原因,基于PCR的检测试剂盒是最合适的选择。
6. 新型冠状病毒感染治疗
针对大流行性严重急性呼吸综合征冠状病毒2的特异性疫苗的研发正在进行中。由于新型冠状病毒感染患者的主要问题是呼吸系统受损,因此对新冠肺炎患者的治疗主要集中在对症和呼吸支持上(Colson 等人,2020)。最初,所有新冠肺炎患者都会接受氧疗(Marmor 等,2016)。尽管迄今为止尚未发现针对严重急性呼吸综合征冠状病毒2的特异性药物,但医学观察者正在尝试使用不同的抗病毒药物来治疗新型冠状病毒感染(Dong 等人,2020)。
6.1. 抗病毒药物
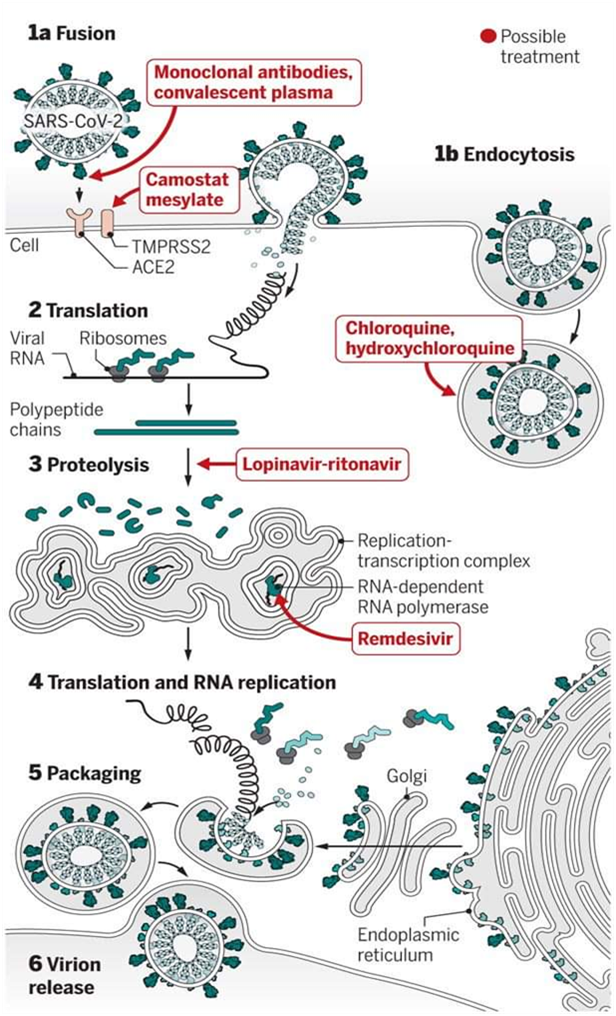
已开发出多种抗病毒药物用于治疗人类免疫缺陷病毒、流感、埃博拉、严重急性呼吸综合征冠状病毒和中东呼吸综合征冠状病毒等病毒感染(Marmor 等,2016)。在过去几十年中,在严重急性呼吸综合征冠状病毒和中东呼吸综合征冠状病毒暴发后,已开发出包括核酸和病毒酶在内的多种抗病毒药物(McCreary 等人,2020)。为持续推进新型冠状病毒肺炎特异性药物的研发,世界卫生组织决定对现有抗病毒药物进行大规模临床试验[(1) 瑞德西韦,(2) 氯喹和羟氯喹,(3) 利托那韦和洛匹那韦,(4) 利托那韦和洛匹那韦联合干扰素‐β)] ,用于 SARS‐CoV‐2感染的治疗(Kupferschmidt等人,2020年)。瑞德西韦(GS‐5734)曾用于西非埃博拉的治疗(Sheahan 等人,2017)。瑞德西韦中的活性三磷酸核苷可与RNA结合,作用于RNA聚合酶并作为RNA链终止剂(Sheahan 等人,2020)。瑞德西韦(EC50= 0.07 % μM)已被应用于严重急性呼吸综合征冠状病毒和中东呼吸综合征冠状病毒的药物研究(王 等,2020)。此外,EC50= 0.77% μM的瑞德西韦被用于在Vero E6细胞系中对 SARS‐CoV‐2进行持续48小时的in-vitro分析(Gordon 等,2020)。最近,华盛顿州斯诺霍米什县一名年轻的新型冠状病毒肺炎感染患者接受了瑞德西韦治疗,并于次日康复(王等, 2020)。然而,加利福尼亚州一名新型冠状病毒肺炎患者的病例报告表明,使用瑞德西韦并无明显疗效(Michelle 等人,2020)。
在过去几十年中,由于氯喹(4‐氨基喹啉)和羟氯喹具有抗病毒和抗炎活性,已被用作预防疟疾、类风湿性关节炎和红斑狼疮以及SARS‐CoV感染的主要疫苗(Gao 等人,2020)。除了其抗病毒能力外,氯喹还具有调节免疫力的能力,可在口服后增强体内抗病毒效果。因此, 氯喹可被用作疫苗以减少SARS‐CoV‐2感染(Touret 等人,2020)。然而,另一项在中国新冠肺炎患者中进行的研究表明,一种新型抗病毒药物瑞德西韦与氯喹的联合使用
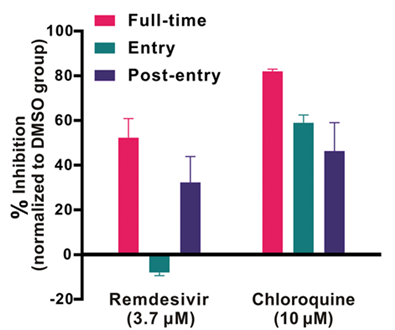
洛匹那韦和利托那韦抗病毒药物组合曾用于治疗人类免疫缺陷病毒(Chu等人,2004年)。然而,这些药物也被发现有助于抑制严重急性呼吸综合征冠状病毒/中东呼吸综合征冠状病毒感染。最近,洛匹那韦和利托那韦的组合已在中国新型冠状病毒感染患者中应用,但效果并不理想,因为洛匹那韦和利托那韦的使用可能造成肝脏损伤(Aspiroz等人,2011年)。利托那韦、洛匹那韦与干扰素‐β联合使用可抑制中东呼吸综合征冠状病毒感染(Chan等人,2015年)。在另一项研究中,硝唑尼特被报道对埃博拉、中东呼吸综合征冠状病毒和流感病毒具有抗病毒活性。硝唑尼特(EC50剂量为0.92 μM)曾用于预防中东呼吸综合征冠状病毒感染( Savarino等人,2006年)。最近,EC50 (2.12 μM)被用于体外治疗新型冠状病毒感染的 Vero E6细胞系in-vitro.据报道,多种用于治疗新型冠状病毒感染的抗病毒药物的有效性( Zumla等人,2016年)。图5展示了氯喹和瑞德西韦对抑制新型冠状病毒感染的作用。氯喹和瑞德西韦的试验已在Vero E6细胞上进行。试验期间,药物预处理时间为1小时(完整时间)[图 5]。随后引入病毒(2小时),将病毒与药物的混合物提取后,细胞在含药物的培养基中培养。然而,在“进入”治疗中,药物在病毒附着前1小时加入细胞;在“进入后”试验中,药物在病毒进入后2小时加入,并持续保留在体系中直至实验结束(图5)。
6. 新型冠状病毒感染治疗(续)
因此,先前开发的抗病毒药物可用于新型冠状病毒肺炎治疗。表2 总结了用于治疗病毒感染的抗病毒药物。
表2. 针对已有疾病的抗病毒药物 [改编自郭等人,2020;开放获取]
| 序号 | Drug | 状态 | 靶向疾病 | Ref |
|---|---|---|---|---|
| 1. | 核酶 | 临床前 | 人类冠状病毒 | (Tchesnokov 等人,2019) |
| 3. | 洛匹那韦/利托那韦 | 已批准 | 艾滋病,严重急性呼吸综合征,MERS | (茨维特科维奇 等人,2003) |
| 4. | 硝唑尼特 | 已批准, | 人类/动物 冠状病毒 | (伊兹萨 等人,2018) |
| 5. | 利巴韦林 | 已批准, | 艾滋病,严重急性呼吸综合征,中东呼吸综合征 | (伊兹萨 等人,2018) |
| 7. | 香蕉素和 5‐羟基色原酮 衍生物 | 临床前 | 人类冠状病毒 | (Philippe et 等人, 2020) |
| 8. | 洛匹那韦、N3、CE‐5 和 GRL‐001 | 临床前 | 严重急性呼吸综合征冠状病毒,中东呼吸综合征‐ 人类冠状病毒, HCoV‐229E, HCoV‐NL63 和 动物冠状病毒 | (Chan 等,2003) |
| 9. | 格里夫斯汀 | 临床前 | 严重急性呼吸综合征冠状病毒,中东呼吸综合征‐ 冠状病毒,HCoV‐229E, HCoV‐OC43,人类免疫缺陷病毒,HCV | (奥基夫 et al.,2010) |
| 10. | 法匹拉韦(T‐705) | 研究中 | A(H1N1) | 等人, 2020) |
| 11. | 氯喹 | 已批准, 研究中, 兽用已批准 | 疟疾,自身免疫性疾病 | (萨瓦里诺 等人,2003) |
| 12. | 奥司他韦 | 已批准 | 甲型流感病毒 | (麦克奎德 等人,2015) |
| 13. | 喷昔洛韦/阿昔洛韦 | 已批准 | 单纯疱疹病毒, 水痘‐带状疱疹 病毒 | (Shiraki, 2018) |
| 14. | 更昔洛韦 | 已批准,研究中 | 与艾滋病相关的 巨细胞病毒 感染 | (Furuta et al., 2013) |
| 15. | 法匹拉韦 (T‐705) | 研究中 | 法匹拉韦 (T‐705) | (Goldhill et al., 2018) |
| 16. | 硝唑尼特 | 已批准, 研究中, Vetapproved | 多种 病毒 包括 人类/动物 冠状病毒 | (Rossignol, 2014年) |
6.2. 中医常规治疗
抗病毒药物的使用会对人类健康产生不良反应。因此,已采用各种常规治疗来治疗新型冠状病毒感染。最近的中国报告指出,中药可能是减轻SARS‐CoV‐2感染的潜在替代方案(任等人, 2020)。研究发现,肺是新冠肺炎患者的主要感染器官(~ 90%)。然而,湿毒疫是感染的主要原因。中医药旨在通过常规方法治疗受损器官(国家卫生健康委员会
6.3. 新冠肺炎的血浆疗法
在缺乏特效药物的情况下,多种抗病毒药物和疗法被用于救治新型冠状病毒感染患者。由于抗病毒药物对人体具有有害的副作用,其使用受到限制。然而,传统治疗方法对重症感染患者效果不佳。康复期血浆疗法已被认为是治疗危重患者最有效的方法之一(詹金斯等,2015)。康复期血浆疗法是一种利用已康复患者血液中的抗体来治疗病毒感染患者的技术(赖,2015)。2014年,世界卫生组织将康复期血浆疗法宣布为埃博拉疫情期间的试验性治疗方法(程等, 2005)。使用康复期血浆疗法可降低中东呼吸综合征冠状病毒、埃博拉和甲型H1N1流感病毒感染患者的死亡率(阿拉比等,2015)。观察发现,康复期血浆疗法是治疗重症新型冠状病毒感染患者的更好选择。新型冠状病毒肺炎康复患者的血液中含有特异性的抗冠状病毒抗体。这些血液抗体的血清可用于治疗重症感染患者。这些抗体能够抑制病毒复制,并增强患者的免疫反应。一项研究报告指出,血浆治疗在新型冠状病毒感染初期(症状出现后14天内)更为有效。晚期使用血浆疗法效果较差,并会增加
- 血浆捐献者的体温必须正常超过3天。
- 血浆捐献者至少有两次连续的严重急性呼吸综合征冠状病毒2阴性报告。
- 血浆必须从符合21 CFR 630.15范围内进行血浆单采术的捐献者中采集。
- 捐献者在血浆采集时需有阳性的血清学检测报告。
如果在感染早期开始血浆疗法,并考虑捐献者和受体的资格因素,则可能成为新型冠状病毒肺炎的有效治疗手段。除了康复期血浆疗法的成功案例外,一份研究报告还指出了血浆治疗相关的风险因素。血浆治疗可能在少数患者中失败,从而加重新型冠状病毒感染,还可能影响患者的免疫系统,进而导致再感染。尽管存在这一风险因素,血浆疗法已在全球范围内被潜在用于新冠肺炎患者的治疗。
7. 封锁对新型冠状病毒感染的影响
了解社交距离有助于减少新型冠状病毒感染。最近,所有感染新型冠状病毒的国家都实施了封锁措施,以在公共场所保持社交距离。已有研究展示了考虑与不考虑季节性效应情况下社交距离的效果(基斯勒等人,2020)。采用了线性数学模型来估计传播动态,该模型此前曾用于HCoV‐OC43和HCoV‐HKU1的研究(里德等人,2020)。传播率[β(t)]与基本传播率[R0(t)]成正比(瓦林加等人,2007)。
β(t)]= γ R0(t)
其中,γ是个体康复率。
一次性社交距离(20周)数据显示,传播率大约降低了60%。然而,更长时间且严格的临时社交距离对降低新型冠状病毒肺炎的基本传播率并不更有效(卢等人,2020)。图6表示未考虑季节性效应的新型冠状病毒感染动态。在整个情景中,传播率保持恒定(2.2)。社交距离的效果范围从零到R0的60%减少。长期(20周)社交距离的平均峰值最低,总疫情持续时间最短。与临时社交距离情景相比,长期社交距离的成功率更高(20‐40%)(卢等人,2020)。
 4周,(B) 8周,(C) 12周,(D) 20周,以及(E) 无限期。图表(至 ) 表示累积感染规模与群体免疫阈值(黑色横条)[。转载自(基斯勒等人,2020;开放获取]。)
4周,(B) 8周,(C) 12周,(D) 20周,以及(E) 无限期。图表(至 ) 表示累积感染规模与群体免疫阈值(黑色横条)[。转载自(基斯勒等人,2020;开放获取]。)
8. 新型冠状病毒肺炎的医疗器械与生物材料
生物医学设备在疾病检测以及药物递送系统中发挥着重要作用。患者的新型冠状病毒感染可通过病理学、免疫学和分子生物学仪器进行检查。新型冠状病毒具有较高的分子量(140 千道尔顿),编码 3800 个DNA碱基对,表明其需要药物递送系统(张等人,2020)。这些疫苗可以通过脱氧核糖核酸、信使核糖核酸或蛋白质进行递送(Kowalski 等,2019)。用于防护装备的材料,如防护服、口罩和手套,也是控制新型冠状病毒感染的重要因素。防护服研发中的一些挑战包括抗毒性差、透气性和散热性能不佳。然而,对气溶胶防护能力低、手套和口罩的重复使用是其主要问题(Itani 等,2020)。就新型冠状病毒肺炎治疗而言,有效检测设备的作用变得尤为重要。目前有多种传感设备用于检测新型冠状病毒感染,相关内容将在下一节中讨论。
8.1 新型冠状病毒肺炎检测
基于聚合酶链式反应(PCR)和非PCR检测方法均用于识别SARS‐CoV‐2感染。基于PCR的方法包括PCR、实时PCR(RT‐PCR)、逆转录酶PCR(RT‐r PCR)、实时定量PCR( RT‐qPCR)、Taq Man法实时RT‐PCR和双Taq Man探针法RT‐PCR,这些方法常被用作金标准(Wan 等,2016)。
8.1.1 实时PCR
在逆转录聚合酶链式反应(RT‐PCR)中,首先通过逆转录将RNA转化为互补DNA(Tahamtana 等,2020)。RNA转录为DNA的过程需要针对目标RNA序列进行引物设计,随后加入dNTs、逆转录酶(酶)和无核酸酶缓冲液,从而将RNA转化为扩增的cDNA靶标(卢 等人,2020)。该转录与扩增过程需要加热和冷却循环。所产生的cDNA可通过凝胶电泳或基因测序进行鉴定(贝尔姆等人,2020)。在RT‐PCR中,靶标扩增可相对容易地进行监测和定量。然而,RT‐PCR的应用需要昂贵的成本
逆转录聚合酶链式反应(RT‐PCR)仪器及其后续分析相当复杂(达拉瓦特等人,2020)。为了减少样本处理后的操作、实现特异性靶标扩增并获得可靠结果,已在RT‐PCR系统中引入TaqMan探针。
8.1.2. 基于Taq Man探针的逆转录聚合酶链式反应(RT‐PCR)
其5’端带有荧光染料,3’端带有淬灭剂。当TaqMan探针与靶序列结合时,淬灭剂与报告染料分离,荧光信号被释放(贝尔姆等人,2020)。同时,延伸中的引物到达3’端,由于内切核酸酶活性而切断淬灭剂。这种检测方式可实现对核酸靶标的非常特异、敏感和特异的识别。需要注意的是,基于PCR的核酸检测可能需要热循环仪或定量PCR仪,这些设备成本较高,且不具备现场检测能力。此外,微滴数字PCR(dd‐PCR)也被用作新型冠状病毒肺炎检测的传感装置。
8.1.3. 微滴数字PCR
dd‐PCR是一种新技术,使用TaqMan探针(余等人,2020)。扩增在分散液滴相中进行,其中分散相由水油乳液构成(泰勒等人,2017)。由于具有较大的表面积以及扩增前大量液滴步骤,反应显著增强。作为案例研究,对来自76名患者的336份样本同时采用逆转录聚合酶链式反应(RT‐PCR)和dd‐PCR检测严重急性呼吸综合征冠状病毒2(SARS‐CoV‐2)。结果显示,使用RT‐PCR时,95份样本为阳性,161份为阴性,67份为单基因阳性;而dd‐PCR检测显示95份样本为阳性,且RT‐PCR的Ct值与dd‐PCR测定的拷贝数高度相关,靶向目标为 ORF1ab片段。此外,研究发现,在67份单基因阳性的样本中,dd‐PCR检测显示26份为阴性, 41份为严重急性呼吸综合征冠状病毒2阳性。研究得出结论:RT‐PCR和dd‐PCR均具有较高准确性,但在病毒载量较低时,dd‐PCR更为准确。
8.1.4 非PCR检测设备
非PCR方法包括自持续序列复制、等温多重置换扩增、基于核酸序列的扩增、环介导等温扩增DNA(LAMP)、实时LAMP和实时定量LAMP(RT‐qLAMP)(周等人,2019)。其中,等温方法因其简便性而变得流行。
本质上,观察到在大多数情况下,RT‐LAMP方法被用于检测严重急性呼吸综合征冠状病毒2,而在少数情况下使用了RT‐PCR。当无法获得实时热循环仪时,RT‐LAMP为即时检测诊断提供了一种可行方案。然而,基于RT‐LAMP的技术存在样本交叉污染或气溶胶污染的可能性,足以裂解靶标RNA样本(北川等人,2020)。此外,引物设计需要格外谨慎,因为可能发生非特异性扩增。为了特异性而设计的发夹结构或突变会减缓退火动力学,从而延长分析时间。尽管如此,目前RT‐LAMP仍为大流行提供了应对方案(魏等人,2020)。
表3:用于检测Orf2ab和刺突基因片段的引物
| Sr. No. | 序列 | 用于靶向的片段 | Ref |
|---|---|---|---|
| 1. | orf1ab‐4F3 | GGTATGATTTTGTAGAAAACCCA | (Islam 等人 等人,2015) |
| 2. | orf1ab‐4B3 | CAACAGGAACTCCACTACC | (Islam 等人 等人,2015) |
| 3. | orf1ab‐4FIP | GGCATCACAGAATTGTACTGTTTTT GCGTATACGCCAACTTAGG | (Islam 等人 等人,2015) |
| 4. | orf1ab‐4BIP | AATGCTGGTATTGTTGGTGTACTGA GGTTTGTATGAAATCACCGAA | (Islam 等人 等人,2015) |
| 5. | orf1ab‐4LF | AACAAAGCTTGGCGTACACGTTCA | (Islam 等人 等人,2015) |
| 6. | S‐123F3 | TCTATTGCCATACCCACAA | |
| 7. | S‐123B3 | GGTGTTTTGTAAATTTGTTTGAC | |
| 8. | S‐123FIP | CATTCAGTTGAATCACCACAAATGT GTGTTACCACAGAAATTCTACC | |
| 9. | S‐123BIP | GTTGCAATATGGCAGTTTTTGTACAT TGGGTGTTTTTGTCTTGTT | |
| 10. | S‐123LF | ACTGATGTCTTGGTCATAGACACT | |
| 11. | S‐123LB | TAAACCGTGCTTTAACTGGAATAGC | |
| 12. | nCoV N‐F3 | TGGACCCCAAAATCAGCG | (Taylor et 等人, 2017年) |
| 13. | nCoV N‐B3 | AGCCAATTTGGTCATCTGGA | (Taylor et 等人, 2017年) |
| 14. | nCoV N‐FIP | CGTTGTTTTGATCGCGCCCC‐ ATTACGTTTGGTGGACCCTC | (Taylor et 等人, 2017年) |
| 15. | nCoV N‐BIP | ATACTGCGTCTTGGTTCACCGC‐ ATTGGAACGCCTTGTCCTC | (Taylor et 等人, 2017年) |
| 16. | nCoV N‐LF | TGCGTTCTCCATTCTGGTTACT | (Taylor et 等人, 2017年) |
| 17. | nCoV N‐LB | TCTCACTCAACATGGCAAGGAA | (Taylor et 等人, 2017年) |
8.2. 生物材料在新型冠状病毒肺炎中的重要性
最近,各种聚合物如聚丙烯(PP)、聚偏氟乙烯(PVDF)和聚四氟乙烯(PTFE)被用于制备防护用具(科雷亚等人,2020)。防护用具包括口罩和面罩。聚丙烯用于制备认证口罩,如N95、FFP2、FFP3和外科口罩(曹等人,2020)。而聚碳酸酯(PC)和聚对苯二甲酸乙二醇酯(PET)则用于制备面罩(皮埃蒙特塑料公司;2020)。研究表明,在药物递送系统中使用纳米生物材料可增强抗病毒药物的活性(库马尔等人,2020)。最近,多种有机纳米颗粒,包括脂质和聚合物纳米颗粒,已被用于脱氧核糖核酸和信使核糖核酸的递送(英杰等人,2020)。脂质体等脂质纳米颗粒由于其球形结构和增强的生物相容性,适用于药物递送(伊斯兰等人,2015)。最近,莫德纳使用带负电荷的离子化脂质体递送编码严重急性呼吸综合征冠状病毒2刺突蛋白的信使核糖核酸(科恩等人,2020)。其中
9. 结论
新型冠状病毒感染在全球范围内持续增加。本文综述了严重急性呼吸综合征冠状病毒2的基因组序列及其与宿主细胞的相互作用。血管紧张素转换酶2(ACE‐2)已被确定为严重急性呼吸综合征冠状病毒2的主要受体。文章讨论了糖尿病、高血压和年龄因素等基础疾病对感染及严重急性呼吸综合征冠状病毒2病死率的影响。目前用于治疗新冠肺炎患者的已有抗病毒药物包括瑞德西韦、羟氯喹、利托那韦和洛匹那韦。使用羟氯喹和阿奇霉素(EC50= 0.72%μM)治疗7天后,可减少~ 50%的严重急性呼吸综合征冠状病毒2增殖。大量基于PCR和非PCR的生物医学设备被广泛用于新型冠状病毒肺炎感染检测。非PCR检测设备可提供快速结果。聚丙烯、聚碳酸酯和聚对苯二甲酸乙二醇酯等生物材料分别用于口罩和护罩的制造。壳聚糖纳米颗粒可用于将抗病毒药物递送至感染部位。




















 53
53

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








