功能化金刚石纳米颗粒作为药物递送系统:载药与释放研究
1 | 引言
尿路感染(UTI)是一些最常见的细菌感染,每年在全球影响约1.5亿 人。随着细菌对抗生素的耐药性变得越来越普遍, 因此,有必要通过使用纳米颗粒进行靶向药物递送等替代治疗方法来 降低剂量并减少副作用(福克斯曼,2014年)。由于纳米颗粒尺寸小 (<200纳米米)且表面积大,能够穿过活细胞的细胞壁,高效地将 药物递送到细胞内,从而减少副作用。
尿路感染(UTIs)是美国第二常见的传染病,每年治疗费用约为35亿美元。随着对 抗生素的耐药性日益普遍,迫切需要开发替代疗法,包括用于治疗尿路感染的低剂量 和细胞靶向抗生素。纳米金刚石颗粒(NDPs)因其稳定的惰性核心以及反应性强但 可功能化的表面,成为有吸引力的药物递送平台。此外,金刚石纳米颗粒表现出多种 稳定的光发射波长,这使得其中一种或多种光学发射可用于基于光信号转导的生物传 感应用。最近,我们的研究首次证明了在纯化并经聚乙烯亚胺(PEI)功能化的 NDPs上实现稳定的阿莫西林负载。本研究论文进一步对负载阿莫西林的纳米金刚石 颗粒进行了研究,定量分析了6和25纳米纳米金刚石颗粒上的阿莫西林负载量,并研 究了在不同pH值条件下的阿莫西林释放情况,同时检测了这些纳米金刚石颗粒是否 存在PEI的释放。由于紫外‐可见分光光度计无法直接检测PEI,我们开发了一种将铜 离子结合到聚乙烯亚胺聚合物上的技术,从而可在阿莫西林存在的情况下通过紫外‐可 见光谱追踪和检测PEI。结果表明,每1克PEI功能化的6纳米或25纳米纳米金刚石颗 粒分别成功负载了19毫克和48毫克阿莫西林,该结果通过傅里叶变换红外光谱、动态 光散射(DLS)和紫外‐可见表征得到验证。本文解释了与PEI相关的药物释放机制, 结果显示在pH 4和体温条件下,约85%的药物在20小时内被释放。研究结果还表明, 在阿莫西林释放过程中,25纳米纳米金刚石颗粒没有发生PEI释放,这一特性可能成 为药物递送中的治疗益处特性。
特定药物的效果和成本。为了用作药物靶向递送的平台,纳米颗粒还 必须经过功能化处理,具有低毒性特征且具备生物相容性(法拉吉和 威普夫,2009;谭和格林,2010)。纳米金刚石颗粒(NDPs)具有 多种医学上的显著优势,例如化学惰性、光学透明性和生物相容性 (莫查林、申杰罗娃、何和戈戈齐,2012;大泽和何,2012),同时 其加工过程仍然简单且成本低廉(达尼连科,2004,2005)。此外, NDPs的低毒性(艾耶尔等人,2018;Schrand 等人,2007)和高 细胞摄取率使其成为某些蛋白质类和化疗药物的理想载体(陈等人, 2010;周等人,2011;希姆库纳斯等人,2009)。经低毒性聚乙烯 亚胺(PEI)功能化的NDPs已被用于脱氧核糖核酸、小干扰RNA (陈等人,2010)以及基因递送(张等人,2009)。此外,金刚石 纳米颗粒表现出多种稳定的光发射波长,为利用一种或多种光学发射 进行基于光信号转导的生物传感应用提供了巨大可能性。
在之前的一项研究中,我们首次证明了成功纯化6和25纳米纳米 金刚石颗粒(NDPs)、对25纳米NDPs表面进行聚乙烯亚胺(PEI) 功能化,并将阿莫西林负载到NDPs上的方法(Rouhani等人, 2016年)。在另一项研究中,我们证实了酸处理NDPs无毒,并可被 人体膀胱细胞系摄取(艾耶尔等人,2018)。由于药物递送系统的目 的是在目标介质中释放药物,因此必须研究药物载体中的任何部分 (例如PEI)是否会随阿莫西林一同释放。PEI无法通过紫外‐可见光 谱直接检测,但安加罗、德罗莎、米罗和夸利亚(2003)表明,向 PEI中添加硫酸铜可形成铜氨络合物,该络合物可通过紫外‐可见光谱 检测。然而,由于阿莫西林的存在会导致峰重叠,因此无法使用硫酸 铜或硝酸铜来追踪PEI。为解决此问题,我们首次开发了一种利用氧 化铜颗粒在阿莫西林释放过程中追踪PEI的技术。在本研究中,我们 系统地研究了在不同pH值和温度下,6和25纳米NDPs上PEI和阿莫 西林的负载量及释放量的定量分析。我们还探讨了PEI及表面电荷对 NDPs载药量和释放量的影响。
2 | 材料与方法
平均粒径为25纳米的单晶NDPs和平均粒径为6纳米的爆轰合成 NDPs分别购自先进磨料公司和纳米结构与非晶材料公司。聚乙烯亚 胺(PEI)溶液(50% w/v的PEI水溶液)购自弗鲁卡。氧化铜(II) (97%)购自阿尔法艾瑟。表征仪器包括配备PIKE VeeMAX II反射 装置的安捷伦瓦里安680‐IR傅里叶变换红外(FTIR)光谱仪、珀金 埃尔默高分辨率Lambda 1050紫外‐可见‐近红外分光光度计以及马尔 文Nano S90动态光散射(DLS)。
2.1 | 负载阿莫西林的定量分析
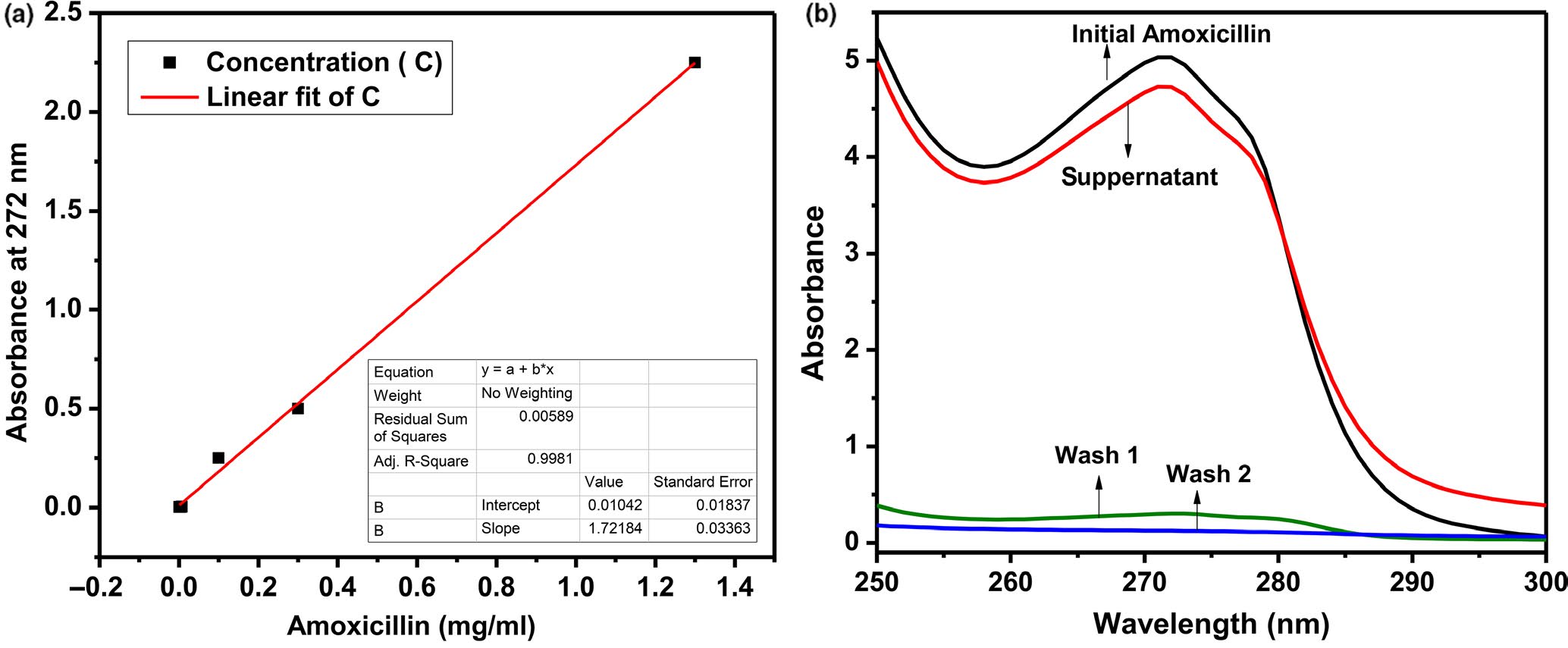
首先,通过阿莫西林的紫外‐可见光谱校准曲线来确定仪器限制及其对 一系列已知浓度的响应。配制了一系列浓度范围为0.0001至3.2 mg/ml的阿莫西林样品,并记录每个浓度下的紫外‐可见光谱响应。 该实验重复进行了三次,测量数据采用线性回归拟合。利用该线性拟 合预测无内毒素水溶剂中阿莫西林的未知浓度。
为了定量测定负载PEI的纳米金刚石(ND‐PEI)颗粒表面吸附的 阿莫西林量,通过紫外‐可见分光光度计(Lambda 1050 珀金埃尔默) 监测阿莫西林的吸收光谱,测定了阿莫西林的初始浓度(C0)、与纳 米金刚石颗粒混合后未吸附的阿莫西林浓度(Ceq)以及洗涤步骤中 过量阿莫西林的浓度(Cwash1、Cwash2)。每次实验中溶液中阿莫西林 的吸光度峰在272纳米处测定,并根据比尔定律将其与阿莫西林浓度 相关联:
$$
A = -\log \frac{I}{I_0} = \epsilon lc
$$
其中ε是材料的摩尔吸光系数,C为其浓度,l为光束路径长度。
2.2 | ND‐PEI‐阿莫西林的药物释放
在4°C储存温度、25和37°C室温(人体体温)下,研究了负载聚乙烯 亚胺和阿莫西林的纳米金刚石(ND‐PEI‐阿莫西林)颗粒中阿莫西林 的释放行为,考察了不同pH值条件:pH 4(柠檬酸缓冲液)、pH 7(PBS缓冲液)、pH 8(碳酸氢钠缓冲液)以及无内毒素水(pH 6.5)。将1毫克/毫升的载药颗粒与5毫升所需培养基混合,于1 4,385 g离心30分钟,然后使用紫外‐可见分光光度计在272纳米处测 定上清液的吸光度。样品在设定温度下孵育,并在1–190小时的不同 时间点取样,以研究药物释放情况。
2.3 | 纳米金刚石颗粒上PEI负载和PEI释放的定量分析
为了在阿莫西林存在的情况下检测聚乙烯亚胺,不能使用硫酸铜或硝 酸铜,因为它们与阿莫西林的峰存在重叠。我们开发了一种使用氧化 铜颗粒的技术。首先,为了生成聚乙烯亚胺的紫外‐可见光谱校准曲 线,制备了一系列浓度范围为0.01至0.001毫克/毫升的聚乙烯亚胺样 品,每个样品均与0.05毫克氧化铜颗粒混合。由于形成了当向聚乙烯亚胺(PEI)中加入铜离子(Cu²⁺)时,形成蓝色的铜氨 络合物(Cu(NH₃)₄²⁺),并在每个浓度下检测其紫外‐可见光谱。该 测量重复三次,随后对数据进行线性拟合,并利用所得校准函数预测 无内毒素水介质中PEI的未知浓度。为了研究阿莫西林与氧化铜( CuO)的相互作用,将0.05毫克的氧化铜加入到2.5毫克/毫升的阿莫 西林溶液中,然后研究样品的紫外‐可见光谱。
为了量化ND‐PEI表面吸附的PEI含量,通过紫外‐可见分光光度 计监测PEI‐CuO的吸收光谱,测定了PEI的初始浓度(C₀)、与纳米 金刚石颗粒混合后未吸附的PEI浓度(Cₑq)以及洗涤步骤中过量 PEI的浓度(Cwash₁、Cwash₂)。每次实验中,溶液中PEI‐CuO的吸光 度峰在630纳米处测定,并根据比尔定律将其与PEI浓度关联。为了研 究PEI从ND‐PEI或ND‐PEI‐阿莫西林中的释放情况,收集了各样品在 不同pH值下的上清液,加入到氧化铜溶液中,并用紫外‐可见分光光 度计进行分析。
3 | 结果与讨论
3.1 | 聚乙烯亚胺和阿莫西林负载的纳米金刚石颗粒(NDPs)的表征
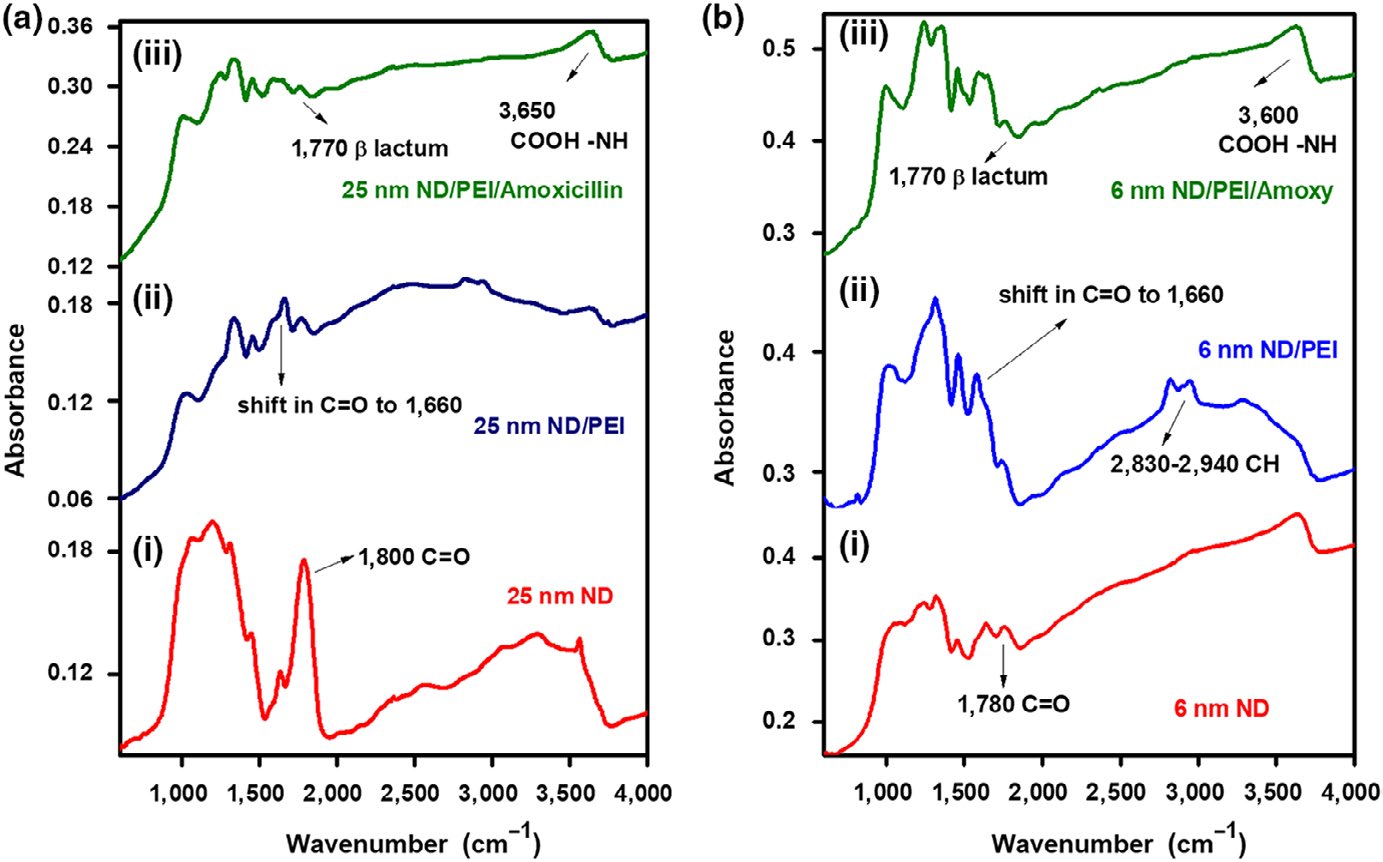
纳米金刚石颗粒经过纯化,并使用我们之前论文中描述的方法负载了 PEI和阿莫西林(Rouhani等人,2016年)。进一步研究的结果显示, 在表面具有强羧基的酸处理纯化的25纳米纳米金刚石颗粒上负载阿莫 西林的情况在1,800 cm⁻¹处(图1ai),以及具有羧基且强度较低的6纳米 NDPs(图1bi)。图1aii、bii显示了经酸处理并涂覆PEI的NDPs的 傅里叶变换红外光谱,其中NDPs的羧基(在1,800 cm⁻¹处)由于 PEI的氨基(在1,580 cm⁻¹处)与NDP表面的C=O之间形成氢键而移 至1,660 cm⁻¹处。负载阿莫西林的酸处理ND/PEI颗粒的傅里叶变换 红外光谱显示出阿莫西林β‐内酰胺峰位于1,770 cm⁻¹,以及在3,650 cm⁻¹处的尖锐特征峰,该峰归因于PEI的NH伸缩振动与阿莫西林的 羧酸基团之间的键合,证实了阿莫西林已成功负载于ND/PEI颗粒上 (图1aiii、biii)。

采用Zeta电位测量来检测NDPs在PEI涂层前后的表面电荷。表 1总结了涂层/负载不同阶段的Zeta电位和粒径测量结果。将ND‐PEI 分散在去离子水中以去除过量的PEI。通过离心收集颗粒,并去除含 有过量PEI的上清液。此步骤称为第一次洗涤和第二次洗涤。然后, 将收集的ND‐PEI重新分散在去离子水中,利用动态光散射进行表面 电荷和粒径的测量。
酸处理的25纳米NDPs分散在蒸馏水中时的Zeta电位为 −50 mV(pH 7)。在用PEI包覆NDPs后,与PEI混合的颗粒的Zeta电位 为+55 mV(pH 7),这表明NDPs表面已被PEI覆盖。经过两次洗 涤以去除过量的PEI后,收集到的颗粒的Zeta电位为+45 mV(pH 7)。NDPs的Zeta电位从−50 mV变为+45 mV,证实了PEI在 NDPs上的成功包覆。通过动态光散射(DLS)技术进行的流体动力 学粒径测量显示,分散在蒸馏水中的NDPs尺寸为57纳米,而 ND‐PEI颗粒的尺寸为160纳米。
| pH | Zeta电位 (mV) | 流体动力学 粒径(纳米) | |
|---|---|---|---|
| NDPs(25纳米) | 7 | −50 | 57 |
| 纳米金刚石颗粒和PEI | 7 | +55 | 210 |
| NDP‐PEI 后 第一次洗涤 | 7 | +50 | 170 |
| NDP‐PEI after 第二次洗涤 | 7 | +45 | 160 |
| NDP‐PEI dispersed 在去离子水中 | 7 | +45 | 160 |
表1 Zeta电位和纳米金刚石颗粒、ND‐PEI颗粒的流体动力学粒径
表2总结了负载阿莫西林后NDPs的流体动力学尺寸和泽塔电位的 研究结果。ND‐PEI纳米颗粒分散在蒸馏水中时的Zeta电位为+45 mV(pH 7)。在NDP‐PEI纳米颗粒负载阿莫西林后,混合物的 Zeta电位为+70 mV(pH 7),经过两次洗涤以去除过量的阿莫西林 后,收集到的颗粒的Zeta电位为+66 mV(pH 7)。ND‐PEI颗粒的 Zeta电位从+45 mV变为+66 mV,形成ND‐PEI‐阿莫西林。这一变 化表明阿莫西林分子已负载在ND‐PEI颗粒上并形成了正电荷位点。 收集到的ND‐PEI‐阿莫西林颗粒在去离子水中混合后的流体动力学尺 寸为180纳米。
对于6纳米纳米金刚石颗粒,裸颗粒的Zeta电位为+42 mV, ND‐PEI为+60 mV,ND‐PEI‐阿莫西林为+75 mV。由于裸颗粒和阿 莫西林包覆的6纳米颗粒发生团聚,其流体动力学尺寸不可靠,范围 在50至1,000纳米之间。
| pH | Zeta 电位 (mV) | 流体动力学 粒径(纳米) | |
|---|---|---|---|
| NDPs(25纳米) | 7 | −50 | 60 |
| ND‐PEI(清洗后 步骤) | 7 | +45 | 160 |
| 混合 ND‐PEI 和 阿莫西林 | 7 | +75 | 200 |
| ND‐PEI‐阿莫西林 第一次洗涤后 | 7 | +70 | 180 |
| ND‐PEI‐阿莫西林 第二次洗涤后 | 7 | +66 | 180 |
| ND‐PEI‐阿莫西林 混合在去离子水中 | 7 | +66 | 180 |
表2 Zeta电位和纳米金刚石颗粒、ND‐PEI及ND‐PEI‐阿莫西林的流体动力学粒径
3.2 | 纳米金刚石颗粒上负载阿莫西林的定量分析
图2a显示了无内毒素水中阿莫西林的校准曲线。根据对实验数据的线 性拟合,计算了初始纯阿莫西林溶液在无内毒素水中的吸光度强度以 及混合和洗涤后上清液的吸光度强度。所得的阿莫西林浓度分别记为 C₀, Cₛᵤₚ、Cw₁和Cw₂。图2b显示了初始纯阿莫西林溶液、ND‐PEI颗 粒与阿莫西林混合后的上清液以及经过两步洗涤后的上清液的紫外‐可 见光谱。表3总结了1毫克ND‐PEI上负载阿莫西林的典型定量结果。
系统定量分析负载的阿莫西林结果显示,1克ND‐PEI最多可吸附 114.50毫克阿莫西林。然而,这种负载导致形成了ND‐PEI‐阿莫西林 聚集体,其中部分未结合的阿莫西林分子被隐藏在聚集体结构的中心, 而其他阿莫西林分子则与ND‐PEI形成氢键。为释放过量,进行了两步洗涤以去除阿莫西林。第一次洗涤后,1克ND‐PEI上负载 了53.31毫克阿莫西林;第二次洗涤后,上清液中仅检测到5.18毫克 阿莫西林。初始阿莫西林浓度与Cₛᵤₚ、Cw₁和Cw₂之和的差值为 48.124毫克,表明成功结合到1克ND‐PEI表面的阿莫西林量为48.24 毫克。类似地,发现对于6纳米纳米金刚石颗粒,每1克ND‐PEI上负 载的阿莫西林量为19毫克。由于6纳米纳米金刚石颗粒具有正表面电 荷并发生团聚,其负载的PEI和阿莫西林量较25纳米样品更少。

| 初始阿莫西林 | 上清液 | 第一次洗涤 | 第二次洗涤 | |
|---|---|---|---|---|
| 浓度(毫克/毫升) | 2.50114 | 2.38692 | 0.06104 | 0.00504 |
| 2.50125 | 2.3868 | 0.06115 | 0.00521 | |
| 2.50346 | 2.38661 | 0.06137 | 0.00531 | |
| 平均浓度(毫克/毫升) | 2.50128 | 2.386778 | 0.061191 | 0.005187 |
| 标准偏差 | 0.000133 | 0.000129 | 0.000136 | 0.000111 |
表3 1毫克25纳米纳米金刚石‐聚乙烯亚胺负载阿莫西林的典型定量结果
3.3 | ND‐PEI‐阿莫西林颗粒的药物释放
在pH为4、7和8的介质中,于37°C(模拟人体温度)、25°C(室温) 和4°C(储存温度)条件下,研究了1毫克NDPs‐PEI‐阿莫西林颗粒在 200小时内的阿莫西林释放情况。首先,绘制了阿莫西林在柠檬酸缓 冲液(pH 4)、磷酸盐缓冲盐水(PBS,pH7)和碳酸氢盐缓冲液 (pH 8)中的校准曲线。随后,研究了温度和pH值对阿莫西林降解 的影响。最后,测量并分析了ND‐PEI‐阿莫西林在不同pH值和温度 下的阿莫西林释放情况。这些实验的结果将在以下章节中进行讨论。
3.3.1 | 温度对阿莫西林降解的影响
图3显示了阿莫西林溶解于无内毒素水中,在储存温度(4°C)、室温 (25°C)和体温(37°C)下保存7天后的紫外‐可见光谱,最终浓度为 2.5毫克/毫升。在4°C保存的样品的紫外‐可见光谱未显示任何变化。 在室温下保存的样品在5天后显示出350 cm⁻¹处的微弱特征峰,而在37°C下保存的样品在 2天后显示出350 cm⁻¹处的新特征。
350 cm⁻¹处峰的出现是由于阿莫西林降解所致。阿莫西林因温 度和pH值引起的降解机制将在以下章节中进行说明。

3 | 结果与讨论(续)
3.3.2 | pH值对阿莫西林降解的影响
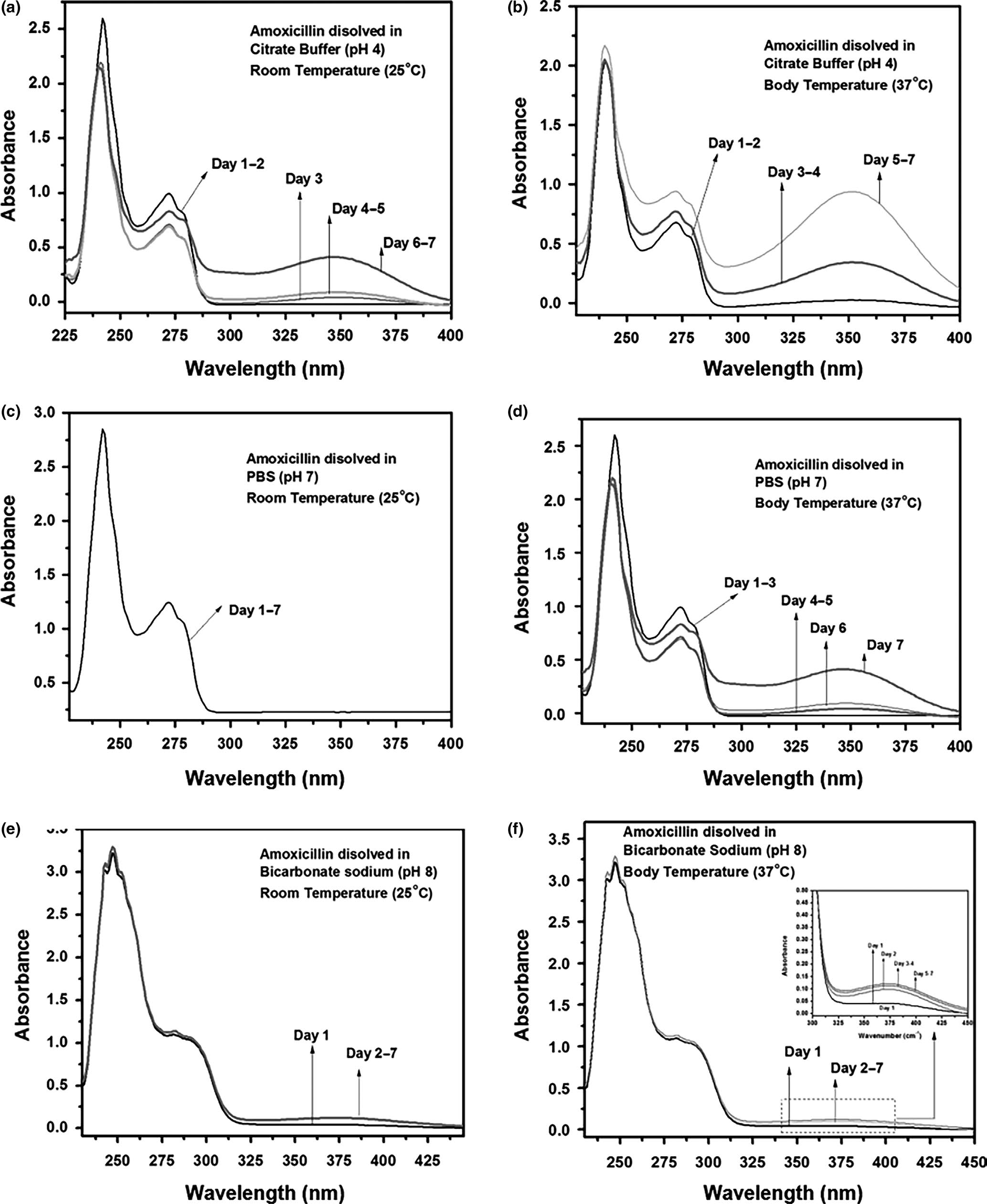
图4a、b显示了阿莫西林溶解在柠檬酸缓冲液(pH 4)中,在室温 25°C和体温37°C下放置7天后的吸光度谱。柠檬酸缓冲液的酸性环境 导致阿莫西林在室温和体温条件下放置2天后发生降解。在350 cm⁻¹ 处观察到明显的特征峰,并伴随溶液颜色变为黄色。图4c、d显示了 阿莫西林溶解在PBS(pH 7)中,在室温25°C和体温37°C下的紫外‐ 可见光谱。可以看出,阿莫西林在室温下放置7天仍保持稳定,但在 37°C下放置3天后显示出与降解相关的特征。
图4e、f显示了碳酸氢钠碱性介质(pH 8)对阿莫西林降解的影 响。在室温和体温条件下,1天后均出现了归属于阿莫西林降解的 350 cm⁻¹特征峰。图4f插图显示了该特征的增加。在350 cm⁻¹处出现的峰随时间增强,表明阿莫西林降解程度更高。
需要注意的是,用于阿莫西林校准的271 cm⁻¹处的峰强度在阿莫西林 降解后不稳定,因此不能用于计算阿莫西林浓度。

图5a–c显示了阿莫西林样品在37°C温度下,于无内毒素水、柠 檬酸盐缓冲液、磷酸盐缓冲液和碳酸氢钠缓冲液中溶解7天后的傅里 叶变换红外光谱。在pH 4和pH 7的样品中,1,778 cm⁻¹处与β‐内酰 胺相关的峰明显。然而,在酸性pH 4条件下溶解的样品中,相对于 1,450 cm⁻¹处酰胺II峰的β‐内酰胺峰相对强度低于pH 7条件下的样品。 在碱性缓冲液(pH 8)中溶解的样品则未见β‐内酰胺的特征峰。
阿莫西林结构中的β‐内酰胺峰容易受到四元β‐内酰胺环的酸碱催 化水解。在较低pH条件下,阿莫西林更稳定,因为在这些条件下, 阿莫西林的氨基处于质子化状态,氮原子上的孤对电子被占用。在较 高pH(pH 8及以上)时,氨基发生去质子化,氮原子上的一对孤对 电子可用于对β‐内酰胺环进行亲核攻击。这将生成由邦德加德( 1977)鉴定的三环化合物,如图5d所示。紫外‐可见分光光度计检测 到的阿莫西林主要吸光度峰与噻唑环(240 cm⁻¹)和苯酚(271 cm⁻¹)有关,而在350 cm⁻¹处观察到的峰则与三环化合物结构中新 形成的环有关。
根据齐亚、沙尔奇安和博尔赫(1977年)的研究,阿莫西林在35°C和 pH 5.77条件下保持最大稳定性的时间为55小时。
我们的阿莫西林降解研究表明,体温(37°C)和碱性pH(pH 8)会加快阿莫西林的降解速率。在温度37°C和pH 8的共同作用下, β‐内酰胺环在1天后完全消失。另一方面,在体温37°C条件下,酸性 pH(pH 4)或中性pH(pH 7)中的阿莫西林在2天后发生部分降解。 这些发现有助于更准确地设计药物释放实验并解释实验结果。
3.3.3 | pH值和温度对ND‐PEI‐阿莫西林中阿莫西林释放的影响
图6a显示了在室温下,溶剂pH值不同时ND‐PEI‐阿莫西林的阿莫西 林释放情况。最多55%的载药在酸性介质(pH 4)中释放。而在PBS(pH 7)中的药 物释放为25%,在无内毒素水(pH 6.5)中为14%,在较高pH如 pH 8时为8%。图6b显示了在体温37°C下的药物释放,其中在酸性介 质(pH 4)中释放了85%的载药。温度从25至37°C升高,使不同介 质中的药物释放几乎增加了两倍。
为了比较温度对不同pH值介质中药物释放的影响,对比了每种 介质中的药物释放曲线(图6c–f)。在pH 4条件下,37°C体温下1小 时的释放量相当于25°C室温下5小时的释放量。似乎随着温度升高, 溶液中离子的运动速率及其与载药颗粒表面的相互作用增强,导致更 多的阿莫西林释放。在较高pH值的样品中也可观察到温度对药物更 快释放的影响。需要注意的是,我们对略高于体温(40°C)与体温(37°C)相比未显示出显著差异。
6纳米纳米金刚石颗粒的药物释放在不同pH值和温度下表现出与 25纳米纳米金刚石颗粒相同的趋势。
在不同pH值的溶剂中对阿莫西林溶解度的研究表明,由于在 pH < 9时存在两性离子效应,羧酸(负pKa= 2.87)和氨基(正pKa= 7.28)的离子电荷相互抵消,导致该抗生素的溶解度降低(萨埃 斯马和托特曼,1990年)。因此,药物释放机制可通过考虑聚乙烯亚 胺在不同pH和温度条件下的作用来解释。支化PEI通过亚乙基连接伯 胺、仲胺或叔胺。由于每三个原子中就有一个是可质子化的氨基氮, 聚乙烯亚胺具有较高的阳离子电荷密度。主链上每隔两个原子即含有 一个氮原子,导致其pKa值范围较宽,并具有较高的缓冲能力。另一 方面,由于聚乙烯亚胺具有富乙烯骨架,因而是一种疏水性聚合物。
链间与链内相互作用之间的竞争导致疏水性聚电解质骨架的伸展。同 一条链中的氨基之间(链内)的电荷排斥有利于链的伸展,而两条 PEI支链上的氨基之间的电荷排斥(链间)则可能导致分子结构紧缩。 由于溶液条件(pH、盐和浓度;里德、戈什、梅贾迪和弗朗索瓦, 1991年)的变化,链间和链内排斥之间的平衡也会发生改变。例如, 高或低pH值的溶液会增加PEI上的电荷,而含盐溶液(如PBS)会屏 蔽静电相互作用,从而降低电荷排斥。在低离子强度溶液中,由于离 子浓度较低,聚合物片段间的吸引力疏水相互作用会被静电排斥所抵 消,导致形成伸展的聚合物构型。当溶剂中存在盐时,静电排斥被屏 蔽,使得聚合物表现得像中性聚合物。弱链内排斥和强链间排斥会导 致疏水性聚合物的坍塌(乌尔里希、拉格西尔和斯托尔,2005年)。
对于PEI而言,带电基团位于主链上,由两个亚乙基隔开,形成电荷 紧密排列。PEI中电荷紧密排列的影响如下:每个氨基的质子化都会 增加邻近胺基的电荷排斥和质子化自由能。这一效应已被广泛研究。 例如,对PEI链内排斥力的单链模拟显示,氨基的质子化是分步进行 的(齐巴思和王,2010年)。此外,聚乙烯亚胺滴定实验表明,氨基 质子化需要考虑两个和三个邻近影响。


根据前述讨论,药物在酸性pH下的释放机制可基于pH值和盐对 PEI构型的影响来解释。当将ND‐PEI‐阿莫西林颗粒加入柠檬酸缓冲 液(pH 4)时,PEI上的大部分酰胺基团被质子化,反应如下所述。
在pH 4条件下,聚乙烯亚胺质子化导致聚合物链带上正电荷,从 而增加了链内电荷排斥。如图7所示,链内电荷排斥的增加导致主链延伸,从而形成开链构型。物理吸附的阿莫西林分子在介质 中释放,而化学结合的阿莫西林分子(氢键结合的)则被质子取代后 在介质中释放。当将ND‐PEI‐阿莫西林加入含有多种盐的PBS(pH 7)时,盐的正负离子在PEI的氨基之间起到屏蔽电荷的作用,从而降 低链内电荷排斥,形成中性原子闭合链。对于将ND‐PEI‐阿莫西林加 入碳酸氢钠缓冲液(pH 8)的情况,pH值和盐离子(此处为Na⁺) 浓度均增加。结果,链内排斥作用降低,PEI形成包含中性原子的闭 合链。在PEI闭合链中的物理吸附的阿莫西林分子被束缚,无法暴露 于介质中而难以释放。为了验证这一理论,测定了ND‐PEI‐阿莫西林 在不同pH值下的流体动力学粒径。结果表明,NDPs负载PEI和阿莫 西林在无内毒素水(pH 6.5)中粒径为180纳米,而在柠檬酸缓冲液 (pH 4)中粒径变为644纳米,在PBS缓冲液(pH 7)中为164纳米, 在碳酸氢钠(pH 8)中为94纳米。这些结果证实了PEI在酸性介质中 发生膨胀,导致药物释放增加;而在PBS或碱性pH条件下PEI发生坍 塌或形成闭合链,导致药物释放减少。
3.4 | 纳米金刚石颗粒上聚乙烯亚胺负载及PEI释放的定量分析
由于聚乙烯亚胺(PEI)在紫外‐可见光谱范围内没有特征吸收,其分光光度定量基于铜离子(Cu²⁺)形成蓝色铜氨络合物(Cu(NH₃)₄²⁺) 的反应加入PEI中。铜氨离子在270和630纳米处有两个吸收峰。图8显示了 氧化铜分别加入PEI和阿莫西林后的紫外‐可见光谱。
如图所示,PEI/CuO 在 270 纳米和 630 纳米处显示出两个峰, 这是由于形成了铜氨离子;而阿莫西林/CuO 也显示出两个峰,一个 在 270 纳米处,为阿莫西林的特征峰,另一个在 ~300纳米处的新峰, 是由于阿莫西林结构中存在铜离子所致。
由于铜氨吸收在270纳米处接近阿莫西林的吸收峰(272纳米), 我们选择基于630纳米处的峰对PEI浓度进行校准。图9显示了 PEI/CuO的紫外‐可见光谱和校准曲线。如图所示,随着PEI浓度的降 低,630纳米处峰的强度也随之减弱(图9a,b)。
图9c显示了无内毒素水中聚乙烯亚胺的校准曲线。利用实验校准 数据的线性拟合来计算初始聚乙烯亚胺和混合并洗涤后上清液的吸光 度强度。计算得到的聚乙烯亚胺浓度分别称为C₀, Cₛᵤₚ、Cw₁和Cw₂。

负载聚乙烯亚胺的系统定量结果表明,1克纳米金刚石最多吸附 1.64毫克聚乙烯亚胺。为了去除过量的聚乙烯亚胺,进行了两步洗涤。 第一次洗涤后,去除了0.042毫克聚乙烯亚胺;第二次洗涤后,上清 液中未检测到聚乙烯亚胺。初始聚乙烯亚胺浓度与Cₛᵤₚ、Cw₁和Cw₂ 之和的差值为1.60毫克,这表明成功结合到1克纳米金刚石表面的聚 乙烯亚胺量为1.60毫克。对于6纳米纳米金刚石颗粒,1克纳米金刚石 上的负载聚乙烯亚胺量为0.33毫克。由于6纳米纳米金刚石颗粒具有 正表面电荷且存在颗粒团聚现象,其负载的聚乙烯亚胺量较25纳米纳 米金刚石少。
为了研究ND‐PEI在不同pH值下的PEI释放情况,我们首先分别 研究了CuO在柠檬酸缓冲液(pH 4)、PBS(pH 7)和碳酸氢钠 (pH 8)中的紫外‐可见光谱。我们注意到,CuO混合在PBS(pH 7)和碳酸氢钠(pH 8)中时,在紫外‐可见光谱以及无内毒素水中均 未显示出任何特征峰。然而,将CuO加入柠檬酸缓冲液(pH 4)后, 在780纳米处出现一个峰,这是由于在酸性溶液中形成了Cu²⁺ ‐柠檬 酸二聚体复合物所致(图10a)。
在另一个实验中,将PEI/CuO分别加入PBS(pH 7)、碳酸氢钠 (pH 8)和柠檬酸盐(pH 4)缓冲液中。紫外‐可见光谱显示,在 pH 7和pH 8时,由于形成铜氨离子,在630纳米处出现一个峰;在 pH 4时,由于存在铜氨离子和Cu²⁺ ‐柠檬酸盐二聚体复合物,在730 纳米处形成一个宽峰。(图10b)。
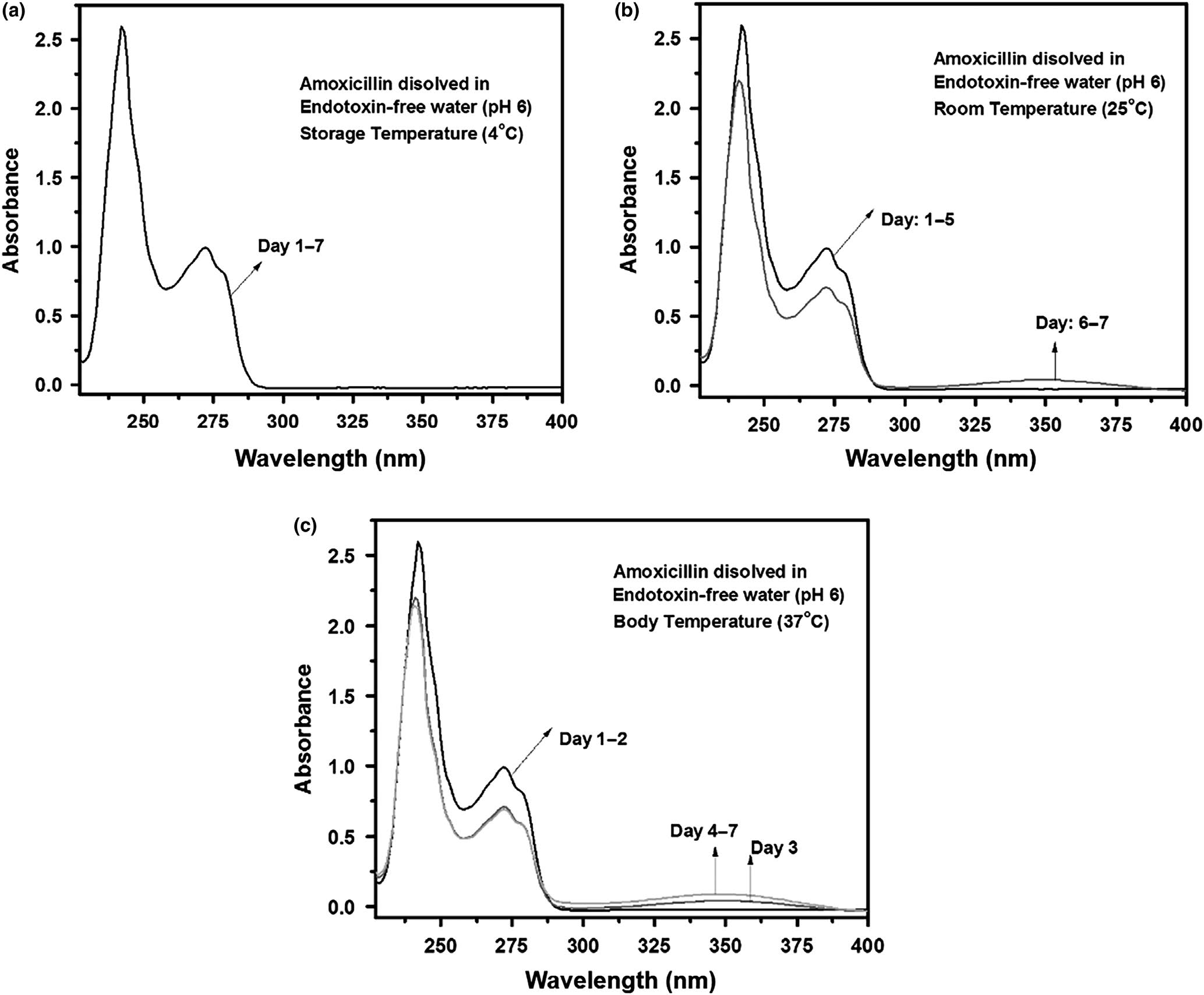
图11显示了ND‐PEI上清液的紫外‐可见光谱。注意,已将 ND‐PEI颗粒添加到不同类型的缓冲液中。从25纳米可以看出,在 pH 4条件下将ND‐PEI加入缓冲液中时,7和8在630纳米处没有出现代表上清液中存在PEI的峰。唯一的峰位 于780纳米,这是由于柠檬酸盐缓冲液(pH 4)与Cu离子相互作用所致(图11a)。然而,6纳米ND‐PEI在所有缓冲液中的结果显示有 PEI释放到上清液中的痕迹。

6纳米和25纳米纳米金刚石颗粒上负载的PEI量及其释放的差异, 可以通过注意到6纳米和25纳米纳米金刚石颗粒表面之间的差异来解 释。25纳米纳米金刚石颗粒具有负表面电荷和表面羧基。这导致在25纳米纳米金刚石颗粒和聚乙烯亚胺之间形成共价键。由于 25纳米纳米金刚石颗粒与聚乙烯亚胺之间的强结合,上清液中未检测 到PEI释放;而6纳米纳米金刚石颗粒表面带有正表面电荷,并同时具 有氨基和羧基,导致聚乙烯亚胺负载量较低,且通过弱氢键结合,从 而引起聚乙烯亚胺释放到上清液中。
将ND‐PEI‐阿莫西林加入不同类型的缓冲液中,取上清液进行分 析。图12a显示了25纳米ND‐PEI‐阿莫西林上清液的紫外‐可见光谱, 这些上清液在各种缓冲液中混合后添加到氧化铜中。320 nm处的特 征峰与阿莫西林和氧化铜的相互作用有关,780 nm处的特征峰则是 由于在酸性pH条件下形成了Cu²⁺ ‐柠檬酸二聚体复合物。可以看出, 在730 nm或630 nm处没有出现特征峰,因此25纳米ND‐PEI‐阿莫西 林在不同pH值下均无PEI释放。图12b显示了6纳米ND‐PEI‐阿莫西林 的结果,其中在630 nm和730 nm处的紫外‐可见光谱特征表明在所 有pH值下均有PEI释放。对于6纳米ND‐PEI‐阿莫西林,由于释放的 阿莫西林强度较高,320 nm处的峰超出了量程,但可以看到峰肩。
总体而言,可以得出结论:PEI会从6纳米ND‐PEI和ND‐PEI‐阿莫西 林中在各种pH条件下释放,而25纳米ND‐PEI或ND‐PEI‐阿莫西林在 不同pH值下则无PEI释放。
4 | 结论
一项关于将PEI和阿莫西林负载于纳米金刚石颗粒(NDPs)作为药 物递送载体的研究被开展。NDPs在负载PEI和阿莫西林前后的表面 电荷变化证实了两者的成功负载。计算得出,在1毫克25纳米纳米金 刚石颗粒上负载的阿莫西林量为48.24毫克,在1毫克6纳米纳米金刚 石颗粒上的负载量为19毫克。阿莫西林释放实验结果显示,在体温和 酸性pH条件下释放量最高,24小时内几乎释放了85%的载药。在酸 性pH下的药物释放归因于PEI的存在。在酸性pH下的药物释放的优点 在于,当ND‐PEI‐阿莫西林被细胞内化并经过具有酸性pH的溶酶体 时,药物可在细胞内释放。
首次开发了一种在阿莫西林存在下检测负载和释放PEI量的新方 法。该方法基于向聚乙烯亚胺溶液中加入铜离子后形成铜氨络合物的 原理。研究发现,成功键合到1克6和25纳米纳米金刚石颗粒表面的 PEI量分别为0.33毫克和1.60毫克。还发现,在酸性pH条件下,25纳 米纳米金刚石颗粒未释放PEI,而6纳米纳米金刚石颗粒则有微量 PEI释放。6和25纳米纳米金刚石颗粒之间PEI负载量的差异可通过两 者表面差异来解释。25纳米纳米金刚石颗粒表面带有负表面电荷和羧 基,导致其与PEI之间形成共价键。由于25纳米纳米金刚石颗粒与 PEI之间的强结合,PEI未被释放,因此在上清液中未检测到。而6纳 米纳米金刚石颗粒具有正表面电荷,其表面同时存在氨基和羧基,导致聚乙烯亚胺负载量较低,且氢键较弱, 从而引起聚乙烯亚胺释放到上清液中。总体而言,可以得出结论:6 nm ND‐PEI和ND‐PEI‐阿莫西林在不同pH值下均会发生PEI释放, 而25纳米ND‐PEI或ND‐PEI‐阿莫西林在各种pH值下均无PEI释放。
这些研究表明,纯化后的以及聚乙烯亚胺功能化的25纳米纳米金刚石 颗粒是一种有前景的抗生素阿莫西林载体,因为它能够与药物结合, 将其携带至酸性pH值的介质中并实现释放。




















 6719
6719

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








