医疗器械:冠状动脉支架
Vanessa Montan˜o‐Machado,玛尔戈扎塔·希科拉‐亚辛斯卡,卡罗琳娜·卡塔尼奥·博尔托兰,帕斯卡尔·舍瓦利埃和迭戈·曼托瓦尼,拉瓦尔大学,魁北克,魁北克省,加拿大
© 2019 爱思唯尔公司。保留所有权利。
历史
心血管疾病(CVD)是与血管尤其是冠状动脉相关的疾病,是全球发病率和死亡率的首要原因。根据世界卫生组织(WHO)的数据,2012年有1750万人死于心血管疾病(CVD),预计到2030年这一数字将上升至2360万。大多数心血管疾病为动脉粥样硬化,与冠状动脉中动脉粥样硬化病变的发展有关。简而言之,长期的高血压、吸烟或高胆固醇引起的初始内皮损伤最终会导致斑块形成,进而引起受损动脉管腔的进行性阻塞,从而扰乱血流直至完全堵塞。这可能导致中风或心脏病发作。在疾病进展阶段,经过初期的药物治疗后,目前通常采用血管成形术和支架植入进行治疗。
但是,什么是血管成形术和支架植入?为什么要使用支架,支架到底是什么?为什么叫支架?
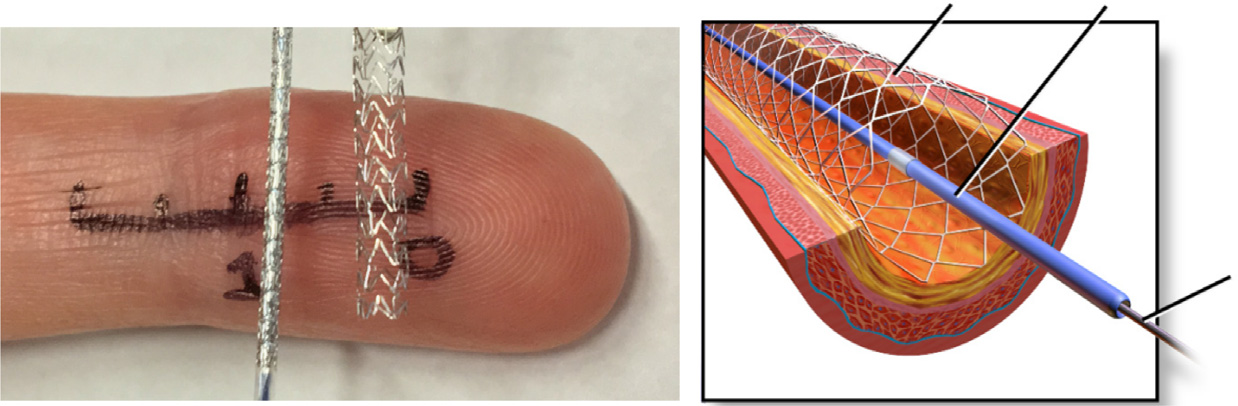
血管成形术是一种经皮血管内手术,通过球囊导管扩张狭窄的动脉,在受损区域扩张球囊,将狭窄斑块推至动脉管壁,从而恢复血流。然而,如果冠状动脉严重受损,则需要植入支架以维持动脉的机械性能。该装置安装在带有球囊的导管上,然后引导至受损的冠状动脉。球囊在此处膨胀,支架随之扩张并释放,狭窄斑块被压缩,血流得以重新建立。支架将永久留置体内。支架是微小的金属网状可扩张管,长度范围为8至38 mm,直径为2–4 mm,用于支撑受损动脉,以恢复血流(图1)。
“支架”一词的起源颇具争议。通常人们认为该词源自一位英国牙医查尔斯·托马斯·斯坦特(Charles Thomas Stent,1807–1885),他曾开发出一种牙科印模树脂,后于1916年被埃瑟(Esser)用于面部重建手术,并称之为“stent’s compound”,随后该词便与支撑物相关联。另一些人则认为,“stent”一词来源于动词形式“stenting”,该词数个世纪以来被用来描述使衣物变硬的过程;还有人将“stent”与一个源自中古英语动词“stenten”的名词联系起来,该词是“extenten”的缩写,意为“拉伸”,而后者又源于拉丁语“extentus”,即“extendere”(意为“伸展”)的过去分词。
自1997年以来,使用支架的血管成形术已成为全球最常见的医疗干预手段,每年进行超过一百万例血管成形术。事实上,从20世纪60年代开始经过多次发展,到1986年首次在人体中进行支架植入,并经历大量试验后,第一款支架直到1994年才获得美国食品药品监督管理局(FDA)批准。这些裸金属支架(BMS)的应用使冠状动脉手术后再狭窄的发生率从30%至40%显著降低。1999年,药物洗脱支架(DES)被引入临床,该支架采用抗增殖剂涂层,旨在最大程度减少再狭窄及再次干预的需求。
四年后,即2003年,第一款药物洗脱支架(DES)获得FDA批准,随后更多产品相继获批。尽管临床效果良好,但长期支架内血栓形成的风险仍然存在。因此,新一代被称为生物可吸收支架的支架应运而生,其材料为可生物降解聚合物(2000年)或可吸收金属(2008年)。部分生物可吸收支架于2012年获准进入欧洲市场,而FDA则于2016年批准了首款此类产品。
纵观历史,最初的支架通常由不锈钢制成,主要因其具有良好的机械和生物特性。此后,其他合金也相继被开发出来,例如钴‐铬、镍‐钛(镍钛诺)合金,以及最近的铂‐铬合金。此外,支架设计在支撑杆结构、厚度、柔韧性和曲率方面也随时间发生了变化。关于药物洗脱支架,其涂层成分和所用药物也在不断演进。新一代可生物降解支架正在研发中,涉及合金成分、可生物降解聚合物、支架设计以及制造工艺等多个方面。这些主题将在接下来的章节中进行讨论。
表面改性
心血管支架中的涂层一直是人们关注的焦点,旨在改善医疗器械与宿主之间的相互作用。事实上,保护金属免于与生物液体接触对于防止腐蚀及其他问题至关重要。
 。https://doi.org/ 10.15347/wjm/2014.010)
。https://doi.org/ 10.15347/wjm/2014.010)
导致医疗器械长期机械性能下降的问题。此外,血液流体引起的腐蚀具有释放金属化合物(如铬和镍)的高风险,这些元素被国际癌症研究机构归类为致癌物。就医疗器械的生物学反应而言,支架植入后希望内皮细胞增殖,以修复内皮,同时形成天然的抗血栓表面,从而避免血栓形成。此外,还希望避免平滑肌细胞的增殖,因为这可能导致支架内再狭窄。表1列出了目前市场上用于冠状动脉支架的一些涂层。
不幸的是,表2中显示的涂层均未能完全避免再狭窄和其他不良反应。这是目前仍在继续研究新涂层的主要原因。
表1 支架置入术的发展历史及支架的演变
| Date | 相关人物 | 事件 |
|---|---|---|
| 1958 | 索尼斯 | 用于心脏选择性成像的诊断性冠状动脉造影 |
| 1964 | 多特和朱德金斯 | 建议在动脉(腿部)内使用假体装置以在扩张后维持血流,此概念源于血管成形术 |
| 1967 | 朱德金斯 | 引入使用导管的冠状动脉造影术 |
| 1974 | 格林齐格 | 进行了首例外周人体球囊血管成形术 |
| 1977 | Gruentzig Miller | 首例在清醒患者中进行的冠状动脉成形术,通过外周动脉插入导管,并扩张球囊以扩张狭窄的动脉节段 |
| 1986 | Sigwart | 首次在临床实践中使用的(自膨胀式)“支架”,最初称为“Wallstents”(发明者为 H. 瓦尔斯坦) |
| 1986 | 帕尔马兹/沙茨 | 创建了一种名为“帕尔马兹‐沙茨”的球囊可扩张支架 |
| 1986 | 普埃尔/西格瓦特 | 首个植入患者体内的冠状动脉支架(法国) |
| 1987 | 帕尔马兹/沙茨 | 在德国将他们的“帕尔马‐沙茨”支架植入一名患者体内 |
| 1987 | 金图尔科‐鲁宾 | 柔性金属螺旋支架/首个获得美国食品药品监督管理局批准的支架旨在 |
| 1994 | FDA | 金图尔科‐鲁宾和帕尔马兹‐沙茨™支架的批准 |
| 1997 | 全球 | 已实施超过一百万例使用裸金属支架的血管成形术 |
| 1999 | 苏扎 | 首例西罗莫司洗脱支架(西罗莫司支架)的植入 |
| 2000 | 伊垣 | 首个在人体中测试的可吸收支架是在日本开发的,由聚‐L‐乳酸制成 |
| 2002 | 欧洲市场 | 用于临床的西罗莫司洗脱西罗莫司支架和泰菲支架 |
| 2003 | FDA | 首个药物洗脱支架的批准:西罗莫司支架,一年后是泰菲支架 |
| 2005 | — | 药物洗脱支架植入术占血管成形术的近90% |
| 2007 | Biotronik | 镁可吸收支架及临床结果 |
| 2008 | Biosensors | 带可生物降解聚合物的药物洗脱支架:BioMatrixTM支架 |
| 2012 | 欧洲市场 | 首个可生物降解支架于九月推出,第二个于2013年5月推出 |
| 2016 | FDA | 首个完全可生物降解血管支架的批准 |
表2 市场上可用的支架涂层
| 涂层 | 评论 |
|---|---|
| 钽 | 已通过物理气相沉积溅射在316L不锈钢基板上进行涂层。涂层在塑性变形 |
| Gold | 具有射线不透性以增强荧光透视可见性。已观察到血小板活化和新生内膜形成。无体内未报告再狭窄率的改善 |
| PTFE | 在大隐静脉移植治疗中降低了远端栓塞的概率。大多数支架内再狭窄发生在支架移植物的边缘。涂层支架与裸金属支架在六个月随访时具有相似的再狭窄率 |
| PLGA, PLLA, PDLLA | 也用作生物可吸收支架的支架材料。用作西罗莫司和紫杉醇的药物载体 |
| PRC | 涂有交联磷酸胆碱。可减少血小板黏附。涂层稳定性存在问题。体内。缺乏内皮化 |
| 肝素 | 减少支架内血栓、白细胞和血小板黏附,降低凝血预防平滑肌细胞移位和增殖。体内研究尚未证明对支架内血栓有影响再狭窄 |
| 西罗莫司(药物洗脱支架) | 西罗莫司是一种具有强大抗增殖和免疫抑制特性的抗生素。有多种支架市场上售的涂有该药物的支架 |
| 紫杉醇(药物洗脱支架) | 它是一种目前用于治疗卵巢癌的抗肿瘤药。使用减容装置机械性地减少斑块体积。它可能导致支架植入血管的内皮愈合延迟和内皮功能障碍 |
| 佐他莫司洗脱支架(ZES) | 据报道可促进内皮快速且均匀的愈合,但关于其植入后对内皮功能的影响知之甚少支架植入后内皮功能的损伤 |
| 生物可吸收依维莫司洗脱支架 | 生物可吸收聚合物的基础显示出在相邻区域对内皮依赖性血管运动反应有更好的保护支架节段与西罗莫司洗脱支架的比较 |
涂层分类
根据用途,涂层可分为两大类:被动型和生物活性型。这两类将在后续章节中进一步说明。
被动涂层
被动涂层旨在为裸露金属提供新的性能和/或避免生物材料与生物环境之间的任何相互作用。通常,其目的是防止蛋白质和细胞在生物材料表面黏附。用于制备此类涂层的材料通常具有抗污性能,例如聚四氟乙烯(PTFE)、聚乙二醇(PEG)、壳聚糖和葡聚糖。这些材料还可赋予材料新的性能,以方便植入过程中的操作,例如金涂层可提供射线不透性。已开发出多种无机涂层应用于支架表面,以减少金属离子释放,包括类金刚石碳、氧化铱、氮氧化钛和碳化硅。然而,临床试验并未显示这些涂层在降低再狭窄率方面具有进一步的优势。
生物活性涂层
生物活性涂层旨在通过支架与机体相互作用来调节或控制特定的生物学反应。例如,它们可能旨在避免血栓形成,防止平滑肌细胞的增殖和/或促进内皮细胞的移位与增殖。当前对生物活性涂层的研究包括探索已知在内皮细胞增殖中起作用或具有抗血栓形成特性的生物分子,如蛋白质、多糖和磷脂。
药物递送
正如在表2中所观察到的,大多数已商业化的涂层支架均载有药物,且通常其目的是防止平滑肌细胞增殖和/或血栓形成,如同生物活性涂层的情况一样。植入裸金属支架可能导致需要再次干预以植入多个支架;事实上,这种情况发生在超过15%的患者中,而药物洗脱支架的植入则低于5%。目前最常用的释放技术是使用载药聚合物基质。一些用于载药的聚合物包括聚左旋乳酸和聚右旋乳酸。药物洗脱支架的一个主要优点是能够实现局部药物释放,而不是像口服途径或注射那样将少量药物引入目标区域。然而,尽管药物洗脱支架旨在预防再狭窄,仍有报道称裸金属支架可能具有更低的再狭窄率;这一现象可归因于药物洗脱支架中的药物缺乏特异性,其虽旨在抑制平滑肌细胞增殖,但同时也抑制了内皮细胞的增殖。
DES可分为部分可吸收支架和完全可吸收支架。这主要取决于支架材料。实际上,市场上已经可以找到多种由完全可吸收材料(如镁和聚左旋乳酸)制成的支架。
涂层沉积
在过去的几十年中,已经开发出不同的技术来涂覆生物材料,这些技术已从简单的吸附发展为复杂的多步骤工艺。表3总结了研究中用于改支架表面的一些技术。
表3 支架应用的涂层技术
| 方法 | 描述 |
|---|---|
| 吸附 | 一种常用于蛋白质的简单方法。通常在 37 °C下进行。关于温度影响的研究已经开展。即使已经表明蛋白质会强烈吸附到多种基底上,其稳定性涂层在体内可能会受损 |
| 浸涂 | 简单快速的方法。常用于带电荷的聚合物,适用于层层自组装技术。支架在体内流动和支架变形过程后,涂层的稳定性可能会受到影响。 |
| 旋涂 | 简单的方法,成本低,速度快。适用于聚合物。可观察到涂层均匀性不足。稳定性涂层在体内流动和支架变形时可能会受损 |
| 喷涂涂层 | 将溶液喷洒在表面。可由此获得聚合物薄膜。可能会观察到低附着力现象支架植入和变形 |
| 等离子体处理 | 长期应用,表面特性控制。无溶剂。高粘附性和内聚涂层。时间耗时、昂贵的多步骤过程 |
| 基质辅助脉冲激光蒸发 | 已用于沉积聚合物以及有机化合物的薄而均匀层,例如碳水化合物以及近期的蛋白质。激光靶材由包含聚合物溶液的冷冻基质组成化合物溶解在相对挥发性溶剂中 |
| 嫁接 | 分子的嫁接过程可以通过多种涂层技术组合来实现。表面功能化通常通过典型的化学过程或等离子体处理来完成。表面功能化后,可采用浸涂或旋涂方法进行涂覆,形成共价键 |
支架设计与制造
金属生物材料的机械性能定义是植入物设计中的重要步骤。支架的设计需要平衡相互对立的机械要求。实际上,支架的机械性能对于确保其成功输送和长期稳定性至关重要。所需具备的特性之间存在矛盾:高弹性模量(防止回缩)、低屈服强度(便于支架扩张)、扩张后的高抗拉强度(实现高径向强度并允许使用更细的支撑杆)以及高延展性(能够承受扩张过程中的塑性变形)。上述性能难以在单一材料中同时实现。球囊可扩张支架应能经历塑性变形,并在输送后保持所需的尺寸。而自膨式支架则应具备足够的弹性,以便压握输送,并在目标区域顺利展开。迄今为止,已有多种材料被研究用于支架应用,其中部分材料已实现商业化。
支架材料
球囊扩张支架最常用的材料是316L不锈钢(SS316L)和钴铬合金。在这两种情况下,稳定的Cr2O3钝化膜的形成提高了表面的耐腐蚀性。多年来,已证实更细的支撑杆可降低支架内再狭窄的发生率。现代更强、更刚硬的材料(包括铂铬、钴镍和钴铬合金)以及制造工艺的进步使得支撑杆尺寸得以减小。钴铬合金比SS316L具有更高的强度和更好的射线不透性,同时具备良好的耐腐蚀性、抗疲劳性,且为非磁性(见表4)。钴铬合金自1937年以来已被用于医用植入物。首款采用Co‐20Cr‐35Ni‐10Mo合金的支架于2003年开发。该合金最初被设计为一种耐热材料,名为Elgiloy。其支撑杆厚度减小至80‐90毫米,而早期的 SS316L支架为130‐140毫米。由于对更高强度、刚性和射线不透性材料的强烈需求,专门针对冠状动脉支架设计的新合金应运而生。波士顿科学推出了铂铬钢(Fe‐(32.5‐33.5 wt%)Pt‐(17.5‐18.5 wt%)Cr‐(2.43‐2.83 wt%)Ni),其中添加铂以增强射线不透性,并在延展性和强度之间提供合理的平衡。该合金被用于制造梁厚度为81毫米、宽度为91毫米的支架。另一种用于制造支架并在动物模型中成功植入的铂合金由90%铂和10%铱组成。与SS316L相比,向铂中添加铱显著增强了射线不透性。此外,这些合金表现出优异的耐腐蚀性,但其较差的机械性能仍令人担忧,因此对铂铱合金支架的研究仍然有限。
钽(Ta)已被用于制造由127 mm厚丝材组成的线圈式冠状动脉支架。由于钽具有较大的质量密度(ρ = 16.6 g/cm³),其射线不透性高,从而在X射线下输送和释放支架时具有更好的X射线可见性。尽管钽的生物相容性和可视性优于 SS316L,但由于其强度不足,该材料并未在支架制造中广泛使用。事实上,与其他列于表4中的支架制造材料相比,钽的屈服强度接近其抗拉强度,因此在扩张过程中支架更易发生断裂。此外,这些支架释放时所需的压力较低,可能导致回缩。
最终,钽的难加工特性可能从合金开发到支架电抛光带来显著的制造挑战。自膨式支架在室温下直径较小,在体温下可自行扩张至与血管直径相当的尺寸。这种自扩张能力源于形状记忆合金固有的超弹性。镍钛诺(TiNi合金,其中两种元素的原子百分比大致相等)是唯一用于自膨式支架的材料,因其具有优异的超弹性、生物相容性和足够的耐腐蚀性。建议将自膨式支架用于神经血管和颈动脉。由于球囊扩张式植入物扩张时需要高压,可能会损伤脑血管的薄管壁,因此不推荐用于此类血管。
心血管支架的制造方法
支架可由板材、丝材(圆形或扁形)或管材制成。支架制造方法包括丝材编织/针织和激光切割板材/管材。如今,支架主要通过激光切割不同直径和管壁的金属管材来制造。
表4 不同支架材料的机械性能
| 材料 | 杨氏模量(吉帕) | 屈服强度(兆帕) | 抗拉强度(兆帕) | 延伸率% | 射线不透性 |
|---|---|---|---|---|---|
| SS316L(ASTM F 138 退火态) | 190 | 250 | 580 | 55 | 正常 |
| 钽(退火) | 185 | 138 | 207 | 60 | 非常好 |
| 铂铬钢 | 191 | 460 | 824 | 43 | 非常好 |
| 铂‐10%铱 | 150 | 200 | 340 | 25 | 非常好 |
| 镍钛诺(退火) | 83 | 195–690 | 895 | 10 | Good |
| 钴铬(ASTM F 90) | 210 | 379 | 896 | 30 | Good |
| L605(钴铬) | 243 | 629 | 1147 | 46 | Good |
厚度和长度。由金属板制成的支架在形成图案后应卷成管状结构,其制造方法的选择主要取决于所选原材料的形态。金属丝可通过传统金属丝成形技术以不同方式制成支架,例如针织、编织和卷绕(图2)。金属丝支架最简单的形状是线圈。目前市场上所有线圈支架均为球囊扩张型。金属网支架已被证明具有较高的血栓形成和再狭窄倾向,因此不再用于冠状动脉介入治疗。
心血管支架的制造方法
大多数商用冠状动脉支架是通过激光切割(LC)微型管材制成的。激光切割(LC)是一项关键技术,能够实现支架在微米级公差下的制造。球囊扩张支架在压握或接近压握状态下进行切割,而自膨胀镍钛合金支架可以在压握状态(需要切割后扩张和定型)下切割,也可以从直径与成品支架尺寸相当的管材上直接切割。无论哪种情况,支架都需要进行切割后去毛刺以及电化学抛光等表面处理。美国食品药品监督管理局(FDA)首次批准用于临床实践的激光切割支架于1994年在美国问世。
脉冲掺钕钇铝石榴石(Nd:YAG)激光器是目前商用支架制造中最常用的激光设备。它们可配置为基模和固定频率,或多种不同的激光频率,以产生具有期望特性的光束,从而实现更快更清洁的切割。传统的Nd:YAG激光器脉冲持续时间约为0.1–20毫秒,存在若干局限性。尽管其具有高精度和高速度,但此类脉冲通过热加工过程去除材料,并在一定程度上导致管材的蒸发。此外,较长的脉冲时间会在切割区域附近形成相对较大的熔化区和热影响区(HAZ)。这会导致切割边缘出现明显的毛刺形成,并在管材表面附着凝固液滴。热影响区(HAZ)可能导致支架材料脆化,从而降低其机械性能。因此,在后续工艺中彻底去除热影响区(HAZ)显得尤为重要。
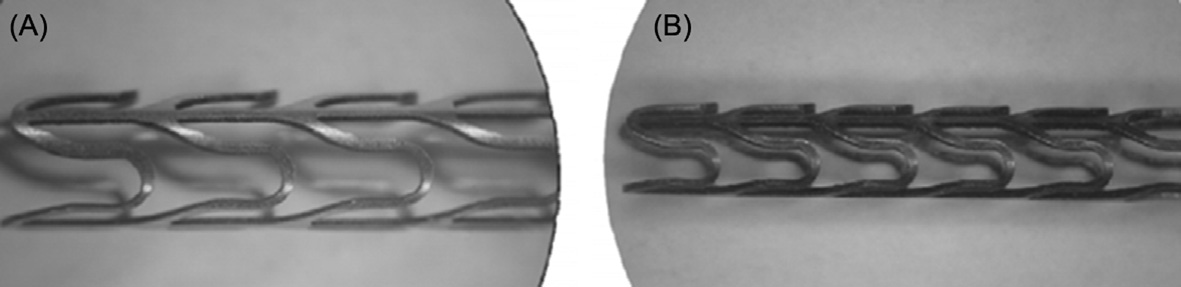
脉冲Nd:YAG激光器已被光纤激光器所取代,后者具有更好的光束质量,且光束质量不受脉冲能量和平均功率的影响。这些激光器可产生低至几十微秒的脉冲持续时间,适用于精细特征切割。由于能够自由调节脉冲频率和脉冲持续时间,这些激光器在切割可控性方面表现出显著提升。此外,从操作角度而言,光纤激光器具有一系列优势。实际上,它们采用风冷方式,效率更高,并采用具有长使用寿命的二极管,从而实现最低运行成本。图3显示了一个心血管支架分别使用光纤激光器(A)和 Nd:YAG激光器(B)进行切割的示例。可以看出,由于光纤激光器具有优异的光束质量和更小的切缝宽度,更适合微加工,因此其切割更为精确。
 , 137–147. https://doi.org/10.1080/136457002760273340)
, 137–147. https://doi.org/10.1080/136457002760273340)
 ,300–302。https://doi.org/10.1016/j.optlastec.2008.06.001)
,300–302。https://doi.org/10.1016/j.optlastec.2008.06.001)
光化学加工
光化学加工(PCM)是一种灵活且快速的技术,能够以较低成本实现复杂形状的微细加工,而这是其他技术难以达到的。在此过程中,材料通过蚀刻剂与金属基底之间的化学反应逐层去除。支架由薄合金箔制成,其所需图案由光刻掩模确定。该方法包括使用光刻术将图案转移到箔材上,随后进行化学蚀刻。之后,将蚀刻后的箔材卷成圆筒形,并通过对箔材两侧进行焊接最终形成支架。PCM工艺生产的零件无毛刺。该技术所制备的支架表面可有效克服激光加工带来的缺陷,例如熔化区和热影响区(HAZ)的快速凝固现象。更重要的是,PCM通过简单溶解不需要的金属部分,不会在金属基底中产生机械应力,从而保持材料性能不变。研究表明,PCM有望成为各类支架大规模生产的一种低成本方法。该技术可制造公差仅为几微米的部件。对于不锈钢支架,PCM工艺包括成形和焊接;而镍钛合金支架则还需增加一个定型工序。
支架几何结构
支架的长度范围为6–30毫米,直径为2–5毫米。早期的设计通常分为线圈、网状或开槽管几何结构。线圈支架由金属丝或金属条带弯曲成圆形构成。管状网状支架由金属丝缠绕成网状结构形成管材,而开槽管支架则是通过激光切割金属管材制成支架设计。线圈设计具有较大的支柱宽度以及较少的连接部分,在某些情况下甚至没有连接部分,这使得该几何结构更具柔韧性。然而,其径向强度不足且网孔较大,容易导致组织脱垂。支架设计概念较为复杂,需要具备良好的输送性、通过性、高扩张率、回缩控制以最小化移位和缩短,并具有良好的可视性。支架设计的持续演变推动了多种多样的支架几何结构的发展,实现了强度与柔韧性的最佳平衡。
支架设计可根据连接元件的构型分为开孔或闭孔结构(图4)。对于闭孔几何结构(图4A),相邻环段通过桥接元件在每个可能的连接点处相连。这些N形、S形或V形连接器可在支架扩张过程中发生塑性变形,使相邻环段能够轻松适应动脉形态。闭孔设计的优点是具有最佳的支撑和均匀表面,无论弯曲程度如何。然而,上述支架设计相比开孔设计更易发生断裂,且灵活性较差。在开孔结构(图4B)中,支架后续节段之间的一部分桥接元件被移除。未连接的结构元件有助于提高支架的贴壁性和灵活性;但其支撑均匀性低于闭孔设计(图4)。

另一个问题是支架梁的厚度。尽管增加梁厚度可以提高支架的血管壁支撑能力和径向强度,但已发现较厚的支架梁比薄梁具有更高的再狭窄风险。此外,已证实圆形梁截面更有利于血流的平滑流动,而方形梁截面由于其尖锐的边缘会干扰血流,甚至可能切割血细胞。简而言之,每种支架几何结构都有其优缺点,应根据特定的临床应用进行调整。
已商业化的心血管支架
市场上可用的支架可分为三大类:裸金属支架(BMS)、部分生物可吸收支架和生物可吸收支架。表5列出了目前商业化销售的各种支架及其简要说明。
在表5中可以看出支架随时间的演变及其特征的多样性。例如,可以观察到支撑杆厚度的演变(其重要性此前已作描述),以及在生物可吸收装置开发中使用的多种聚合物和药物。吸收时间、FDA批准年份及其他一些细节均表明了市场上医疗器械的多样性。这种多样性是由于在单一医疗器械中满足所有支架要求所面临的挑战所致。
研究与未来趋势
正如本文所证实的,由于再狭窄和晚期支架内血栓仍然是存在的问题,因此仍需大量努力来改善这些器械的临床性能。
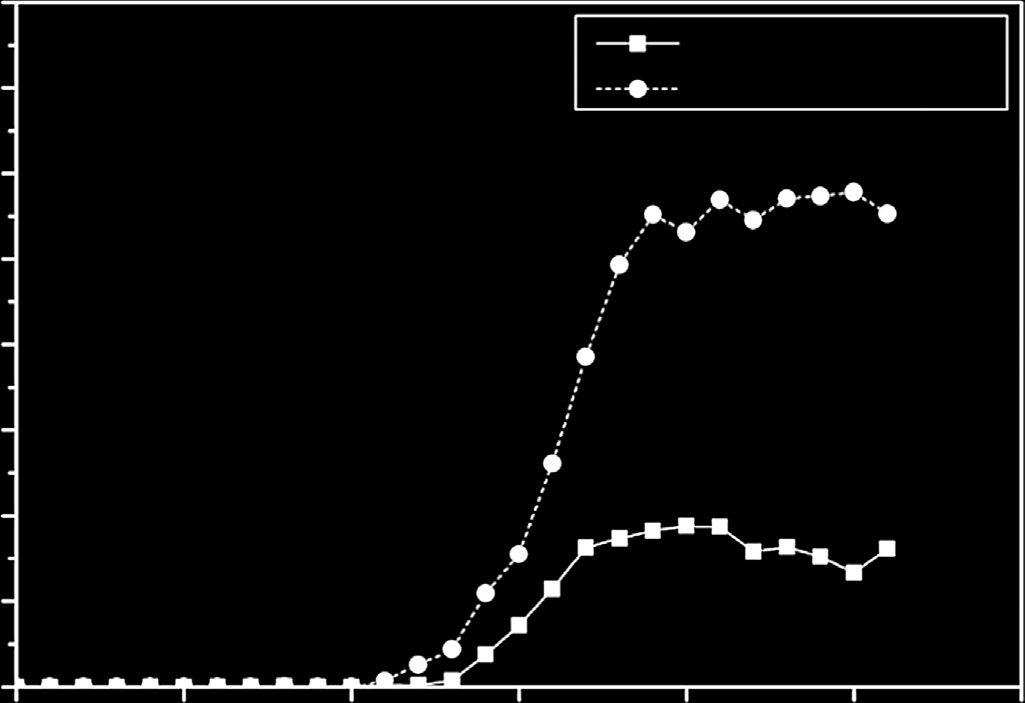
图5展示了支架研究演变过程中的若干趋势。如图所示(图5A),药物洗脱支架(DES)在过去十多年中一直是研究的焦点。然而,由于临床评估显示某些药物洗脱支架的再狭窄率和晚期支架内血栓发生率可能高于裸金属支架;并且考虑到生物可降解涂层(近期正在开发中)降解后,裸露的金属将暴露于血管环境中;因此,对裸金属支架的研究正重新受到关注。众所周知,裸金属支架的主要问题是相对较高的再狭窄率,而通过减小支架的管壁厚度可降低该风险。这便是自2012年以来钴‐铬合金相比不锈钢受到更多研究的原因之一,如图5B所示。这些合金具有更高的强度,可实现更细的支撑杆。尽管市场上仍存在由不锈钢制成的支架(如表5所示),但其使用似乎正逐步被钴‐铬支架所取代。
如今,开发具有更高强度的新型金属合金以提供更细的支撑杆已显而易见,这是一个颇具前景的研究领域。在图5B中可以看出,人们对钛合金的兴趣正在增加,主要原因是这些合金具有高耐腐蚀性和高强度。然而,这些合金的主要缺点是冷成形能力低,这可能会使支架制造工艺变得困难。此外,将支架应用所需的所有机械性能集于一种钛合金中仍是一项挑战。目前已研究用于此应用的一些钛合金体系包括 Ti–Fe–Cu、Ti–Nb–Zr–Mo–Sn 和 Ti–Ta–Hf–Zr。
从图5C可以看出,与心血管支架相关的出版物数量仍然很高;然而,可以注意到对神经支架的兴趣正在增加。对于这种应用,由于颅内血管弯曲,支架应具有更高的柔韧性和输送性,这可以通过更细的支撑杆来实现。再次可以看到,趋势是进一步降低支架的管壁厚度。
关于涂层的研究,近年来正在研究通过结合生物活性分子来吸引内皮祖细胞(EPCs)至支架表面,以促进再内皮化过程。尽管一种名为Combo双疗法支架(OrbusNeich)的新支架已上市,该支架含有抗CD34抗体作为生物活性分子,但在临床应用之前,仍需对EPC捕获支架进行进一步研究和改进。主要挑战在于找到最有效的生物活性分子以捕获EPCs(对EPCs具有高特异性的分子),以及找到一种在不使生物活性分子失活的情况下对支架进行灭菌的方法。最初使用的分子如抗CD34抗体和 VE‐钙黏蛋白对EPCs的特异性和亲和力不足,且可能同时捕获平滑肌细胞(SMCs),从而导致再狭窄。最近的研究正在使用适配体作为生物活性分子,这些适配体是对其靶标具有高亲和力的DNA或肽序列。
关于新的制造工艺,增材制造(AM)是一种具有巨大潜力的激光技术,可用于为特定患者身体定制的支架制造。该技术使用高能激光作为能量源,烧结金属粉末颗粒以逐层构建,生成期望的几何形状。基于粉末床熔融的增材制造工艺表现突出,是一种极具前景和吸引力的选择,可直接从粉末生产支架前体,从而省去微型管制造和激光微切割工序。迄今为止,尽管尚无通过增材制造技术生产的商用金属支架,但近期已有研究报道了增材制造在支架制造中的可行性。
最后,开发可降解支架(聚合物或金属的),以避免生物材料在适当的时间段后完全消失所带来的长期影响,是当今最具吸引力和前景的研究领域之一。这一主题将在本章关于可降解金属的另一篇文章中进行阐述。
 AND 支架 *),((钴 OR Co) AND (铬 OR Cr)) AND 支架*,(铂) AND 支架*,以及((钛 OR Ti)) AND 支架*;(C)(心脏的 OR 心脏病学* OR 冠状的 OR 心血管的) AND 支架*,以及 神经学* AND 支架*)
AND 支架 *),((钴 OR Co) AND (铬 OR Cr)) AND 支架*,(铂) AND 支架*,以及((钛 OR Ti)) AND 支架*;(C)(心脏的 OR 心脏病学* OR 冠状的 OR 心血管的) AND 支架*,以及 神经学* AND 支架*)
延伸阅读
班达尔,A.‐M.,罗塞爾,M.,& 斯蒂芬,Y. (2013)。冠狀動脈支架斷裂:一種工程方法(綜述)。材料科學與應用,4。https://doi.org/10.4236/msa.2013.410075。布塔尼,J.,卡邁克爾,K.,梁,S. W.,& 柯林斯,M. J. (2005)。冠狀動脈支架:識別與評估。臨床病理學雜誌,58,795–804。https://doi.org/10.1136/jcp.2004.024174。伯恩,R. A.,約納,M.,& 卡斯特拉蒂,A. (2015)。支架內血栓與再狹窄:我們學到了什麼以及未來方向?安德烈亞斯·格倫齊格演講ESC2014。歐洲心臟雜誌,36,3320–3331。https://doi.org/10.1093/eurheartj/ehv511。夏爾潘蒂耶,E.,巴爾納,A.,吉勒文,L.,& 朱利亞德,J. M. (2015)。完全可生物降解的藥物洗脫冠狀動脈支架:一篇綜述。心血管疾病檔案,108,385–397。https://doi.org/10.1016/j.acvd.2015.03.009。曹,K.,新実,M.,中井, M.,日枝,J.,& 川崎,Y. (2013)。用于生物醫用應用的高模量Ti‐Fe‐Cu合金的開發。材料學會報,54(4),574–581。德米爾,A. G.,& 普雷維塔利,B. (2017)。通過選擇性激光熔化增材制造心血管鈷鉻支架。材料與設計,119,338–350。何,M.‐Y.,陳,C.‐C.,王,C.‐Y.,張, S.‐H.,謝,M.‐J.,李,C.‐H.,等 (2016)。冠狀動脈支架的發展:從金屬裸支架到可生物降解類型。金屬(巴塞爾),6,168。https://doi.org/10.3390/met6070168。伊克巴爾,J.,貢恩,J.,& 塞魯伊斯,P. W. (2013)。冠狀動脈支架:歷史發展、現狀與未來方向。英國醫學通報,106,193–211。https://doi.org/10.1093/bmb/ldt009。林,J.,奧贊,S.,李,Y.,等 (2016)。具有潛在支架應用前景機械性能的新型Ti‐Ta‐Hf‐Zr合金。科學報告,6,1–11。馬尼,G.,費爾德曼,M. D.,帕特爾,D.,& 阿格拉瓦爾,C. M. (2007)。冠狀動脈支架:材料視角。生物材料,28,1689–1710。https://doi.org/10.1016/j.biomaterials.2006.11.042。孟,H. 等(2009)。使用光纤激光切割系统的血管支架激光微加工。光学与激光技术,41(3),300–302。https://doi.org/10.1016/j.optlastec.2008.06.001。奧布賴恩,B.,扎法爾, H.,易卜拉欣,A.,扎法爾,J.,& 沙里夫,F. (2016)。冠狀動脈支架材料與塗層:技術與性能更新。生物醫學工程年鑒,44(2),523–535。龐桑,P.,米萊,C.,舍維,J.,& 普羅夫特,J. (2004)。比較和優化用于支架應用的鈷鉻管材。ASM醫療器械材料與工藝會議,25–27。齊, P.,嚴,W.,楊,Y.,等 (2015)。通過等離子體聚合烯丙胺薄膜固定DNA適體以構建內皮祖細胞捕獲表面。膠體與界面B:生物界面,126, 70–79。羅金,A. (2011)。支架:冠狀金屬假體背後的人與詞。循環:心血管介入,4,206–209。https://doi.org/10.1161/CIRCINTERVENTIONS.110.960872。魯普曼尼,P.,塞圖拉曼,S.,薩提什,S.,& 瑪赫斯瓦里·克里希南,U. (2016)。血管支架的變遷:從被動結構到智能裝置。RSC進展,6,2835–2853。https://doi.org/10.1039/C5RA19109B。斯米洛維茨,N. R., & 費特,F. (2016)。急性心肌梗死的直接血管成形術和支架植入術歷史。當前心臟病學報告,18,5。https://doi.org/10.1007/s11886‐015‐0681‐x。施托克爾,D.,邦西尼奧雷,C.,& 杜達,S. (2002)。支架设计综述。微创治疗及辅助技术,11(4),137–147。https://doi.org/10.1080/136457002760273340。西多‐普盧姆,G.,& 塔布里齊安,M. (2008)。支架塗層策略綜述:臨床見解。材料科學與技術,24,1127–1143。https://doi.org/10.1179/174328408X341816。他們,S. (2004)。藥物洗脫支架簡史。生物傳感器國際, 2003–2005。田,Y.,余,Z.,翁,C. Y.,肯特,D.,& 王,G. (2015)。用于支架的生物醫用β型鈦合金薄壁管的顯微組織、彈性變形行為和機械性能。生物醫用材料力學行為雜誌,45,132–141。惠利,M. H.,& 菲諾爾,E. A. (2007)。設計理想的支架。今日血管內介入,6,25–34。




















 713
713

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








