一种用于向啮齿动物递送纳米颗粒的新型鼻内喷雾装置
1 引言
在过去二十年中,针对中枢神经系统(CNS)和全身性疾病药物载体的开发引起了广泛关注[1]。载药纳米颗粒已通过鼻内、贮库/可注射途径在啮齿动物模型中进行了测试(皮下、肌肉内、腹腔内(IP)和静脉注射)以及口服给药途径治疗这些疾病[2,3]。
在所有这些潜在的给药途径中,鼻内途径不仅被发现是到达大脑最快的方式,而且由于与大鼠注射或口服给药相比具有更高的中枢神经系统摄取,还表现出更高的后续药物生物利用度[3–6]。这些优势被认为源于纳米颗粒鼻内给药后发生的一系列生物转运事件,即通过间接途径(如嗅觉上皮细胞的内吞作用、通过上皮的转胞吞作用以及摄取)通过鼻血管床的血管途径和/或直接途径(即通过延伸至鼻黏膜的嗅觉神经细胞对颗粒进行内吞作用)[7]。因此,通过避免药物在胃肠道中的潜在降解以及肝脏的首过代谢,可使更多的药物浓度到达中枢神经系统[7]。
目前,大多数关于使用纳米颗粒进行鼻内给药的研究涉及将制剂直接移液至麻醉状态下的啮齿动物的鼻腔中[8–10]。然而,这种给药方式效率相对较低且不可重复,因为存在显著且可变的鼻滴现象,药物会沿鼻腔流入咽部[11]。一些先前的专利鼻喷装置试图通过使用针头刺破膜封预充储液器,并利用负压吸入固定体积的液体来解决这种变异性问题[12,13]。这些设备理论上可将一致的剂量加载到喷雾室中,但依赖于患者完全用力来启动喷雾泵,从而可能引入剂量间变异性[14]。计量阀也曾被用于递送特定体积的药物,但由于两次喷雾之间压力下降,仍可能引入剂量间变异性[15,16]。由于这种变异性,大多数临床使用装置要么是预先装好每位患者所需体积的单剂量装置,要么是可连接注射器的喷雾装置(例如喉罩国际公司的黏膜雾化装置(MAD)),其中注射器在连接到MAD之前先进行装载[17]。尽管此类无菌包装一次性用品对急性治疗有效,但对于需要长期多次给药的慢性治疗而言,成本效益不高。
为了解决这些挑战,我们开发了一种配备电子控制压力源的加压式单剂量鼻喷装置,以确保药物或载药纳米颗粒悬浮液以足够的压力输送至啮齿动物的嗅上皮,并在每次连续喷雾时保持相同的压力(见图1)。本研究的目标是:(1)设计一种能够在体内均匀且可重复地喷洒鼻上皮表面的单剂量鼻内喷雾装置;(2)证明该鼻内装置在雾化纳米颗粒以诱导未处理大鼠产生强直性反应(代表一种生物效应)方面的体内疗效;以及(3)证明该装置在增强凝集素功能化纳米颗粒递送至大脑方面的疗效,这些纳米颗粒旨在促进其与鼻上皮高表达的N‐乙酰葡糖胺残基结合,相较于裸纳米颗粒和传统的移液技术而言具有更优效果[8,18–20]。
2 鼻内喷雾装置的设计
本文所介绍的鼻内喷雾装置的工作原理借鉴了该领域的大量研究成果,旨在通过微流控流动聚焦产生高效单分散喷雾[21,22]。该设备的工作原理如下:当外部气动压力施加到中央储库时,纳米颗粒‐药物悬浮液被推动流向喷嘴。然而,在到达喷嘴之前,药物流被设备两侧内部气道的气流包围。这种两相流被限制并聚焦进入喷嘴,使液体纳米颗粒流集中在喷嘴的中心区域。当两相流从喷嘴出口喷出时,由于膨胀作用在液‐气界面引入不稳定性,导致液体断裂并发生雾化[21,22]。液滴形成的模式和尺寸取决于毛细数、喷嘴直径以及两相压力的比例。这种简单的结构能够在简单几何结构中持续产生任何液体的均匀液滴分布。高压聚焦流在纳米颗粒从喷嘴喷出的瞬间将其气溶胶化,从而在啮齿动物鼻腔内形成单一可控喷雾(图2)。用户可通过电磁阀利用LABVIEW编程界面实现对施加压力的基于计算机的控制。
该鼻内喷雾装置设计紧凑,便于携带,总长度为64.5毫米(包括喷嘴外部突出部分,长10.75毫米),宽度为30毫米,高度为7毫米。所制造的鼻内喷雾装置的具体组件如图3(a)–3(f)所示。该设备组件包括喷嘴、外壳、后部压力入口、内部载气通道网络、位于储库顶部的外部压力入口、中央储库,以及连接中央储库与载气通道用于雾化的中央通道。选择六边形形状是为了在将装置插入大鼠鼻孔时可轻松调整至多个角度。六边形外壳的长度和高度设计便于手持和操作,在流动聚焦或雾化过程中无显著作用。喷嘴(图3(a))总长度为15毫米,从主体突出10.75毫米,外部呈锥形,尖端直径为1.5毫米,基底直径为4毫米,中央设有直径为1毫米的中央圆柱通道(图3(b))。由于喷嘴外部尖端直径为1.5毫米,上述鼻喷装置的喷嘴应能舒适地置于大鼠鼻腔的鼻孔内,其平均外鼻孔直径为1.8毫米[23]。喷嘴的小直径还可使设备顺利进入啮齿动物鼻腔,避免造成组织损伤或呼吸阻塞[24]。为了在设备或喷嘴损坏时便于重复使用,喷嘴通过螺纹连接设计成可从鼻喷装置主体上拆卸。
选择这些尺寸是因为它们是所使用的3D打印机在制造过程中能够可靠地复制出相对光滑侧壁的最小尺寸。
鼻内喷雾装置的主体呈六边形,长度为40.21毫米,宽度为30毫米(图3(c))。其内部包含一个可外部加载的药物储库,并通过一个直径为3毫米的圆形横截面小通道与设备的喷嘴部分相连(图3(c)–3(e))。药物储库还设有气压连接器,可用于将药物溶液以气动方式推入喷嘴部分。主体内部设有一个从设备后部开始的内部气流通道,随后分成两条通道,沿六边形周长延伸,横截面为直径3毫米的圆形。这些气流通道用于将加压空气引导至主体外围,最终进入喷嘴(图3(e))。采用上述流动聚焦法,将纳米颗粒溶液聚焦至喷嘴中心,以防止喷嘴堵塞和污染。该装置的储库设计使得可通过移液方式轻松加载可控量的纳米颗粒溶液。考虑到成年大鼠鼻腔总体积(≈2576.5 mm³)及啮齿类动物体重可能存在差异,每次喷雾需使用可变体积的载药纳米颗粒溶液来实现2毫克/千克剂量的给药[24]。从11.4毫克/毫升载氟哌啶醇纳米颗粒溶液中,根据大鼠体重(300–500克),每次给药所需的药物制剂(即本研究中的载药纳米颗粒)体积为≤50微升,因此需要总储库容量为≈100微升。中央储库(图3(e)和图3(f))设计为直径3毫米、高度5.6毫米(总体积¼ 40微升);结合储库上方顶部压力入口(直径3毫米)的体积,总储库体积达到101微升。该储库可在不同动物间通过定制药物或纳米颗粒剂量进行填充,误差范围±1微升。因此,中央储库可首先加载特定达到2毫克/千克剂量所需的药物体积。加压空气随后会推动中央储库内的药物溶液,使其通过小型中央通道流向喷嘴,确保目标药物体积从设备中完全排出。请注意,可根据特定关注药物所需的剂量大小或潜在剂量范围,将具有不同储库尺寸的设计按需集成到设备中。
中央储库通过一个小型中央通道(长度¼ 2.95毫米,直径¼ 1毫米)连接至圆形内部气道汇合的位置(图3(e))。外部施加的(空气)压力驱动药物载液从储库流入聚焦流体积,促进纳米颗粒溶液的雾化以及喷雾从喷嘴向鼻腔的喷射。液体输送中央通道(1毫米)与加压空气通道(3毫米)的直径比例保持为1:3。这有助于在雾化过程中在纳米颗粒悬浮液周围形成气罩,防止液体与空气通道壁接触,从而避免通道堵塞或材料损失。中央通道的长度为2.95毫米,喷嘴总长度为15毫米,因此中央储库距离喷嘴入口为17.95毫米。需要注意的是,根据我们的经验,中央储库到喷嘴的确切距离对设备功能并不重要,该距离的选择主要是为了适配设备的外部几何结构。
 喷嘴设计(左),(b) 喷嘴设计(前),(c) 从顶部观察设备的外部视图(左),(d) 从正面观察设备的外部视图,(e) 从顶部观察设备的内部视图(左),以及(f) 从侧面观察设备的外部视图(左))
喷嘴设计(左),(b) 喷嘴设计(前),(c) 从顶部观察设备的外部视图(左),(d) 从正面观察设备的外部视图,(e) 从顶部观察设备的内部视图(左),以及(f) 从侧面观察设备的外部视图(左))
3 方法
3.1 鼻腔喷雾装置的制造与操作
使用AUTOCAD INVENTOR 2012年软件(Autodesk,3D系统公司,加利福尼亚州圣拉斐尔)设计了一种基于聚焦流喷嘴的装置,并随后使用VisiJet EX200塑料丙烯酸通过ProJet HD 3000 3D打印机(3D系统公司)制备引物。该设备连接到一个气动压力源,可通过三通常闭式歧管电磁阀(SM10MM‐30‐12‐3)(汉弗莱,卡拉马祖,密歇根州)进行脉冲控制,该电磁阀连接至N1 ELVIS IIþ 100 MS/s示波器电路板(美国国家仪器公司,奥斯汀,德克萨斯州),并通过LABVIEW接口实现自动化,以确保设备控制的可重复性(图2)。进入设备的压力通过氧气罐上的调节器测量,而电磁阀则实现了对通过鼻喷装置的氧气压力的精确控制。
3.2 材料
MePEG3000–PLGA30479(L/G¼ 50/50) 和 Mal–PEG3400–PLGA36934(L/G¼ 50/50) 共聚物购自PolySciTech(西拉法叶,印第安纳州)。STL(EY Laboratories,南旧金山,加利福尼亚州)、2‐亚氨基硫醇盐酸盐(Prochem,梅德利,佛罗里达州)、氟哌啶醇(Sigma‐Aldrich,奥克维尔,安大略省,加拿大)以及双辛可宁甲酸(BCA)二钠盐水合物(98% 纯度,Sigma‐Aldrich)均直接使用,未经进一步处理。去离子水使用Millipore Simplicity 系统(Millipore,贝德福德,马萨诸塞州)进行纯化。其他所有化学品均为分析纯试剂,未经进一步纯化即使用。
3.3 非功能化和STL功能化PEG–PLGA纳米颗粒的制备与表征
根据Piazza等人所述的乳化/溶剂蒸发法,采用Me–PEG–PLGA与Mal–PEG–PLGA的9:1质量比制备了载有(载药)和不含(空载)氟哌啶醇的STL功能化的PEG–PLGA纳米颗粒[6]。空载和载药STL功能化纳米颗粒的关键特性总结于表1中。动态光散射结果显示,这两类纳米颗粒的z‐平均直径均为120–130 nm,且多分散性相对较低(<0.23);透射电子显微镜观察也证实了两种情况下均为球形形貌(数据未显示,见参考文献[6])。通过结合后上清液的BCA检测,测得无论是否存在药物,平均每纳米颗粒标记14.9 ± 65.7个STL分子(STL/纳米颗粒),以促进增强的纳米颗粒–鼻黏膜上皮相互作用。空载与载药纳米颗粒之间的泽塔电位无显著差异(t ¼ 0.3799,自由度¼ 18,p> 0.05),表明空载和载药载体之间的电荷驱动的上皮相互作用相同。对于载药纳米颗粒,包封率(EE)为 ≈74%,载药量(DLC)为 ≈0.87%(通过高效液相色谱法(HPLC)测定)。纳米颗粒制剂从未进行冷冻干燥,并保存在1 ml去离子水中,置于 4 °C冰箱中待后续使用。
| 纳米颗粒类型和包封药物 | 纳米颗粒大小 (纳米米) | 泽塔电位(毫伏) | EE | DLC |
|---|---|---|---|---|
| STL功能化空纳米颗粒 | 123 ± 0.3 | -14.8 ± 0.6 | — | — |
| STL功能化氟哌啶醇载药纳米颗粒 | 128 ± 1.0 | -15.2 ± 0.8 | 74.7 ± 0.8% | 0.87 ± 0.02% |
“±”指的是标准误(SEM)。
3.4 鼻内喷雾装置的喷雾分布
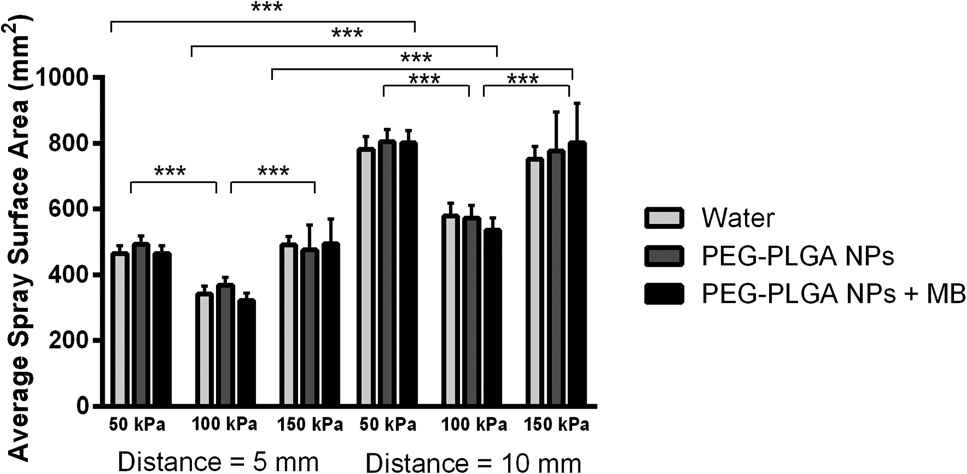
将鼻内喷雾装置用胶带固定在S8APO显微镜(Leica,韦茨拉尔,德国)的载物台上,并配备10415929 0.5×相机,以观察在50、100和150 kPa(0.5、1或1.5 巴)气溶胶化压力下通过喷嘴的喷雾情况。所有图像均在每段视频中的同一时间点捕获,并使用IMAGEJ(美国国立卫生研究院,贝塞斯达,马里兰州)进行处理。为了确定每次喷雾覆盖的上皮表面积,使用移液管将100 μl的水、PEG–PLGA 纳米颗粒或含2%亚甲蓝的PEG–PLGA 纳米颗粒等分试样加入设备的储库中。随后,在测试的压力下,将储库内容物气溶胶化(n ¼ 10),持续30秒,喷雾位置位于垂直平面前方5 mm或10 mm处。一张纸被固定。然后记录每个球形喷雾表面积的最大直径,以便比较不同压力下喷雾覆盖面积的疗效。
3.5 动物
从查尔斯河实验室(圣康斯坦特,魁北克省,加拿大)获取了24只体重在275至300克之间的雄性斯普拉格‐道利大鼠。所有动物的饲养和实验均遵循《实验动物护理与使用指南》(加拿大动物护理委员会,1984,1993)中所述的指导原则,并符合麦克马斯特大学动物研究伦理委员会批准的实验方案。所有实验均使用雄性斯普拉格‐道利大鼠;该品系最常用于研究精神类药物对动物行为的影响,且使用雄性大鼠而非雌性大鼠可避免因雌性动情周期带来的潜在干扰[25]。大鼠被单独饲养,环境温度和湿度保持恒定,明暗循环为12小时光照/12小时黑暗,并可自由获取食物和水。饲养环境温度维持在 21 ± 1 °C,所有实验均在白天周期内进行。
3.6 强直性测试
在每次实验过程中,将大鼠转移至隔音室,并使其适应环境至少半小时,然后进行药物处理。将大鼠的前爪轻轻放置在距木制平台10 cm高的水平金属棒上,测量其保持该姿势的时间。每组大鼠(n ¼ 6)分别单次给予以下处理:(1)通过移液管鼻内给药空载STL功能化纳米颗粒(麻醉状态);(2)通过移液管鼻内给药载氟哌啶醇的STL功能化纳米颗粒(非麻醉状态);(3)通过移液管鼻内给药载氟哌啶醇的STL功能化纳米颗粒(麻醉状态);(4)通过鼻喷装置鼻内给予载氟哌啶醇的STL功能化纳米颗粒(麻醉状态)。对上述各组大鼠采用2:4(空气:异氟烷)的比例在麻醉室内进行轻度麻醉,随后在转移至鼻罩时将比例调整为2:3,再进行药物制剂的鼻内给药。需注意,通过移液管对非麻醉(或轻度麻醉)大鼠给药时,由一名实验人员轻轻固定大鼠,另一名实验人员在2分钟内交替缓慢滴加纳米颗粒悬浮液至啮齿动物的鼻孔中。未对未麻醉大鼠使用鼻喷装置,因为大鼠的活动可能导致丙烯酸喷嘴破裂,从而造成潜在伤害。所有接受氟哌啶醇处理的大鼠仅一次性给予2 mg/kg剂量,无论给药途径如何。为确保氟哌啶醇释放产生了生物效应,在给药后1小时以30秒间隔对动物进行三次重复测试。强直性反应的最大强度以秒为单位记录,并根据在金属棒上的停留时间将时间转换为评分(1–6分)(1¼ 0–10秒,2¼ 11–20秒,3¼ 21–30秒,4¼ 31–40秒,5¼ 41–50秒,或6¼ 51–60秒)[26]。判定为强直性反应所需的最低截止评分为3分(即在金属棒上停留20秒)[27]。
3.7 组织分析
在安乐死后1小时内,采集基底神经节的纹状体区域(富含多巴胺受体)和嗅球(凝集素靶向部位)的组织样本,用于区域特异性氟哌啶醇的分析。每个组织样本均按照Igarashi等人的描述进行制备[28]。使用Sonic 300 组织破碎仪(Artek公司,印第安纳州韦恩堡)在冰上将样品加入3体积的冰冻1.15%氯化钾(KCl)溶液中匀浆,然后加入2体积的甲醇中2%(v/v)乙酸混合。将样品在9500 RPM(4 °C)条件下,使用5415 R离心机(Eppendorf,德国汉堡)离心10分钟,以去除提取的氟哌啶醇中的所有蛋白质和组织。在氟哌啶醇提取后,取20μl上清液等分试样,按先前所述方法进行高效液相色谱法(HPLC)分析[6,28]。
3.8 统计分析
采用重复测量 3 × 2 × 3方差分析(ANOVA)结合Bonferroni事后检验,评估喷雾距离和药物溶液类型对气溶胶化后喷雾覆盖面积的影响。第一个因素为压力水平(50、100和150 kPa),第二个因素为喷雾距离(距垂直表面5 mm或10 mm),第三个因素为气溶胶化溶液类型(水、PEG–PLGA NPs或含亚甲蓝的PEG–PLGA NPs)。因变量为喷雾覆盖面积。此外,采用单因素方差分析结合Tukey事后检验,评估药物处理与大鼠强直反应程度之间的关系。该方差分析的被试间因素为药物处理,共四个水平(空载STL‐NPs经鼻给药并使用麻醉、载氟哌啶醇STL‐NPs经鼻滴注无需麻醉、载氟哌啶醇STL‐NPs经鼻滴注并使用麻醉、以及通过鼻内喷雾装置经鼻给予载氟哌啶醇STL‐NPs),因变量为强直评分。另外,针对两个不同脑区(嗅球和纹状体)的大鼠组织中氟哌啶醇浓度,分别进行单因素非参数方差分析结合Tukey事后检验,以评估药物处理与氟哌啶醇组织浓度之间的关系。该方差分析的被试间因素为药物处理,共四个水平(空载STL‐NPs经鼻给药并使用麻醉、载氟哌啶醇STL‐NPs经鼻滴注无需麻醉、载氟哌啶醇STL‐NPs经鼻滴注并使用麻醉、以及通过鼻喷装置经鼻给予载氟哌啶醇STL‐NPs),因变量为组织中氟哌啶醇浓度(μg 氟哌啶醇/g 脑组织)。所有统计分析均使用GRAPHPAD PRISM软件(GraphPad Software, Inc., La Jolla, CA)完成。
4 结果
4.1 喷雾覆盖面积优化
喷雾成像在施加压力(50–150 kPa)和喷雾距离(5 mm和10 mm)的条件下进行,以观察喷嘴出口处的喷雾形态,并评估生成液滴的形状和分布情况,包括在有和无纳米颗粒悬浮液存在时的表现。在50 kPa(图4(a))下,压力不足以将药物完全气溶胶化,纳米颗粒悬浮液以液流形式流出,而非形成单个液滴。此类喷雾会导致大量液体沉积在鼻腔中,并因此类似于常规使用的移液过程。在100 kPa(图4(b))下,喷雾被雾化,且喷雾的锥角较窄,使得这种聚焦气流相比50 kPa压力更可能深入鼻腔。这类喷雾是理想的,因为产生的细小液滴可使更大比例的气溶胶化的纳米颗粒在被冲走之前到达并被嗅上皮吸收,从而有效靶向目标位置。在150 kPa(图4(c))时,喷雾完全雾化,但锥角较大。在150 kPa压力下观察到的更广区域内的广泛喷雾(图4(c))导致部分液滴滞留在成像平面上,表明该压力对鼻内递送效率较低。此类喷雾并不理想,因为大量喷雾沉积在吸收目标区域以外的部位,造成administered NPs的浪费。
通过测量气溶胶化溶液喷雾所影响的表面积,旨在确定喷雾面积小于平均嗅上皮表面积(675 ± 643 mm²(标准误(SEM))的条件,从而最大化喷雾到达目标上皮的量。选择的喷雾距离为5 mm,对应于7.0–9.1 mm大鼠鼻腔的大致中点,以及10 mm,模拟从鼻孔开口到嗅上皮的喷雾情况[24]。测得的喷雾区域与视觉评估中观察到的锥角相关,较小的锥角导致较小的喷雾区域。不出所料,随着喷雾源与目标表面之间距离的减小,喷雾覆盖面积也随之减小(F (1,162)¼ 344.8, p< 0.0001)。压力也显著影响气溶胶化溶液的喷雾覆盖面积(F (2,12) ¼ 176.1, p< 0.0001),但呈非线性关系,在所有测试样本中,100 kPa压力在两种施用距离下始终产生最小的喷雾覆盖面积(图5)。具体而言,在每个测试样本中,两种距离下50 kPa与100 kPa之间的喷雾区域均存在显著的组间差异,100 kPa与150 kPa之间也同样如此(表2)。然而,每种测试样品在两个距离下使用50 kPa和150 kPa压力时,喷雾区域的组间差异无显著性(表2)。基于这些结果,选择100 kPa压力用于通过鼻喷装置雾化载卤哌啶醇的纳米颗粒溶液。有趣的是,在各个距离/压力组合下测得的喷雾面积与是否存在纳米颗粒或同时存在纳米颗粒和小分子示踪剂(MB)无关(F(8,162)¼ 1.19,p< 0.05,p ¼ 0.3055),表明黏度在这些潜在疗法的相关范围内,对气溶胶化没有显著影响。

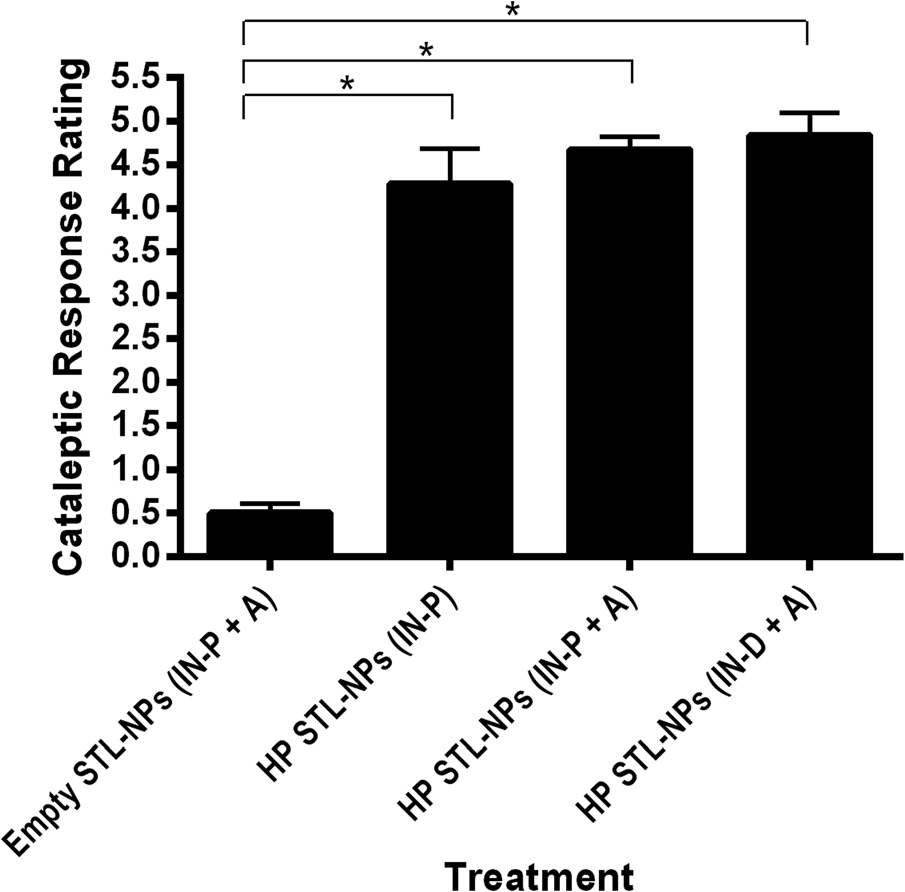
4.2 鼻内给予载卤哌啶醇纳米颗粒后的强直性测试
采用传统移液技术以及新型喷雾装置进行鼻内给药,评估载氟哌啶醇STL功能化纳米颗粒(HP‐STL‐NPs)释放的氟哌啶醇通过不同给药途径在大鼠中诱发强直症的能力(图6)。对数据进行统计分析显示,载药STL功能化纳米颗粒(HP‐STL‐NP)处理对强直评分具有显著影响(F (3,20)¼ 65.60,p< 0.0001)。无论给药途径如何,空载STL‐NPs与载药纳米颗粒之间的强直性反应均存在显著差异(Tukey事后检验,p< 0.0001),证实纳米颗粒本身不会引起强直症。此外,麻醉(A)的存在与否或鼻内给药方式(即移液管(IN‐P)与鼻喷装置(IN‐D))均未导致强直性反应出现显著差异,因为接受载药纳米颗粒给药的大鼠均表现出高度强直(Tukey事后检验,p> 0.05)。尽管啮齿动物在气管插管期间可通过口腔呼吸,但它们是强制性鼻呼吸者,双侧鼻孔阻塞可能导致不适或呼吸紊乱[30]。由于这一因素,喷嘴设计为完全封闭一个鼻孔(用于药物给药的鼻孔),而另一个鼻孔保持完全开放。当使用严格控制的压力(即100 kPa)在给药期间或之后雾化药物溶液时,未观察到任何大鼠的鼻腔中有药物制剂逸出。三种治疗方案中的任何一种或使用鼻喷装置均未发现引起任何可见的炎症(如鼻腔刺激或出血)或其他类型的可见全身性神经毒性效应(如癫痫发作、呼吸衰竭等)。
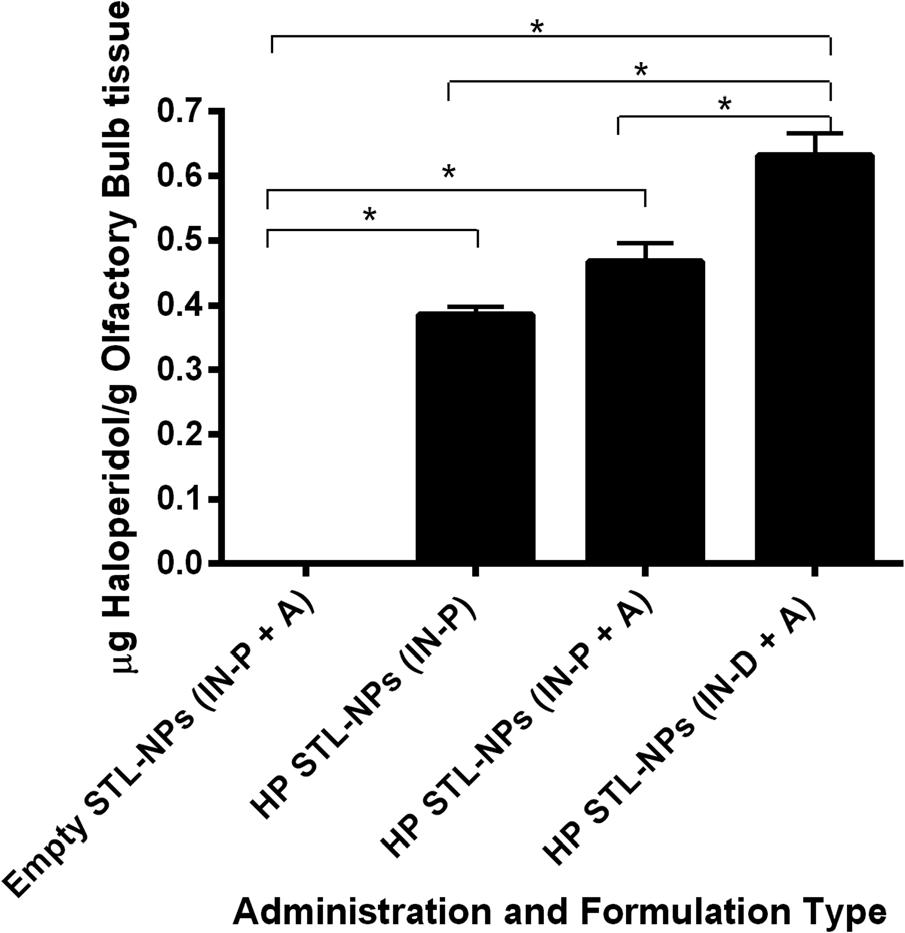
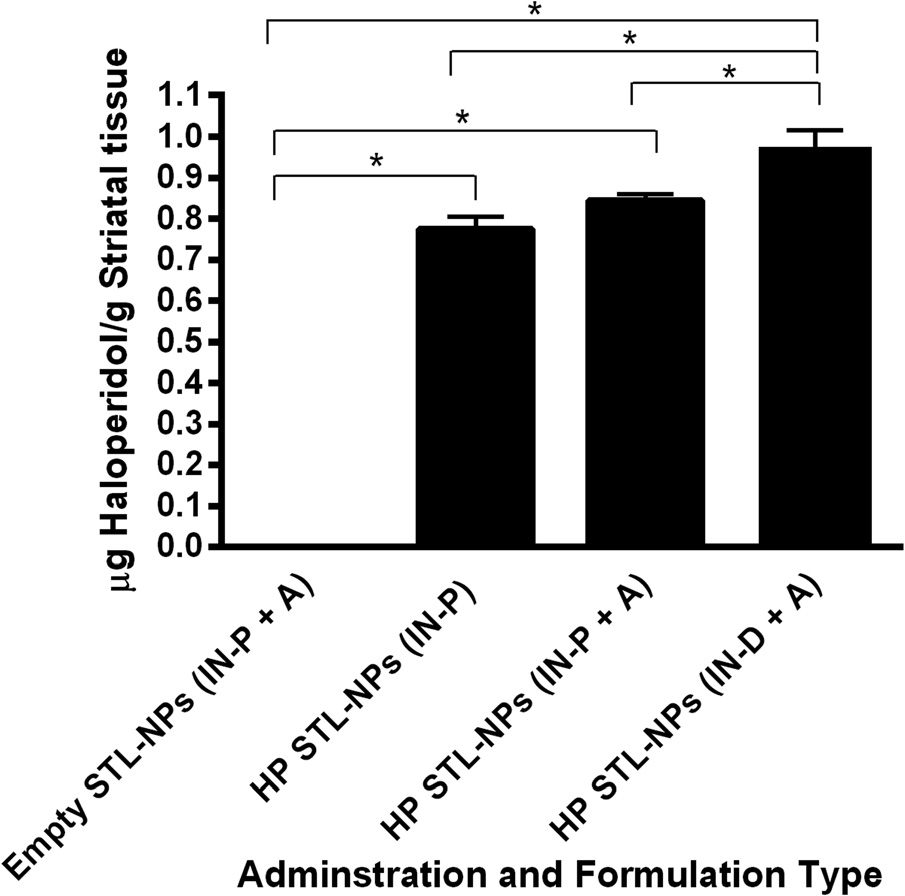
4.3 载氯丙嗪纳米颗粒鼻内给药后的组织分析
测量了经鼻内给予的载氯丙嗪STL功能化纳米颗粒(HP‐STL‐NPs)在使用或不使用麻醉(A)、使用移液管或鼻内喷雾装置(IN‐P 与 IN‐D)条件下,嗅球(图7)和纹状体(图8)中的浓度。统计分析显示,经载氟哌啶醇的STL功能化纳米颗粒(HP‐STL‐NPs)处理后,嗅球(F (3,20) ¼ 137.6,p< 0.0001)和纹状体(F (3,20) ¼ 276.7,p< 0.0001)中的氟哌啶醇浓度显著增加。此外,在空载STL‐NPs(empty STL‐NPs)和载药NPs(HP‐STL‐NPs)之间,无论给药途径如何,嗅球(Tukey事后检验,p< 0.0001)和纹状体(Tukey事后检验,p< 0.0001)中的氟哌啶醇浓度均观察到显著差异,证实了药物从鼻腔到大脑的有效摄取及后续转运。使用移液管经鼻给予载氟哌啶醇STL‐NPs时,非麻醉状态(HP‐STL‐NPs (IN‐P))与麻醉状态(HP‐STL‐NPs (IN‐P þA))大鼠在嗅球(Tukey事后检验,p> 0.05)或纹状体(Tukey事后检验,p> 0.05)中的氟哌啶醇浓度无显著差异,表明药物转运与给药期间所使用的麻醉状态无关。然而,使用鼻内喷雾装置(IN spray device)经鼻给予载氟哌啶醇STL‐NPs的麻醉大鼠,其嗅球(Tukey事后检验,p< 0.01)和纹状体(Tukey事后检验,p< 0.01)中的氟哌啶醇浓度显著高于使用传统移液技术(HP‐STL‐NPs (IN‐PþA))的大鼠;具体而言,使用喷雾装置相比简单移液在嗅球和纹状体中实现了1.2–1.5倍更高的药物浓度。在比较通过移液管给药的非麻醉大鼠与通过新型鼻内喷雾装置给药的麻醉大鼠时,同样观察到嗅球(Tukey事后检验,p< 0.01)和纹状体(Tukey事后检验,p< 0.01)中药物浓度的提升。因此,与传统递送技术相比,使用喷雾装置给药 NPs有助于改善药物向大脑靶组织的转运。
| 统计评估 不同喷雾压力下鼻喷雾表面积成对比较的显著性 | |||||
|---|---|---|---|---|---|
| 喷嘴与th之间的距离 | 喷雾表面 | 鼻喷雾压力 | 喷嘴的距离 | 从喷雾表面 | 制剂类型 |
| t值 | |||||
| 50 kPa与100 kPa喷雾压力比较 | 5 mm | 水 | t ¼ 2.773 | ||
| PEG–PLGA 纳米颗粒 | |||||
| PEG–PLGA 纳米颗粒þMB | |||||
| 10 毫米 | 水 | t ¼ 4.566 | |||
| PEG–PLGA 纳米颗粒 | |||||
| PEG–PLGA 纳米颗粒þMB | |||||
| 100 kPa 与 150 kPa 喷雾压力比较 | 5 mm | 水 | t ¼ 3.362 | ||
| PEG–PLGA 纳米颗粒 | |||||
| PEG–PLGA 纳米颗粒þMB | |||||
| 10 毫米 | 水 | t ¼ 4.566 | |||
| PEG–PLGA 纳米颗粒 | |||||
| PEG–PLGA 纳米颗粒þMB | |||||
| 50 千帕与150 千帕喷雾压力比较 | 5 mm | 水 | t ¼ 0.5897 | ||
| PEG–PLGA 纳米颗粒 | |||||
| PEG–PLGA 纳米颗粒þMB | |||||
| 10 毫米 | 水 | t ¼ 0.6725 | |||
| PEG–PLGA 纳米颗粒 | |||||
| PEG–PLGA 纳米颗粒þMB |
5 讨论
使用鼻内喷雾装置对纳米颗粒的有效给药具有三个关键优势。第一,当给药距离相当于啮齿动物鼻腔的平均长度时,单剂量鼻内喷雾装置能够产生接近体内鼻上皮表面积的喷雾覆盖面积。第二,该鼻内装置在雾化水溶液和悬浮纳米颗粒方面均表现出同等高效的性能,使其在多种潜在药物或治疗载荷的应用中具有高度通用性。第三,无论动物是否处于麻醉状态,采用鼻内喷雾装置进行纳米颗粒的鼻内给药,均可在大脑特定区域实现比使用移液管更高的药物浓度。
雾化压力被发现对雾化效率以及喷雾分布的面积均有显著影响。只有在100 kPa压力下,才能既有效雾化纳米颗粒悬浮液,又使喷雾区域在10 mm工作距离下小于大鼠嗅上皮的平均表面积(该位置位于大鼠鼻孔外侧),而50 kPa和150 kPa的工作压力均未达到此效果。上述所有特性表明,这种喷雾可实现向嗅上皮的有效输送[7]。在此条件下进行雾化,在将纳米颗粒经鼻内给药至大鼠鼻腔后,未引起任何可观察到的组织损伤、鼻出血或呼吸道阻塞。
尽管喷雾给药的STL功能化纳米颗粒成功诱导了大鼠的强直性反应(表明药物被转运至大脑),但通过移液管进行鼻内给药的STL功能化纳米颗粒,无论是否使用麻醉,同样能有效在未处理大鼠中诱导强直症(图6)。这种强直性反应无差异的现象可能是由于低至0.25 mg/kg的氟哌啶醇剂量即可诱导强直症[31],而本研究中的给药剂量(载药纳米颗粒为2 mg/kg)远高于该浓度。然而,结果明确表明,通过喷雾装置鼻内递送的纳米颗粒制剂能够将氟哌啶醇运送到其靶点(多巴胺D2受体),穿过血脑屏障,相较于现有的基于注射的局部给药策略,这是一种侵入性显著更低但效果相似的治疗方法。
研究表明,该喷雾装置可促进药物向嗅球(此前已证实,在鼻内给药后1小时,此处载药纳米颗粒浓度最高,图7)[8]和纹状体(大脑中D2受体浓度最高的区域之一,图8)[29]的转运。在使用鼻内喷雾装置进行鼻内给药后,STL功能化的载氟哌啶醇纳米颗粒在上述两个区域中的氟哌啶醇浓度比传统移液法高出1.2–1.5倍。我们认为,鼻喷装置通过增加纳米颗粒与鼻上皮结合的数量,显著提高了药物载体的递送效率;这种增强效果可能源于雾化器改善了纳米颗粒的表面覆盖范围和分散状态,同时增加了纳米颗粒与上皮碰撞时的冲击力,这些因素均有助于纳米颗粒被黏膜层捕获并进一步转运。尽管在当前实验背景下,对未麻醉大鼠进行喷雾给药被认为不符合伦理要求,但使用移液管经鼻给予载氟哌啶醇纳米颗粒的麻醉与未麻醉大鼠之间,其大脑中氟哌啶醇浓度无显著差异。虽然对麻醉啮齿动物进行鼻内给药操作更为简便,但移液法在有无麻醉条件下表现相当,表明纳米颗粒悬浮液形成的气溶胶液滴到达嗅上皮的速率可能也不依赖于麻醉状态,这支持了此类实验中继续使用麻醉的做法。还应注意的是,使用鼻内喷雾装置经鼻给予载氟哌啶醇纳米颗粒的麻醉大鼠,其纹状体组织中氟哌啶醇浓度是腹腔注射游离氟哌啶醇组的三至四倍[6,28,31]。因此,通过将鼻内给药作为首选递送途径、对纳米颗粒进行功能化以靶向鼻上皮,并利用喷雾装置实现药物在鼻腔内的均匀分布,可实现脑部递送的显著且具有临床相关性的提升。
鉴于使用一种新型鼻内喷雾装置成功改善了凝集素功能化的载氟哌啶醇PEG–PLGA纳米颗粒的鼻内递送,我们预计该开发的设备在提高基于啮齿类动物研究中枢神经系统药物制剂递送的疗效和相关性方面具有巨大潜力。特别是,由于此类鼻内喷雾装置能更真实地模拟人类鼻内给药的实际情况,我们预计在啮齿类动物研究中使用该鼻内设备将有助于改善啮齿类动物与人类在疗效结果之间的预测相关性(尤其是对于纳米颗粒药物制剂),从而加快并更清晰地将此类药物递送技术转化为临床应用。
6 结论
设计了一种可重复填充的鼻内喷雾装置,该装置相较于传统的移液方法,能够使更多的载药、靶向鼻上皮的纳米颗粒进入大脑。因此,通过喷雾技术进行纳米颗粒的鼻内给药,有可能在比使用未包封的中枢神经系统药物或通过其他方式递送的包封药物更低的药物剂量下,引发有效的治疗反应,从而可能降低此类疗法的副作用和成本(后者对于较新的治疗方法尤为重要)。特别是,在相同总药物剂量下,使用基于喷雾的凝集素功能化纳米颗粒鼻内给药,运送到大脑的药物浓度显著提高(达三倍),与传统的腹腔药物给药相比,表明该技术代表了一种比当前实践侵入性更小且更有效的药物给药方法。我们建议该设备可能特别有助于在啮齿动物中实现更相关的鼻内给药临床前建模,加快从实验室到临床的转化进程。




















 95
95

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








