基于天然聚合物的静电纺丝纤维用于抗菌用途
14.1 引言
由天然聚合物制成的静电纺纳米纤维膜是一类具有多种生物活性的生物基材料,因其优异的生物相容性、生物降解性、低毒性和固有的大表面积,近年来在伤口敷料、组织工程和药物递送等生物医学应用中成为新型材料。
天然聚合物通常难以转化为纳米纤维,因此常与合成聚合物共混,或对天然聚合物进行化学改性。表14.1列出了已通过静电纺丝成功加工的纯聚合物及其共混物。此外,静电纺丝为天然聚合物在不同领域的应用带来了全新的前景,特别是在生物医学领域。
学术界和工业界对表面抗菌处理的兴趣日益增长,其中包括与纺织材料相关的应用。从这一角度来看,抗菌纳米纤维是一个特殊领域,它结合了纳米纤维的固有特性与杀菌作用。
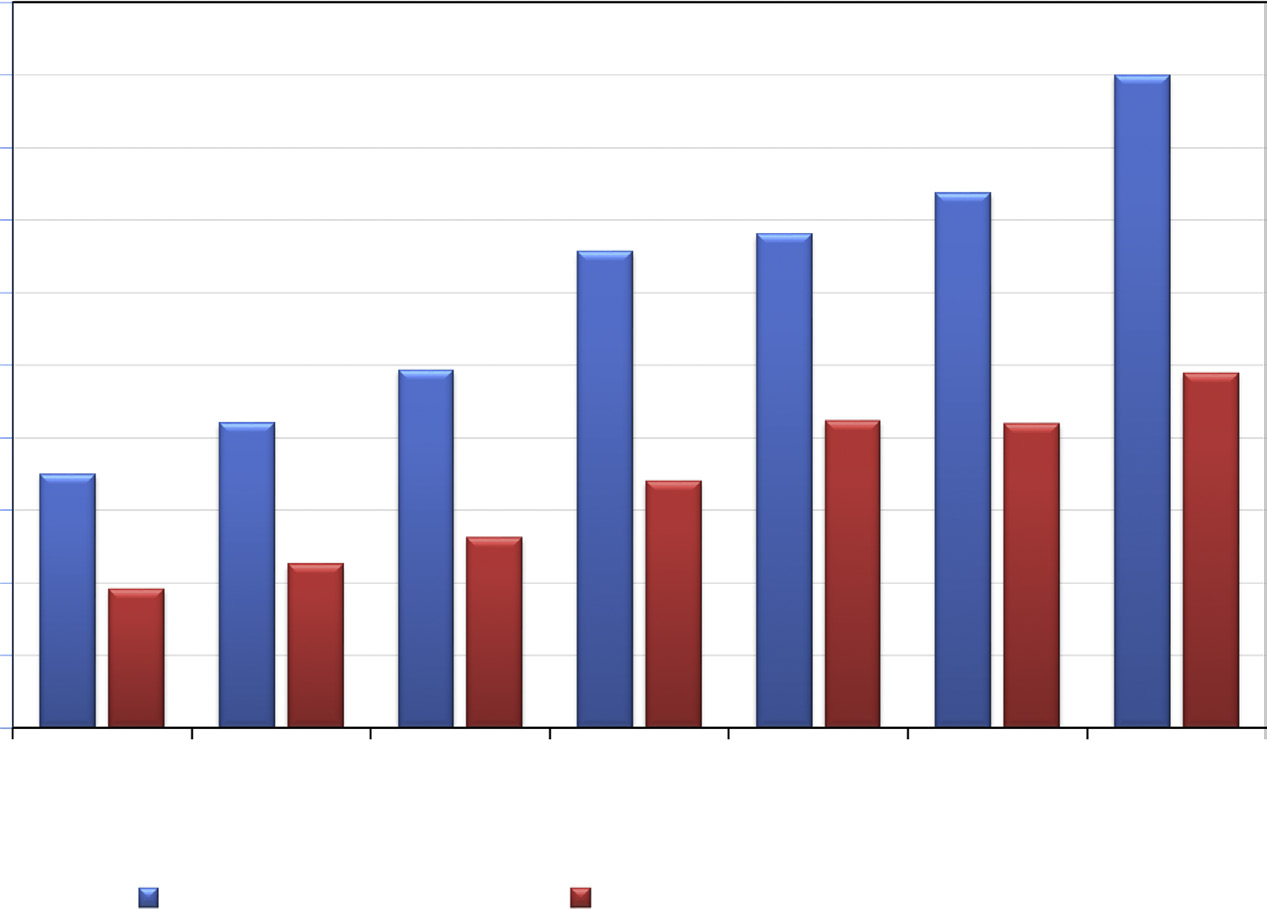
为了突出这一研究兴趣,将关于抗菌静电纺丝纳米纤维的论文数量与抗菌/抑菌织物/纺织品的论文数量进行了比较。在Scopus文献数据库中,以“(antimicr* OR antibacter*) AND (electrosp* OR nanofib*)”为检索词共检索到3141篇参考文献,以“(antimicr* OR antibacter*) AND (fabric* OR textile)”为检索词共检索到6909篇参考文献。近7年来各年度的参考文献分布情况如图14.1所示,以供对比。
14.2 抗菌纳米纤维
14.2.1 杀菌剂及纳米纤维的优势
抗菌纳米材料(例如,纳米颗粒、纳米层、纳米纤维)具有较大的比表面积,从而赋予其高效接触表面。随着对静电纺丝技术的认识不断深入,纳米纤维已被用于嵌入抗菌剂,包括贵金属纳米颗粒、金属氧化物、抗生素和杀菌小分子。纳米纤维已被证明能够控制嵌入剂的释放,并提高杀菌化合物抗菌活性的耐久性和效率。

在杀菌剂中,银是使用最广泛的之一。特别是银纳米颗粒,由于其强大的杀菌活性和广谱抗菌效果,已被应用于抗菌医用纺织品、伤口敷料、导管、医疗设备、组织工程支架以及水净化装置中。细菌膜会积累银离子,破坏ATP生成和DNA复制,并产生活性氧,直接损伤细胞膜本身。似乎银纳米颗粒的形态会影响银离子的释放,较小的纳米颗粒可以释放更多的银离子[1]。
光催化纳米颗粒也被提议作为多种具有自消毒表面产品的广谱杀菌化合物。在这一领域,材料科学的当前研究正致力于寻找能够在阳光或可见光下而非紫外线照射下发挥作用的光催化材料[2–4]。
抗菌纳米颗粒可通过静电纺丝工艺轻松地掺入纳米纤维中。所得的纳米复合纳米纤维通常在杀灭细菌方面表现出良好效果,因为纳米纤维的尺寸与纳米颗粒尺寸相当,使得暴露的活性纳米颗粒表面比例高于传统的微米级复合纤维。
抗生素药物已与静电纺丝纳米纤维结合,用于生产具有可控释放功能的抗菌膜,以用于医学应用,自2002[5]起。通过在与聚合物溶液混合进行静电纺丝之前,将药物或杀菌小分子包埋于纳米级容器或载体中,可实现可控和缓释。
最近,公众对纳米粒子/纳米材料(包括纳米级抗菌剂)和合成抗生素对环境、人类健康以及细菌耐药性问题的影响日益关注。因此,天然抗菌化合物的使用正在迅速增长,因为它们被认为具有无毒、环境可持续且不易引发强耐药细菌的优点。壳聚糖是制备抗菌纳米纤维的理想候选材料,因为它是一种本身具有抗菌性能的天然聚合物,对革兰氏阳性菌和革兰氏阴性菌均具有高活性。
然而,壳聚糖在静电纺丝中常常与其他抗菌化合物联合使用。原因在于壳聚糖难以直接转化为纳米纤维,通常需与其他聚合物(如聚环氧乙烷、聚乙烯醇、聚己内酯)共混使用。这种稀释可能导致纳米纤维杀菌作用的减弱。
14.2.2 蛋白质基纳米纤维
蛋白质是大型天然大分子(也称为多肽),由氨基酸残基的长链组成。蛋白质之间的主要区别在于其氨基酸序列的不同,这导致特定的蛋白质折叠和独特的三维结构,从而决定其在生物体内的生物活性。自然界中的大多数蛋白质由线性链构成,这些链由多达20种不同的L‐α‐氨基酸序列组成。所有蛋白源性氨基酸(除脯氨酸外)都具有共同的化学特征,包括一个α‐碳原子,其上连接有氨基、羧基和可变的侧链基团。脯氨酸与其他氨基酸不同,因其含有一个环状结构连接至N‐端氨基,使CO—NH酰胺部分呈现固定构象。
抗菌蛋白质基纳米纤维的制备通常采用在纤维中掺入杀菌剂的策略,因为蛋白质本身并不具备杀菌作用,抗菌肽和某些酶除外。
14.2.2.1 角蛋白
由于角蛋白生物材料具有生物降解性、生物相容性和天然丰度,已开发用于生物医学和生物技术应用。每年全球产生30万吨角蛋白废料。角蛋白是最丰富且环境友好的材料之一。角蛋白是一种存在于羊毛、毛发、羽毛、指甲和角中的纤维状蛋白质,其硫含量 >3重量百分比。角蛋白具有生物相容性、可生物降解性,能够自组装成高级结构,并含有精氨酸‐甘氨酸‐天冬氨酸和亮氨酸‐天冬氨酸‐缬氨酸细胞黏附氨基酸序列,因此适用于生物医学应用。文献中已有许多报道全面综述了以不同形式(如静电纺丝纤维、海绵、薄膜、水凝胶、粉末)制备的基于角蛋白的材料在生物医学应用(如组织工程支架、伤口敷料、小分子可控释放)中的用途,或用于与其他聚合物制备静电纺混合物。再生角蛋白薄膜和纤维较为脆弱,但可通过添加其他聚合物(壳聚糖、丝素蛋白、聚环氧乙烷、聚乳酸)或增塑剂以增强其机械性能[6–8]。
在抗菌材料和纺织品的开发中,正在使用含角蛋白的材料。在基于角蛋白的消费类纺织品中添加抑菌活性有助于限制可能产生难闻气味或损坏羊毛纤维的有害微生物。此外,在纳米纤维生产中,有时将角蛋白与抗菌剂混合,以制备适用于抗菌用途的天然纳米纤维。
王等人[6]利用角蛋白、聚氨酯和银纳米颗粒制备一种用于伤口敷料的创新纳米纤维膜。角蛋白从人发中提取,并用碘乙酸进行化学改性,得到S‐(羧甲基)角蛋白。将该角蛋白与聚氨酯共混后静电纺成纳米纤维。通过原位生成银纳米颗粒以制备抗菌膜。结果表明,角蛋白的使用促进了成纤维细胞增殖,且负载的银纳米颗粒未损害细胞相容性。抗菌测试结果显示聚氨酯/角蛋白/银纳米颗粒膜具有良好的抗菌性能。伤口愈合实验结果表明,由于这些生物复合材料具有优异的生物相容性和抗菌特性,相较于传统纱布敷料可加速伤口愈合。
在另一份报告中[7],将银纳米颗粒嵌入从羽毛废料和聚乙烯醇中提取的角蛋白中,以制备用于生物医学应用的纳米纤维支架。静电纺丝制备了聚(乙烯醇)/角蛋白‐银纳米纤维支架并对其进行表征。扫描电子显微镜分析显示,与低蛋白含量的纳米纤维相比,高蛋白含量的纳米纤维在形态上表现出更好的均匀性和更少的珠状结构形成。角蛋白和银纳米颗粒的存在显著降低了支架的细胞毒性并提高了存活率。四唑盐(MTT)检测表明,低浓度的角蛋白可提高细胞存活率。然而,高浓度的角蛋白会增加细胞毒性。该论文证明角蛋白可改善支架的抗菌性能,作者得出结论:聚(乙烯醇)/角蛋白‐银纳米纤维膜是医疗应用的有力候选材料。
角蛋白也存在于人发中。朴等人[8]将从人发中提取的角蛋白与聚(乙烯醇)共混,以通过静电纺丝制备纳米纤维膜。他们提高了静电纺丝性、机械性能,并通过添加聚(乙烯醇)和作为交联剂的乙二醛提高了热稳定性。采用扩散试验分析了这些纳米纤维膜对革兰氏阴性和革兰氏阳性菌的抗菌活性。在纳米纤维膜上,大肠杆菌没有抑菌圈,但金黄色葡萄球菌的抑菌圈在含有3和6重量百分比乙二醛的纳米纤维中更大。角蛋白与聚(乙烯醇)和乙二醛之间更强的相互作用可能是含有12重量百分比乙二醛的纳米纤维抗菌活性较低的原因。
迪克森等人[9]报道了通过氯化再生纤维素/角蛋白复合薄膜和纳米纤维或羊毛织物,实现角蛋白基材料的抗菌功能化。文献中有许多将抗菌剂用于纺织羊毛织物以实现功能化的例子。本文是利用再生角蛋白基复合材料制备抗菌材料的少数罕见实例之一。采用旋涂和同轴电纺技术制备含角蛋白和醋酸纤维素的复合材料,并进行脱乙酰化处理。引入核壳结构静电纺纳米纤维是为了最大化角蛋白‐氯表面面积,从而对金黄色葡萄球菌表现出比由相同材料组成的薄膜更强的活性。
在另一篇论文中[10],从羊毛纤维中提取的角蛋白与水中的二氧化钛纳米溶胶和金属银纳米粒子混合。将这些混合物进行静电纺丝,以制备多组分有机/无机纳米纤维。使用适合静电纺丝的水溶液中的胶体,可实现多功能纳米纤维的制备。作者在溶液中添加了聚(乙二醇)以改善静电纺丝性。所得的杂化角蛋白基纳米纤维经过高温处理,以制成不溶于水的静电纺膜。因此,可以洗脱出纳米纤维中的聚(乙二醇),同时保持与初生材料相似的纳米纤维结构和小尺寸孔隙。通过测量静电纺丝溶液中的胶体稳定性,使纳米粒子尺寸尽可能小。
对嵌入纳米纤维中的二氧化钛纳米粒子的抗菌性和光催化性能进行了测定,结果表明,在静电纺丝角蛋白纳米纤维中,纳米粒子的功能得以保留。采用 AATCC 100测试方法测定了含银和二氧化钛纳米纤维对大肠杆菌细菌的抗菌性能。其抗菌性能非常好,因为即使纳米粒子浸没在角蛋白基质中,仍能发挥其功能。抗菌活性取决于与细菌接种物接触的纳米纤维量。
14.2.2.2 大豆分离蛋白
大豆分离蛋白(SPI)是从大豆中提取的一种天然可生物降解聚合物。它具有可再生、可生物降解、经济和固有的生物相容性。SPI经过酸处理后具有杀菌剂作用。
大豆分离蛋白含有超过90%的蛋白质和18种不同的氨基酸。它由强共价肽键形成,球状蛋白的折叠构象中含有许多极性基团,如dOH、dCOOH和dNH2。尽管SPI可被纺丝成纤维,但其机械性能仍不够强,不过它可以与其他聚合物结合生成杂化纳米纤维。
方等人[11]已将SPI与聚(乙烯醇)进行静电纺丝,以制备适用于高性能环保型空气过滤的可生物降解多功能膜。这些过滤器通过琼脂扩散试验表明对大肠杆菌具有良好的抗菌活性。最后,对过滤膜的可生物降解性进行了评估,这对环境保护具有重要意义,并且随着大豆蛋白含量的增加,纳米纤维膜的降解速率得到提高。
制备了两种不同的抗菌高孔隙膜系统[12],一种是通过静电纺丝技术制备的负载光催化二氧化钛纳米颗粒的尼龙6纳米纤维,另一种是将吹制大豆蛋白基纳米纤维涂覆银纳米颗粒的溶液。TiO2抗菌纳米纤维在紫外光下可抑制大肠杆菌的生长并将其杀死。涂覆银纳米颗粒的大豆蛋白纳米纤维由于银纳米颗粒固有的抗菌活性,无需紫外光激活。这些抗菌系统因其良好的生物相容性,可用于水净化或伤口愈合。
王等人[13]采用低浓度聚(乙二醇)和高含量富含花青素的红树莓(糙叶悬钩子)提取物静电纺丝制备SPI。由SPI、聚(乙二醇)和富含花青素的红树莓制成的纳米纤维膜可作为天然食品稳定剂用于活性包装应用,以抑制微生物生长。
14.2.2.3 玉米醇溶蛋白
玉米中的主要蛋白质成分是玉米醇溶蛋白。玉米醇溶蛋白的主要结构为α‐螺旋构象,由九个同源重复单元以氢键稳定的反平行结构排列而成。脯氨酸和谷氨酰胺的存在使得玉米醇溶蛋白相比其他蛋白质具有更高的细胞相容性。因此,玉米醇溶蛋白对多种细胞类型的生物相容性以及基于玉米醇溶蛋白的三维整体支架已被提出作为骨组织工程的潜在支架。玉米醇溶蛋白是可再生的、可生物降解的且具有疏水性,表现出低毒性,是一种相对易于用于静电纺丝的生物聚合物。醇类是静电纺丝玉米醇溶蛋白的优良溶剂。静电纺丝玉米醇溶蛋白纳米纤维已被证明适用于组织工程,特别是单独使用或与胶原蛋白共混用于伤口愈合应用。近年来,由于其可再生来源、可生物降解性、生物相容性以及对微生物降解的抗性,玉米醇溶蛋白已被用于不同领域。例如,通过静电喷雾技术使用纯玉米醇溶蛋白和玉米醇溶蛋白/银混合溶液制备了纳米颗粒,用于抗菌应用[14]。
王等人[15]制备了玉米醇溶蛋白和玉米醇溶蛋白‐姜黄素纳米纤维,并评估了载姜黄素的玉米醇溶蛋白纳米纤维对大肠杆菌和金黄色葡萄球菌的释放动力学和抗菌活性。纳米纤维的最终形态取决于姜黄素的含量。玉米醇溶蛋白‐姜黄素纳米纤维中玉米醇溶蛋白与姜黄素之间的氢键导致玉米醇溶蛋白基质的玻璃化转变略有升高。玉米醇溶蛋白‐姜黄素纳米纤维表现出良好的抗菌活性,对金黄色葡萄球菌的效果优于对大肠杆菌,这可能是由于细胞膜结构不同所致,且抑制效率随姜黄素含量增加而提高。
这项工作表明,玉米醇溶蛋白‐姜黄素纳米纤维可能有潜力作为抗菌应用材料,用于抑制食品包装中的细菌生长和传播。
本文[16],采用胶原蛋白/玉米醇溶蛋白混合物在水/乙酸溶液中通过静电纺丝制备了用于伤口愈合的生物相容性纳米纤维膜。添加玉米醇溶蛋白改善了胶原蛋白的静电纺丝性。在此研究中,由于小檗碱是一种对大肠杆菌和金黄色葡萄球菌具有优异抗菌性能的异喹啉生物碱,因此将其掺入静电纺丝纳米纤维膜中以实现其可控释放和抗菌活性。添加小檗碱对纳米纤维的形态和细胞存活率影响较小。通过琼脂扩散法检测了抗菌活性,结果显示载有较高含量小檗碱药物的静电纺纳米纤维的抑菌圈更显著。因此,载有小檗碱的静电纺胶原蛋白/玉米醇溶蛋白纳米纤维可用于伤口愈合或皮肤细菌感染的治疗。
一种适用于伤口敷料应用的银/聚氨酯/玉米醇溶蛋白杂化纳米纤维复合支架通过静电纺丝制备[17]。银纳米颗粒通过在静电纺丝溶液中还原硝酸银原位合成。金黄色葡萄球菌和大肠杆菌用于通过抑菌圈试验验证纳米纤维膜的抗菌能力。结果表明,含银复合材料具有优异的抗菌性能,且成纤维细胞黏附、增殖和生长良好。
14.2.3 纤维素基纳米纤维
纤维素是一种在自然界中广泛存在的多糖,具有生物相容性和可生物降解性。它由线性链的β(1 → 4)连接的d‐葡萄糖单体单元组成。纤维素是绿色植物和藻类初生细胞壁的重要结构成分。纤维素是地球上最丰富的有机大分子。与其他纤维素衍生物(如羧甲基纤维素(CMC))不同,纤维素本身不适合直接用于静电纺丝[18–20]。例外的是醋酸纤维素(CA),其可通过静电纺丝从溶液中轻松制备纳米纤维。此外,环糊精(CDs)也被用于静电纺丝,以制备纯纳米纤维或含有抗菌基团的共聚物纳米纤维。
在最近的研究中[18],通过静电纺丝从基于单糖、二糖和三糖组合的溶液中制备了糖类纤维。特别是,蔗糖成为通过静电纺丝制备纤维最合适的糖类。
14.2.3.1 羧甲基纤维素
CMC是一种重要的纤维素衍生聚合物,因其具有生物相容性、生物降解性、无毒性和良好的水溶性,被广泛应用于生物医学领域。由于其具有强吸湿性,能够吸收伤口渗出液,因此CMC基纳米纤维是伤口管理的理想材料。CMC的静电纺丝过程中使用聚环氧乙烷作为辅助聚合物。
2016年,两篇论文[19,20]报道了含有银纳米颗粒的抗菌CMC/聚环氧乙烷纳米纤维膜的制备。引入银纳米颗粒的方法略有不同。在第一篇论文中[19],将等质量的CMC和聚环氧乙烷水溶液以2毫升/小时的流速在+22千伏电压下进行静电纺丝。将CMC/聚环氧乙烷纳米纤维小心地浸入AgNO3溶液中,然后进行紫外照射。当银离子被引入纳米纤维时,聚环氧乙烷通过在AgNO3溶液中浸泡而被去除,并通过紫外还原生成银纳米颗粒。根据ISO 22196‐2011标准评估所得CMC/Ag复合纳米纤维对金黄色葡萄球菌和大肠杆菌的抗菌活性。CMC/Ag复合纳米纤维对两种细菌的细菌减少率均为100%。在第二篇论文中[20],将聚环氧乙烷溶解于水合AgNO3溶液中,然后向该溶液中加入等量的 CMC,直至获得均匀混合物。将所得溶液以2毫升/小时的流速和+22千伏电压进行静电纺丝。纳米纤维在室温下真空干燥过夜。透射电子显微镜(TEM)分析显示,4.5纳米银纳米颗粒在聚合物纤维基质中分散良好。作者指出, CMC在银的形成过程中起到了还原剂和稳定剂的作用。通过测量与含银及不含银纳米纤维接触后细菌悬浮液在600 nm处的光密度,评估CMC/聚环氧乙烷/银纳米纤维对大肠杆菌的抗菌特性。12小时后,与CMC/聚环氧乙烷纳米纤维接触的细菌悬浮液光密度未发生变化,而与CMC/聚环氧乙烷/银纳米纤维接触的细菌悬浮液光密度显著降低。
14.2.3.2 醋酸纤维素
醋酸纤维素(CA)是唯一可直接通过静电纺丝加工成纳米纤维的纤维素衍生物。它已被从多种不同的溶剂或溶剂体系溶液中进行静电纺丝,这些溶剂包括丙酮、二氯甲烷(DCM)、甲酸、氯仿、N,N‐二甲基甲酰胺(DMF)、甲醇(MeOH)、吡啶、丙酮/二甲基乙酰胺(DMAc)、丙酮/DMF、乙酸/水、氯仿/MeOH、 DCM/MeOH以及丙酮/DMF/三氟乙醇。CA是纤维素的乙酸酯,通过纤维素的乙酰化反应制得。
CA静电纺丝纳米纤维在细胞培养和组织工程中的应用在现有文献中尚不明确。然而,已有大量研究支持将不同抗菌化合物用于制备抗菌CA基纳米纤维的日益增长的兴趣,其中银纳米颗粒是使用最广泛的之一。在一篇论文中[21],将 CA溶解于丙酮/DMAc(2:1)中,然后加入银纳米颗粒的水分散液并与聚合物混合。CA/Ag纳米纤维对金黄色葡萄球菌、痤疮丙酸杆菌、大肠杆菌和铜绿假单胞菌的抗菌作用进行了评估。在接触时间24小时后,CA/Ag纳米纤维仅抑制了大肠杆菌的生长。
在另一篇论文中[22],将CA和AgNO3 溶解在乙酸/水(3:1)中。CA上的银含量固定为0.5%或 1.0% w/w。这些溶液在 +25 kV 电压和 3 毫升/小时 流速下进行静电纺丝。初生纳米纤维经紫外线照射以实现银离子的光还原为金属银,随后使用乙醇中的 0.5 N 氢氧化钾对醋酸纤维素进行脱乙酰化处理。经紫外线照射后,银纳米粒子的平均尺寸为 3 纳米,脱乙酰化后为 7 纳米。有趣的是,采用含银量为 0.5% 重量/重量 的样品在长时间接触(18 小时)条件下,以及采用 1.0% 重量/重量 银含量的样品在短时间接触(长达 30 分钟)条件下,评估了含银纤维素基纳米纤维对 S. aureus 和 E. coli 的抗菌作用。在脱乙酰化醋酸纤维素纳米纤维上,长时间接触对 S. aureus 的细菌减少率达到 99.9 %。为了评估短期杀菌率,将纳米纤维与 E. coli 接触不同时间(5 至 30 分钟)。初生纳米纤维活性最高,其次是经紫外线光还原后的纳米纤维和经脱乙酰化后的纳米纤维。该结果与基质中银离子的可利用性相关联。
最近,一项研究报道了采用不同方法制备的含银脱乙酰化醋酸纤维素纳米纤维的抗菌结果[23]。将醋酸纤维素溶解在丙酮/DMF(4:6)中,并在+12.6 千伏电压下静电纺丝形成纳米纤维。随后用0.05 M 氢氧化钠对纳米纤维进行脱乙酰化处理。银纳米颗粒通过一种包含三个主要步骤的化学方法在纳米纤维上合成,简述如下:(1)纤维素与氯乙酸钠反应生成羧甲基纤维素钠;(2)用银离子取代羧甲基纤维素钠中的钠离子;(3)使用NaBH4将银离子还原为金属银纳米粒子。按照JIS L1902‐2008标准测试方法,通过测量抑菌圈对金黄色葡萄球菌S. aureus和大肠杆菌E. coli进行了抗菌测试。结果表明,当银未被还原时,相比含有金属银纳米粒子的纳米纤维,其抑菌圈更大。此外,随着银含量的增加,抑菌圈宽度也随之增大。元素分析显示,当银纳米颗粒含量低于4 %时,杀菌效果似乎可以忽略不计。
为了实现银离子的可控释放,研究了沸石作为静电纺丝脱乙酰化醋酸纤维素纳米纤维表面的载体[24]。沸石是具有明确结构的微孔无机晶体固体,由四面体配位的硅和铝的三维结构组成。通过离子交换过程,合成了不同尺寸(即大、小和介孔)的沸石,将其附着在纳米纤维表面,并用银离子进行富集。采用 大肠杆菌 对抗菌特性进行了评估,接触时间为30、60和90分钟。对照组包括纤维素纳米纤维、未负载的不含银的沸石、在银离子交换条件下处理过的含银纤维素纳米纤维以及未负载的银富集沸石。纤维素纳米纤维和未负载的不含银的沸石没有显著的细菌减少率。经银处理的纤维素纳米纤维随时间推移表现出逐渐增加的细菌减少率,最高达到 ∼55%(90分钟)。含有沸石的纳米纤维在30分钟的短时间孵育后即表现出较高的细菌减少率,并在60和90分钟时达到 >90%。
一项关于纤维素纳米纤维和银纳米颗粒的研究[25]提出木质素具有多种用途:作为银和纤维素纤维表面的粘合剂、将银离子还原为金属银纳米粒子的还原剂,以及表面结合的纳米粒子的封端试剂。木质素对人体无毒,并且是纤维素工业的一种环境可持续的副产品。所制备的纳米纤维在仅10分钟接触时间后对大肠杆菌显示出100%细菌减少。
N‐卤胺由于具有广谱杀菌功效、对哺乳动物细胞低毒性、可再充电能力、良好稳定性和耐久性,是优异的杀菌剂。一些研究利用并结合了N‐卤胺与具有大表面积的静电纺纳米纤维的特性,从而提供更多N‐卤胺基团以杀灭细菌。
在另一项研究中[26]醋酸纤维素(CA)在丙酮/DMF溶液中通过二苯基甲烷二异氰酸酯(MDI)进行改性,并在流速为0.5 mL/h、电压为+20 kV的条件下静电纺成纳米纤维。所得CA‐MDI纳米纤维使用索氏提取器以乙醚萃取,以去除过量的MDI。将获得的CA‐MDI纳米纤维在pH 7条件下用10%次氯酸钠溶液氯化处理1小时。根据改进的AATCC测试方法100‐1999,测试氯化与未氯化的CA‐MDI纳米纤维对金黄色葡萄球菌和大肠杆菌的杀菌活性。未氯化的CA‐MDI纳米纤维对金黄色葡萄球菌的细菌减少率为 ∼40%,对大肠杆菌仅为3%。氯化的CA‐MDI纳米纤维在10分钟内完全灭活了金黄色葡萄球菌以及95%的大肠杆菌。大肠杆菌在接触时间达到30分钟后被完全灭活。
在另一项研究中[27],将CA溶解于丙酮/DMF(2:1)中,并加入[5,5‐二甲基‐3‐(3′‐三乙氧基硅丙基)乙内酰脲]作为N‐卤胺前驱体对CA进行化学改性。静电纺丝在+20千伏的施加电压下进行,溶液流速为0.5 mL/h。将电纺膜浸入水中,在高温下固化,然后用乙醇冲洗。冲洗后,纳米纤维膜在pH 7条件下用10%次氯酸钠氯化1小时。氯化和未氯化的纳米纤维采用改良的AATCC测试方法100‐1999对金黄色葡萄球菌和大肠杆菌进行测试,使用25 μL细菌悬浮液。接触时间为5、30和60分钟后,样品用5.0 mL无菌硫代硫酸钠溶液淬灭,以去除所有氧化性氯。氯化样品在10分钟接触时间内对金黄色葡萄球菌的细菌减少率为99.99%,对大肠杆菌为63.15%;在30分钟内对金黄色葡萄球菌和大肠杆菌的细菌减少率均达到100%。
14.2.3.3 环糊精
环糊精(CDs)是近年来在电纺中被提出用于制备抗菌纳米纤维的另一种有趣的纤维素基产品。环糊精是一类由葡萄糖单体通过环状低聚糖结构连接而成的化合物。通常由六个、七个或八个单元组成一个环糊精分子;传统上分别标记为α‐CD、β‐CD 和 γ‐CD。由于其具有中空结构,环糊精是与包括杀菌剂在内的活性化合物形成主客体复合物的理想材料,适用于多种应用[28]。
2010年,环糊精在未添加聚合物的情况下成功静电纺成纳米纤维[29]。在后续研究中[30],将环糊精和柠檬烯在水中以等摩尔比制备成复合物,然后进行静电纺丝(无需载体聚合物),得到纯环糊精/柠檬烯复合纤维。静电纺丝纤维的平均尺寸根据工艺条件的不同在0.7至1.5 μm之间,环糊精/柠檬烯纤维在水中可完全且立即溶解,而纯柠檬烯则不溶解。在37°C下经过24小时接触时间和振荡后,测试了柠檬烯和电纺CD/柠檬烯复合纤维对E. coli和S. aureus的杀菌活性。研究发现,电纺CD/柠檬烯复合纤维的抗菌性能强于柠檬烯。具体而言,柠檬烯对S. aureus和E. coli的细菌减少率分别为70%和77%;而电纺CD/柠檬烯复合纤维对S. aureus和E. coli的细菌减少率分别高达97%和93%。据推测,柠檬烯在复合物中溶解度和稳定性的提高可以解释该结果。
2014年发表的研究N‐卤胺化合物[31]结合环糊精和,用于制备适用于静电纺丝的氯化共聚物。将醋酸纤维素溶解在丙酮/DMF(2:1)中,并加入占醋酸纤维素重量5%的氯化共聚物。该溶液在流速为0.5 mL/h、施加电压为+22 kV的条件下静电纺丝成纳米纤维。采用改进的AATCC 100‐1999测试方法对氯化纳米纤维进行评估,将25 μL细菌接种液滴加在两片纳米纤维样品中间。接触时间固定为5、10和30分钟。所得溶液经淬灭、稀释和涂布处理。结果表明,大肠杆菌对活性氯的耐受性高于金黄色葡萄球菌。事实上,在与金黄色葡萄球菌接触10分钟后即测得100%细菌减少率,而对大肠杆菌则需30分钟。
14.2.4 基于壳聚糖的纳米纤维
壳聚糖是几丁质的脱乙酰化衍生物,而几丁质是一种天然多糖,存在于甲壳类动物、昆虫和某些真菌的外骨骼中。几丁质由线性链的β(1 → 4)连接的N‐乙酰 D‐葡萄糖胺单体单元组成。由于含有氨基基团,当环境pH低于约6.5(壳聚糖的pKa值)时,壳聚糖变为聚阳离子。质子化氨基基团通过壳聚糖的聚阳离子结构与微生物的阴离子细胞壁之间的静电相互作用发挥抗菌功能。壳聚糖对革兰氏阳性和革兰氏阴性细菌均表现出广谱的抗菌活性。此外,壳聚糖对哺乳动物细胞无毒且可生物降解[32,33]。
关于静电纺丝抗菌壳聚糖基纳米纤维的优秀综述已在 2013[34] 中提出。以下讨论报告了该主题最新文献的更新。
迄今为止,仅有四篇论文报道了使用溶剂溶液成功将纯壳聚糖静电纺丝成纳米纤维。2005年,耿等人[35]从7% w/w的106‐kDa壳聚糖在浓乙酸中的溶液成功制备出无珠状物的壳聚糖纳米纤维。该结果被程等人部分证实,他们使用900 kDa分子量的纯壳聚糖在浓乙酸中的3%至4% w/w溶液成功实现了静电纺丝,得到规则的纳米纤维。2006年,大川等人[36]在一份简报中报告称,通过使用不同分子量的壳聚糖在三氟乙酸中的溶液进行静电纺丝,获得了光滑纳米纤维。随着壳聚糖分子量的降低,溶液浓度在2%至8% w/w之间调整。最近,壳聚糖的静电纺丝是从5.5% w/v的纯壳聚糖(70%脱乙酰化的,311.5 千道尔顿分子量)溶于70% v/v 三氟乙酸和30% v/v 二氯甲烷[38]。
将另一种聚合物添加到壳聚糖溶液中用于静电纺丝,使得可以用水作为主要溶剂,而不是使用有毒化合物(如纯乙酸、三氟乙酸和二氯甲烷),从而实现更环保和安全的静电纺丝过程。在一篇文献[39]中,将壳聚糖(溶于90%乙酸)与聚环氧乙烷(溶于水)按30:70、50:50和70:30的比例混合。将银纳米颗粒以水分散液的形式加入聚环氧乙烷溶液中,银/聚环氧乙烷的体积比为1:9。该混合物用于制备50:50的聚合物共混物。静电纺丝在+25 kV电压和2 mL/h流速下进行。采用25 μL细菌接种物作用于1 cm × 1 cm样品,测试其对大肠杆菌和白色念珠菌的抗菌活性。结果显示,含银的50:50共混纳米纤维对两种微生物均实现了100%细菌减少率。然而,不含银的70:30和50:50共混纳米纤维也表现出优异的细菌减少效果,这是由于壳聚糖的杀菌作用所致。因此,无法评估银对材料杀菌作用的贡献。其他研究[40,41]采用了相同的聚合体系(即壳聚糖/聚环氧乙烷),其中银纳米颗粒通过植物提取物(来自欧防风和桉树)化学还原硝酸银制得。在第一篇论文[40]中,使用乙酸/水(50:50体积比)作为溶剂,壳聚糖/聚环氧乙烷的重量比为75:25。将银纳米颗粒以占聚合物溶液总重0.25%和0.50%的浓度加入。静电纺丝在+21 kV电压和1 mL/h流速下进行。纳米纤维在室温下用戊二醛蒸气交联15分钟。对抗菌性能的测试包括含银纳米颗粒的纳米纤维,以及不含银但含或不含欧防风提取物的纳米纤维作为参考样。采用改良的AATCC 测试方法 100‐2012,使用100 μL接种液体积,对金黄色葡萄球菌和大肠杆菌进行抗菌测试。含有0.25%和0.50%银纳米颗粒的壳聚糖/聚环氧乙烷纳米纤维对金黄色葡萄球菌和大肠杆菌的细菌减少率均达到100%。而不含银且不含欧防风提取物的样品对金黄色葡萄球菌的细菌减少率为∼80%,对大肠杆菌为∼76%。含有欧防风提取物(不含银)的纳米纤维对金黄色葡萄球菌的细菌减少率为∼85%,对大肠杆菌为∼81%。
在第二篇论文中[41],将壳聚糖/聚乙烯氧化物溶液用浓乙酸(80%,v/v)配制,壳聚糖/聚乙烯氧化物的质量比为80:20。将硝酸银以不同的浓度(即 5.3、10.6和21.2重量百分比)加入聚合物溶液中。静电纺丝在 +15千伏的电压和1.0毫升/小时的流速下进行。银还原成纳米颗粒通过桉树提取物在静电纺丝纳米纤维上完成。采用琼脂盘扩散法对大肠杆菌和金黄色葡萄球菌进行了抗菌试验。对于含有或不含提取物的壳聚糖/聚乙烯氧化物纳米纤维,均未观察到明显的抑菌圈。相反,含有或不含桉树提取物的壳聚糖/聚乙烯氧化物纳米纤维的抑菌圈是可测量的。
在另外两篇论文中,研究了基于壳聚糖的纳米纤维与银纳米颗粒的协同作用,并添加聚乙烯醇[42]和聚丙烯酰胺/聚乙二醇[43]以实现良好的静电纺丝。
在第一篇论文中[42],静电纺丝溶液的制备方法如下:将壳聚糖溶解于水(8% 重量百分比)中,温度为90°C。加入不同浓度的硝酸银(分别为壳聚糖重量的0.25、0.5和 1 重量百分比)。然后加入乙酸,形成银纳米颗粒,进而引发凝胶化。所得凝胶经电子束辐照(剂量为150 kGy)处理,使其恢复为溶液状态。同时,在90°C下制备10% 重量百分比的聚乙烯醇水溶液。通过将聚乙烯醇溶液与含银纳米颗粒的壳聚糖溶液按4:5的重量比混合,得到最终的静电纺丝溶液。完全混合后,加入乙二醛作为交联剂。该溶液在+15千伏条件下成功进行了静电纺丝。随后在50°C的醇蒸气中完成交联,再进行 120°C的固化处理。采用琼脂扩散试验测定纳米纤维对大肠杆菌和金黄色葡萄球菌的抑菌圈,以评估其抗菌性能。结果发现,对于大肠杆菌和金黄色葡萄球菌,最大抑菌圈均出现在中间浓度的银含量(壳聚糖的0.5 重量百分比)条件下。这种现象被解释为纳米颗粒发生了聚集效应,从而降低了银的杀菌作用。
在第二篇论文中[43],将壳聚糖/聚丙烯酰胺70:30溶液以3 wt%的浓度溶于 50%乙酸中。添加聚乙二醇至壳聚糖质量的5 wt%以降低表面张力。将硝酸银溶解于壳聚糖/聚丙烯酰胺/聚乙二醇溶液中,用于制备纯银纳米颗粒。同样,将硝酸银和三氯化铁的混合物溶解以制备银/铁复合纳米颗粒。金属离子盐的用量按总聚合物计算,使纳米颗粒浓度达到4 wt%。纳米纤维在流速为0.7毫升/小时、电压为+24千伏的条件下制备。含有银和银/铁的静电纺丝纳米纤维经紫外光照射,以将离子还原为金属纳米颗粒。对蜡样芽孢杆菌、粪肠球菌、大肠杆菌、肺炎克雷伯菌、产酸克雷伯菌、铜绿假单胞菌、奇异变形杆菌、鲍氏志贺菌、宋内志贺菌和阴沟肠杆菌进行了抗菌试验以评估最小抑菌浓度。通过加入碘硝基四唑蓝来显示纳米纤维接触后细菌的存活率。纳米纤维表现出强烈的杀菌作用,尽管某些细菌表现出较高的耐受性。含银与含银/铁的纳米纤维之间未发现统计学上的显著差异。作者目前提出的应用方向是水消毒。
基于壳聚糖的纳米纤维常被用作抗生素和杀菌药物的载体,以用于治疗局部感染和促进伤口愈合。最近,一篇论文[44]报道了通过气相二氧化硅纳米颗粒封装,将头孢唑啉(一种属于β‐内酰胺类的抗生素)引入壳聚糖/聚环氧乙烷纳米纤维中的方法。将负载头孢唑啉的气相二氧化硅纳米颗粒在水中通过纳米颗粒与头孢唑啉简单接触1小时制成分散液。然后通过离心分离负载头孢唑啉的气相二氧化硅纳米颗粒,用蒸馏水洗涤并干燥。将壳聚糖和聚环氧乙烷( 3:1)在乙酸/水 50:50中配制成混合溶液。将负载头孢唑啉的二氧化硅纳米颗粒以1 重量百分比的浓度加入聚合物溶液中。静电纺丝在+21千伏电压和1 毫升/小时流速下进行。对壳聚糖/聚环氧乙烷纳米纤维、含2.5%头孢唑啉的壳聚糖/聚环氧乙烷以及含1%负载头孢唑啉二氧化硅的壳聚糖/聚环氧乙烷根据稍作修改的AATCC测试方法100‐2012,对S. aureus和E. coli进行了评估。纯壳聚糖/聚乙烯氧化物纳米纤维具有一些抗菌活性,而含有2.5%头孢唑啉的壳聚糖/聚乙烯氧化物以及含有1%负载头孢唑啉的二氧化硅的壳聚糖/聚乙烯氧化物均对S. aureus和E. coli实现了100%细菌减少。然而,药物释放实验表明,当头孢唑啉嵌入二氧化硅中时,其释放速度更慢。
在另一项研究中[45],将甲硝唑(属于硝基咪唑类)添加至壳聚糖/聚乙烯氧化物纳米纤维中。将壳聚糖/聚乙烯氧化物(1:1)溶解于乙酸(3 vol% 水溶液)中,制备总聚合物浓度为 4 wt% 的溶液。甲硝唑按聚合物质量的 1、5 和 15 wt% 添加到溶液中。静电纺丝纳米纤维在流速为 0.495 毫升/小时、电压为 +21千伏的条件下制备。采用三种体外方法评估甲硝唑的释放情况。
盐酸四环素通过静电纺丝负载到壳聚糖/聚乳酸中[46]。四环素是一类抑制蛋白质合成的抗生素。将壳聚糖溶解于甲酸中,并加入盐酸四环素,使其在最终总聚合物中的浓度分别为0、3、5、10、20和30 wt%。聚乳酸单独溶解于氯仿/乙醇(1:1)中,然后缓慢加入壳聚糖溶液中。将混合溶液在+15 kV条件下静电纺成纳米纤维。采用琼脂扩散试验评估其对金黄色葡萄球菌的抗菌活性。当四环素浓度低于20%时,抑菌圈随四环素含量的增加而迅速增大。
磺胺嘧啶(属于磺胺类)被用于改性壳聚糖[47]。通过同轴电纺技术制备了纳米纤维,其中磺胺嘧啶改性的壳聚糖位于纳米纤维内部或外部。电纺参数为 +15千伏电压和0.042毫升/小时流速。磺胺嘧啶的累积释放在最初20分钟内较快,随后趋于稳定。剩余的磺胺嘧啶因纳米纤维的侵蚀/破坏而释放。
醋酸甲氧苄啶(磺胺类抗生素)与壳聚糖/聚(乙烯醇)结合使用,药物含量分别为0、20和40重量百分比[48]。分别制备聚(乙烯醇)的水溶液、壳聚糖的冰乙酸溶液以及醋酸甲氧苄啶的水溶液,并按不同比例混合。电纺过程中采用 +19千伏电压和1毫升/小时流速。对金黄色葡萄球菌 和 铜绿假单胞菌 进行抗菌测试,接触时间分别为4小时和8小时。壳聚糖/聚(乙烯醇)纳米纤维由于壳聚糖的抗菌作用抑制了两种微生物的生长。将醋酸甲氧苄啶引入纳米纤维后,对于 铜绿假单胞菌 在4小时后的细菌减少率显著提高,并在8小时接触时间后实现完全抑制。药物含量为40重量百分比的样品表现出更高的细菌减少效果。 金黄色葡萄球菌 似乎更具耐受性,即使在8小时接触时间后其生长也未被完全抑制。
14.3 结论
抗菌材料与静电纺丝结合的研究已取得重大进展。因此,许多不同类型的杀菌剂,如抗生素、小分子杀菌剂和纳米颗粒,已成功被嵌入到纳米纤维中。所制备的抗菌纳米纤维已被提议用于生物医学领域的医用植入物和伤口敷料,或用于过滤领域的空气和水净化过滤介质,具有强效的杀菌活性。
在过去的研究中,通常只是将杀菌剂简单地共混到聚合物溶液中再进行静电纺丝。这种方法简单且有助于将大量杀菌剂包埋到纳米纤维中。然而,当使用小分子杀菌剂时,所得材料在测试过程中会迅速释放杀菌剂,导致抗菌性能在短时间内耗尽。
在最近的几篇论文中,杀菌分子首先被嵌入到载体中,然后将药物‐载体复合物与聚合物溶液共混,再通过静电纺丝技术转化为纳米纤维。该策略通常可制备出长效抗菌纳米纤维,同时不影响整体的杀菌性能。本章已综述了一些实例,但该技术在未来仍有待进一步发展。
尽管这些进展显著,但在抗菌纳米纤维的实际应用中仍需解决若干问题。
第一个问题是抗菌纳米纤维的生产率。最近大多数关于抗菌纳米纤维的研究仍采用实验室规模装置生产小型膜(通常仅为几百平方厘米)。该生产过程尚未在大规模生产系统上得到验证。即使所引入的分子或纳米颗粒在实验室规模下并未显著改变静电纺丝过程,但在大型静电纺丝设备上复制相同结果的相关信息以及所得材料的有效性方面,文献中尚未见报道。
第二个需要考虑的方面与用于评估材料性能的测试方法有关。大多数测试都是依据源自纺织品的标准方法进行的,其中最常用的是AATCC 100。然而,这些测试程序(包括接种物体积与纳米纤维重量之比、接触时间、温度、细菌种类、细菌浓度等参数)往往不同,使得不同测试之间的杀菌作用结果难以甚至无法比较。未来的研究应致力于对测试方法进行批判性比较,以了解这些程序对结果的影响。
第三,杀菌剂从纳米纤维向环境中的释放行为在很大程度上取决于条件,并且对于评估抗菌材料的应用至关重要。从这个角度来看,一些使用的方法无法恰当地模拟实际条件,例如在伤口愈合过程中。通常情况下,载杀菌剂纳米纤维在实验室受控条件下检测时表现出优异的抗菌活性。然而,应注意的是,在测试中,样品与少量细菌悬浮液接触,处于黑暗中并保持受控温度。这些条件可能与材料实际应用时的情况大相径庭,在实际应用中,材料可能会接触大量的不同体液,从而稀释甚至冲走杀菌剂,或者暴露于光照和不同温度下。迄今为止,文献中很少有研究评估杀菌纤维材料在体内减少伤口感染或过滤过程中杀灭细菌方面的抗菌特性。
最后,人们普遍认为测试是在纳米纤维制备完成后立即进行的,此时杀菌效果处于最大值。因此,迄今为止,关于载杀菌剂纳米纤维的储存以及随时间推移的效果持续时间尚未在研究中被考虑。
总之,静电纺丝在学术界引起了广泛关注,尤其是静电纺抗菌纳米纤维。然而,要将静电纺抗菌纳米纤维应用于大规模应用,仍需进一步的发展。




















 24
24

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








