第18章 智能凝胶:下一代软湿纳米机器
佐野健一、川村隆三和长田义仁∗
RIKEN Advanced Science Institute, Japan
∗Corresponding author: osadayoshi@riken.jp
我们开发了具有优异机械性能和极低摩擦性能的水溶胀型水凝胶。这些凝胶在电刺激下表现出运动性,可用作人工肌肉。此外,还开发了具有导电功能和可调谐光子晶体的新功能凝胶。同时将介绍由蛋白质凝胶制成的三磷酸腺苷(ATP)驱动生物机器。
1. 引言
人造机器与生物动力系统在两个方面存在差异:一是结构材料,二是能源。人造系统主要由坚硬干燥的材料构成,而生物系统则由柔软湿润的分子组分构成。在生物系统中,肌肉变形是通过三磷酸腺苷(ATP)将化学能直接转化为机械能实现的;而在人造机器中,运动是由电能或热能驱动的组成部分相对位移的直接结果。
为了创建仿生运动系统,我们采用了聚合物凝胶,并通过整合分子水平上的变形赋予其运动能力。除了这些驱动装置外,我们还开发了具有极强机械性能的软湿凝胶(双网络凝胶)、导电凝胶以及表面摩擦极低的水凝胶。我们开发出一种新型制造方法,可将纳米图案化金属点转录到高度吸水膨胀的水凝胶上。这是一种新型的可调谐光子晶体,利用该晶体,已以纳米级精度和毫秒间隔对水凝胶的in situ化学‐机械变形过程进行了研究。
我们还在此报道了由细胞骨架蛋白——肌动蛋白‐肌球蛋白和微管(MT)‐驱动蛋白——重构的ATP驱动的凝胶机器。这些化学交联的蛋白质凝胶通过与三磷酸腺苷水解相偶联,在固定化马达蛋白上移动(纳米生物机器)。值得注意的是,这些人工生物机器的运动速度和输出功率(能量)均远高于天然蛋白质。这意味着共价结合的蛋白质凝胶能够在线状组分网络之间实现同步、协作和整合的涌现功能。
2. 柔软湿润的人工肌肉
近年来,科学家们一直致力于模仿生物动力系统。能够发生尺寸和形状可逆变化的聚合物水凝胶在这一领域引起了广泛关注。迄今为止,一些由聚合物凝胶制成的创新性软湿驱动系统已经得到开发。
聚合物水凝胶由弹性交联聚合物网络构成,水填充在网络的间隙中,从而赋予水凝胶粘弹性特性。水凝胶的一个特定特性是其溶胀状态可通过环境变化(如pH值、离子种类、离子浓度、温度)以及施加物理刺激(如紫外光、磁场和电势)进行调控。
这种特殊性质反过来实现了对凝胶膨胀和收缩的动态控制,并推动了凝胶作为刺激响应性物质在多种应用中的发展。磁响应致动器、温度控制的形状记忆凝胶以及药物递送系统便是这些柔软湿性凝胶器件的开创性实例。这些发挥着新型机械换能器作用的化学‐机械现象,通常伴随着离子的物理化学传输、电离状态的变化或电化学反应。相反,含有弱解离基团的水溶胀聚电解质凝胶在变形时会引发自发电离,从而产生高达数毫伏的电势(见图1)。

已研制出一种压电传感系统,可根据应力和变形的幅度点亮光电二极管阵列。由于具备类似软组织的流变特性,该系统可能成为柔软湿性触觉传感器的原型。
Gelooper, Gelf 2−3:
由于聚电解质凝胶沿聚合物链和交联点处具有较深的静电势谷,它不仅能在施加电场时发生可逆的尺寸和形状变化,还能吸引带相反电荷的表面活性剂形成凝胶‐表面活性剂复合物。这种复合作用导致凝胶的宏观收缩。利用这一现象,已研制出电驱动人工蠕虫状肌肉和能够击球的摆动摆锤。该凝胶类似鳗鱼的摆动原理与表面活性剂分子在聚合物凝胶表面发生的可逆协同复合有关,其中电场主导并控制聚电解质凝胶表面的各向异性复合。
形状记忆凝胶:
通过将亲水单体(如丙烯酸(AA))与可形成结晶结构的疏水单体(例如硬脂酰基丙烯酸酯(SA)或丙烯酰基十六烷酸(AHA))共聚,获得了具有分子有序结构的吸水溶胀聚合物水凝胶。聚(SA‐co‐AA)凝胶在温度变化时表现出形状记忆行为:当凝胶加热至(晶态‐玻璃态)转变温度以上时,它变得柔软并可自由变形;当凝胶冷却至转变温度以下时,它变为刚性,并在去除负载后仍保持其新形状(写入)。当改性凝胶再次加热至转变温度以上时,几秒钟内即可恢复原始形状(擦除)。
化学马达:
交联的聚(SA‐co‐AA)凝胶在有机溶剂中溶胀后,置于水面时会发生自发旋转。该凝胶在有机溶剂中高度溶胀,无法维持结晶结构,但当其被放置在水面上时,会从外表面迅速形成部分有序结构,并逐渐收缩,同时产生高渗透压和静水压。凭借这两种压力,有机溶剂被长时间从凝胶中泵出。例如,一个尺寸为10毫米、在乙醇或四氢呋喃中溶胀的方形聚(SA‐co‐AA)凝胶,以最高转速400转/分钟旋转长达小时。直径数百 µm的凝胶颗粒可以以超过3,000转/分的速度旋转。
凝胶运动的驱动力源于有机溶剂的表面扩散,换句话说,来源于化学势的变化。
3. 具有极低摩擦的高强度水凝胶
水凝胶在实际应用于工业领域之前,需要克服若干严重的科学和技术问题(见图2)。第一个问题是其机械强度不足。水凝胶通常通过乙烯基单体与可交联单体的自由基聚合制备。然而,这些水凝胶通常很弱且脆性大,施加几kPa的小应力就容易断裂。这是阻碍水凝胶作为工业和生物医学材料广泛应用的主要原因。
然而,这一严重问题最近由Gong et al.通过将第二柔性网络引入第一刚性网络中得以解决(双网络聚合物:以下简称DN‐gel)。DN凝胶通过两步网络形成法合成:第一步形成高交联的刚性凝胶,例如聚(2‐丙烯酰胺‐2‐甲基丙烷磺酸)(PAMPS)网络;第二步形成线性或轻度交联的中性网络,如聚丙烯酰胺(PAAm)。该DN水凝胶的断裂强度可高达数十兆帕,即超过100 kgf cm⁻²。

双网络凝胶是一种新型的柔软湿润物质,含有90%的水,具有韧性和柔韧性。这种强韧的DN凝胶的原因可归因于填充了第一网络不均匀“空隙”结构的松散交联第二网络。
该第二网络通过黏性耗散或大变形有效吸收裂纹周围的弹性能量,从而阻止裂纹扩展至宏观程度。动态光散射分析表明,在第二网络的低交联密度下,除了“凝胶”模式(快速模式)外,还存在一种慢速模式,该慢速模式通过吸收弹性能量,有助于提升双网络凝胶的力学性能。
人工肌肉系统的第二个关键问题在于降低水凝胶的摩擦系数。在过去十年中,我们一直在研究各种水凝胶的滑动摩擦行为,并通过实验表明,水凝胶的摩擦行为与固体摩擦和液体润滑完全不同,Gong et al.提出了“排斥‐吸附模型”。经过系统的实验研究,Kaneko et al.证明了在水凝胶表面引入聚电解质刷可显著降低滑动摩擦系数,最低可达 10⁻⁴。因此,我们开发出新型水凝胶材料,其断裂强度高达9兆帕,摩擦系数低至 10⁻⁵。这种兼具高强度和低表面摩擦的柔软湿润凝胶材料,有望在生物医学领域作为“零 µ技术”广泛应用,例如用作关节软骨、生物组织及其他替代材料。
4. 导电水凝胶
凝胶的下一个问题是其缺乏电导性。尽管一些离子聚合物凝胶根据电离度的不同可具有高达 ∼10⁻⁵−10⁻³ s/cm的离子电导率,但由于缺少具有高迁移率的电子载流子,它们无法在高于 10²赫兹的频率下响应。聚合物水凝胶在低电压下无法快速响应,而当电压升高时,会发生水分解并产生氢气和氧气。为了获得在低电场下具有大而快速变形的水凝胶,需要进行合成。
需要具有导电性能的水凝胶。此外,它们还应具备优异的机械性能,柔韧且可拉伸。这类凝胶的合成技术难点如下:聚吡咯和聚噻吩等导电聚合物通常不溶于水及大多数有机溶剂;此外,这些导电聚合物由刚性p‐共轭芳香族和高密度网络结构组成,表现出脆性。这些特性严重抑制了柔软和延展性变形,因其变形程度通常小于原始尺寸的10%,远低于溶胀水凝胶的变形能力。
为了克服这些技术难题,我们基于双网络凝胶开发了具有高机械强度和导电性的导电水凝胶。由于双网络凝胶本身不具备电荷载体,因此通过在由离子型PAMPS和中性PAAm网络组成的双网络凝胶基质中聚合3,4‐乙烯二氧噻吩(EDOT),引入聚噻吩衍生物作为第三种聚合物组分(见图3)。

因此获得的“导电双网络水凝胶”(E‐DN‐gels)不仅能够像传统水凝胶一样通过溶剂组成或离子强度引起较大的体积变化,还可以在电场作用下作为电驱动致动器表现出形状变化。据作者所知,这是首次报道具有高含水量、可拉伸性,并兼具优异的机械性能(溶胀状态下的弹性模量为3MPa)、离子电导率(0.8 s/cm)和电子电导率(溶胀状态下0.6 s/cm,干燥状态下0.8 s/cm)的水凝胶。E‐DN‐gels的一个有趣特性在于其电子电导率可通过变形进行调控,即对凝胶施加按压或拉伸会因双网络基质中聚(EDOT)区域之间的接触增加而使电导率提高。
5. 可调谐光子晶体
长期以来,科学家们一直苦于缺乏一种合适的技术来监测凝胶中发生的理化过程,并实现对化学机械行为进行精确的原位时间过程测量。如果一种新颖的实验方法能够检测到纳米尺度下形状变化的动力学过程,这将有望开辟新前景,帮助理解凝胶中离子所发生的理化行为,并最终推动面向基于离子的生物传感装置的纳米尺度凝胶科学的发展。关键难点在于制造用于感知凝胶内过程的金属图案。
由于水凝胶的重量中通常含有数百甚至数千倍的水,且是一种具有显著波动特性的高度动态物质,因此使用传统制造技术来制备纳米图案器件极为困难。
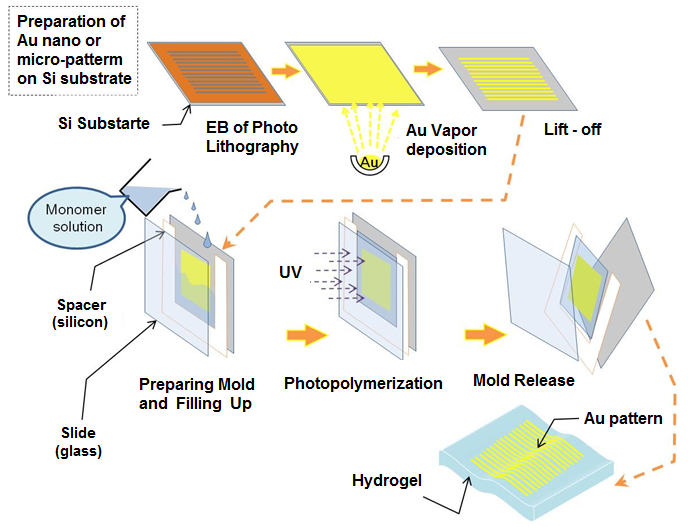
我们最近开发出一种新型制造方法,该方法涉及将纳米图案化金属点转录到高度水溶胀的水凝胶上(见图4)。
 在聚丙烯酸上制备金薄膜图案的过程示意图;(b) 实物图像;(c) 金 2 µm方点阵列的光学显微镜图像和扫描电子显微镜图像;(d) 金 4 µm线图案的光学显微镜图像)
在聚丙烯酸上制备金薄膜图案的过程示意图;(b) 实物图像;(c) 金 2 µm方点阵列的光学显微镜图像和扫描电子显微镜图像;(d) 金 4 µm线图案的光学显微镜图像)
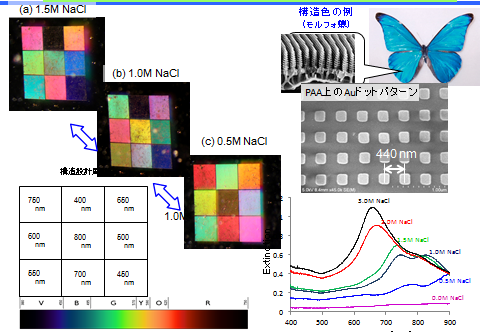
尽管凝胶经历了广泛且反复的溶胀和收缩,所转录的纳米点仍表现出优异的粘附强度。通过使用凝胶上的纳米点图案,水凝胶的化学‐机械收缩和膨胀过程首次以纳米级精度和毫秒间隔得到了研究(见图5)。与典型的布拉格反射器不同,所述纳米点图案化凝胶由单层金点阵列构成,并能根据凝胶的形状和尺寸敏感地改变其衍射图案。

金属点阵列因其几何共振与金属点中局域表面等离激元共振激发之间的相互作用,可充当高效纳米天线,作为等离激元材料受到了广泛关注。已提出多种应用,包括纳米尺度能量传输传感、调控自发辐射和光捕获。我们发现,所制备的纳米点图案化凝胶呈现出鲜艳的虹彩,并具有可通过调节纳米点间距以及含水量和盐浓度来调控的光谱响应(见图6)。这是一种由柔软湿润物质构成的新型可调谐光子晶体。该在水凝胶上制备纳米点的技术可能为利用柔软湿润物质的纳米科学开辟新前景,从而推动基于离子的新一代生物相关器件的发展,包括光开关和生物医学传感应用。
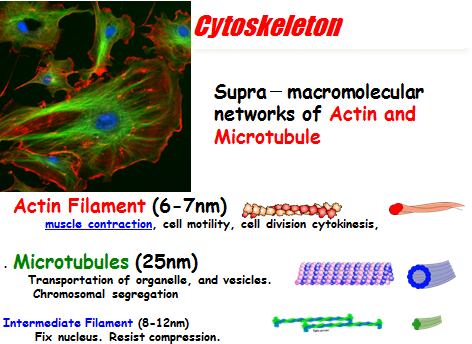
6. 多尺度层级生物凝胶
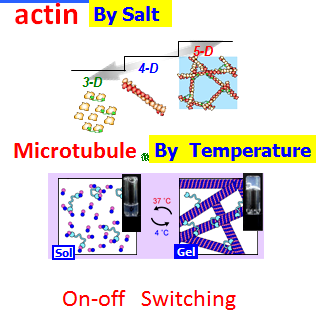
由化学能转化为机械能驱动的生物马达比人造机器效率更高。如今,迫切需要在体外开发出如此高效的仿生马达系统。然而,最大的困难在于如何整合组成部件的复杂功能,以达到自然界生命系统那样高的效能。基于主动和被动的自组织原理以及化学交联过程,已证明可以将运动蛋白系统的功能进行整合,形成能够作为执行器工作的复杂层级结构。ATP驱动的新型生物凝胶机器已从细胞骨架蛋白凝胶中重建:肌动蛋白‐肌球蛋白和微管‐驱动蛋白被提出作为生物动力系统的基本单元,以及能够提供机械功的最小机器(见图7)。
我们发现,化学交联的肌动蛋白凝胶丝(其长度是天然肌动蛋白丝(F‐肌动蛋白)的数十倍)能够在化学交联的肌球蛋白纤维凝胶(长1厘米,宽50毫米)上通过与ATP水解相偶联而运动(纳米生物机器)。在非定向肌球蛋白凝胶上的平均速度为0.69 µm/s,而在定向肌球蛋白凝胶上的平均速度为0.83 µm/s,均超过了天然 F‐肌动蛋白的运动速度。因此,尽管肌动蛋白凝胶的质量增加(体积为天然F‐肌动蛋白的数十至数百倍)且ATP水解的有效表面积减少,它们在共价交联的肌球蛋白凝胶上仍表现出更高的运动速度。
这一点相当令人惊讶,因为肌球蛋白凝胶与肌动蛋白凝胶之间的相互作用只能发生在二维界面上,并且由于交联的存在,大量肌动蛋白和肌球蛋白分子并未参与滑动运动。这意味着自组装且共价结合的肌动蛋白和肌球蛋白能够协同作用,实现对ATP水解的高运动耦合。所述的肌肉蛋白凝胶可能是首个由三磷酸腺苷驱动的人造机器。
我们还表明,与未交联的微管网络相比,化学交联的丝状微管网络在固定有驱动蛋白的表面上表现出增强且持久的运动性。需要注意的是,尽管微管具有高阶分子结构,但它们是随机交联的,并未对网络的极性进行特定控制(见图8)。
因此,微管网络成功地以最高达1.5 µm/s的速度或在1000秒内移动数十余微米的距离传输了其表面放置的二氧化硅微珠(见图9)。微管网络增强的速度归因于微管网络中产生并储存的弹性力,该弹性力随后在时间和空间上释放,从而加速微管网络上的微珠(力化学效应)。在这两种情况下,蛋白质的特征在于能够通过自组织形成高度有序的分子结构,进而形成三维凝胶,且不发生变性,即保持其三级结构甚至聚集的四级结构。
从这一角度来看,此处所示的生物聚合物凝胶可归类为具有运动功能的高度分层的超大分子凝胶(HHSMG)。需要强调的是,高度分层的结构是展现涌现功能的根源。因此,作为生物体关键且基本功能之一的“运动性”,能够成功地与合成大分子相对简单的“化学”过程相关联。
7. 结论
介绍了一些具有多种仿生功能的合成聚合物凝胶,包括一种新型可调谐光子晶体。在第二部分中,介绍了由细胞骨架蛋白重构的 ATP驱动的凝胶机器,包括肌动蛋白‐肌球蛋白和微管驱动蛋白。需要注意的是,这些共价结合的蛋白质凝胶能够发挥同步、协作的涌现功能,并在组分网络纤维之间进行整合。这可能开启柔软湿润的功能性仿生材料的新时代。





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








