本文内容速览:
说起转座子大家会不会觉得有些抽象,本质上是基因,但是它的名字又不叫“基因”,偏偏叫“转座子”。当不熟悉它的朋友与它初次碰面时,不深入了解的话,会被它的名字搞得晕头转向。但在深入了解后,就会发现,这是“本性”使然,正如其名,接下来,就让我们一起走进转座子吧。
转座子的发现
美国遗传学家芭芭拉·麦克林托克(Barbara McClintock)在20世纪40年代通过对玉米的研究发现了转座子,这一发现彻底改变了人们对基因稳定性的传统认知。她在冷泉港实验室工作期间,观察到玉米籽粒颜色的遗传是不稳定的,发现某些基因可以从一条染色体上跳到另一条染色体上。她将这种现象归因于两个关键的基因位点:Ds(Dissociation,解离子)和Ac(Activator,激活子),提出了转座子这一概念。这一开创性的发现为她赢得了1983年的诺贝尔生理学或医学奖。

图1 1947年3月26日,芭芭拉·麦克林托克在纽约冷泉港实验室(图片引自Britannica)。
转座子的分类及作用机制
转座子(Transposable Element,TE)的本质是一类能够在基因组中从一个位置移动到另一个位置的DNA序列,因此也被称为“跳跃基因”,通过这种移动和跳跃,来完成对基因的影响。
根据转座过程中对酶的依赖性不同,转座子可以被分成两种类型:自主活性转座子和非自主活性转座子。自主活性转座子能够独立完成转座过程,因为它们自身编码转座酶(Transposase),这种酶能够识别转座子末端的反向重复序列(TIR),并将其从基因组中切割并插入到新的位置。非自主活性转座子不能独立完成转座过程,因为它们缺乏编码转座酶的能力,需要依赖同一家族中的自主活性转座子提供转座酶来完成转座。
在另一种分类标准下,根据转座方式的不同,转座子又可以被分成I型转座子(Class I element),II型转座子(Class II element)以及Helitron转座子。
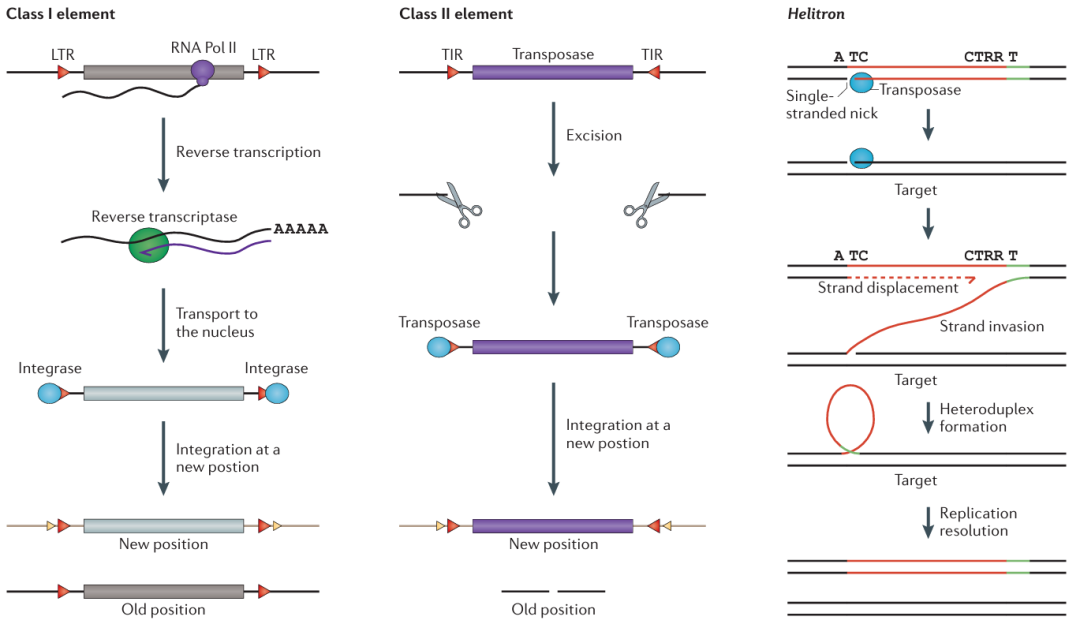
图2 转座子的类型(Lisch 2013)。
I型转座子又被称为是逆转录转座子或者是反转座子,这类转座子通过“复制-粘贴”的机制进行移动。反转座子在转座的时候,会先以DNA为模板,在RNA聚合酶II的作用下,转录成mRNA,然后再以这段mRNA为模板反转录成cDNA,最后在整合酶的作用下将这段cDNA整合到基因组的新位置。植物中常见的I型转座子,如水稻Tos17、RIRE7转座子、小麦BARE-1、OARE-1和Ttd1a转座子、烟草Tnt1、Tto1转座子等等。
II型转座子又被称为是DNA转座子,这类转座子通过“剪切-粘贴”的机制进行移动,在转座酶的催化下,II型转座子从原位置脱离,随后插入到染色体的新位点。原位置因转座子脱离而产生的DNA断裂,会通过DNA的修复机制进行修复。最终,原位置缺失了转座子序列,而新位置则增加了这段序列。
植物中常见的II型转座子有很多,在本文开头芭芭拉·麦克林托克发现的玉米中的Ac-Ds转座子就是II型转座子,其中Ac是自主转座子,能够编码转座酶,Ds是非自主转座子,依赖Ac提供的转座酶进行转座。对这一转座子作用机制的揭示也很好的解释了为什么玉米籽粒会出现不同的颜色。
如图3所示,在Ac(自主转座子)不存在的情况下,Ds(非自主转座子)无法移动,因此无法影响到调控籽粒颜色的基因。而紫色基因(c+)相对于无色基因(c)为显性,因此图3A中的杂合体表型为紫色。当Ac存在时,Ds被激活,其可以插入到c+基因中,如果此时Ds的插入导致了染色体的断裂,那么在子代中c+基因功能的丧失就是不可逆的,最终形成了黄色的籽粒(图3B)。当Ds的插入没有导致染色体的断裂,那么子代中Ds还可以再通过Ac被移动出c+,导致部分细胞中c+功能正常,部分细胞中c+功能丧失,出现斑点色的籽粒(图3C)。
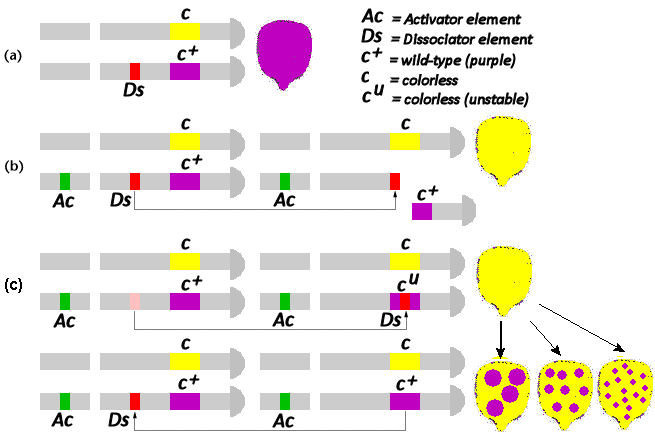
图3 玉米Ac/Ds转座子对玉米籽粒胚乳颜色的影响(百度百科)。
来源细菌中的II型转座子-Tn5转座子,因其高效、灵活、多功能的特点,经常被应用于生物行业的各个领域中。Tn5转座子由编码三个抗性基因的核心序列(kan、ble、str)和两条倒置的IS50序列组成,其中IS50R和IS50L的序列高度同源(图4A),含有编码转座酶(TnP)以及转座阻遏蛋白(lnh)的基因,但IS50L的一个碱基存在突变导致翻译提前终止,因此只有IS50R可以产生正常的有活性的TnP和lnh。IS50具有19bp的倒置末端(外末端OE和内末端IE),两倒置末端有7个碱基不同(如图4C中加粗碱基),此倒置末端是转座酶(Tnp)的作用位点,其中IE只有在没有Dam-DNA甲基化的情况下才可被Tnp识别。ME是IE和OE的嵌合体,OE和IE均为次优序列,而ME是超活性序列(图4C)。
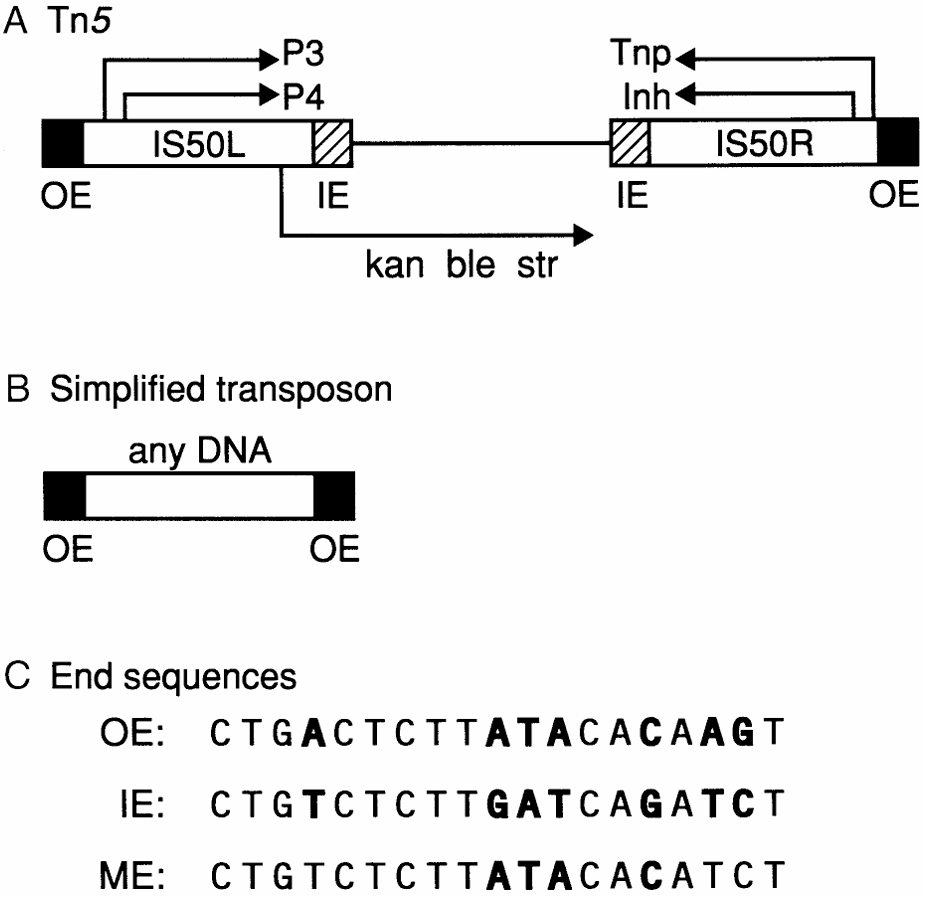
图4 Tn5转座子结构(Reznikoff 2003)。
研究表明Tn5整个转座子序列并不是转座必须的,只需转座子的末端核心序列(OE/IE/ME),转座酶便能将该部分序列插入并连接至基因组内(图5)。
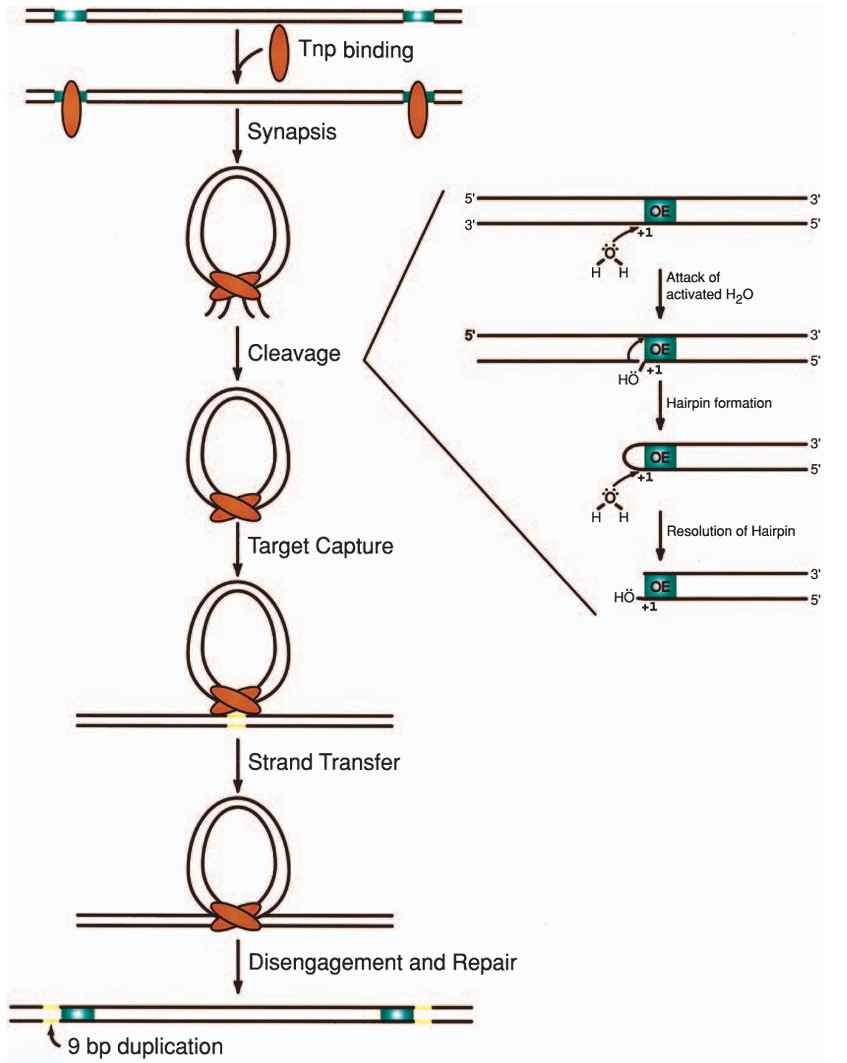
图5 Tn5转座机制(Reznikoff 2003)。
Helitron转座子是近年来发现的一种新型DNA转座子,最初是基于重复序列的计算方法在拟南芥基因组中鉴定出来的。后来发现,大多数植物和许多动物基因组中都携带Helitron转座子。Helitron转座子具有典型的5' TC以及3' CTRR(R为A或G)末端,并在3'末端上游约15~20bp处有一个茎环结构,是转座子的终止信号。Helitron转座子转座后,通常插入AT-rich区域的AT靶位点。与I型转座子和II型转座子不同,Helitron通过滚环(rolling circle)的方式进行转座,依赖解旋酶和核酸酶。并且,在滚环复制的转座过程中经常捕获和携带基因片段,可导致基因拷贝数的变化,也会在一定程度上促进基因组的进化。
转座子与育种
转座子作为基因组中的“跳跃基因”,在育种中发挥着重要作用。它们通过插入、删除或重排基因序列,能够产生新的遗传变异,为作物改良提供丰富的材料。小麦基因组中含有A、B、D三个亚基因组,含有大量的转座子序列,基因组中存在大量由于转座子插入、表观修饰等原因所导致的功能基因失活,成为隐匿或沉默的基因,通过现代基因工程手段人工重新激活这类隐匿的基因,使其发挥功能,将会极大丰富小麦基因资源库,对于培育高产多抗优质广适新品种具有重要意义。
小麦白粉病是由小麦禾布氏白粉菌(Blumeria graminis f. sp. Tritici,Bgt)引起的一种真菌性病害,严重影响小麦的生产。品种抗性的丧失促使人们继续寻找新的抗病来源。野生二粒小麦(Triticum turgidum ssp. dicoccoides,WEW)是现代四倍体和六倍体小麦的祖先,含有许多白粉病抗性基因。
2020年5月,中国科学院遗传与发育生物学研究所刘志勇课题组联合中国农业科学院作物科学研究所李洪杰课题组在New Phytologist杂志上发表了一篇题为“A CNL protein in wild emmer wheat confers powdery mildew resistance”的研究论文,该研究挖掘了一个来自WEW的白粉病抗性基因Pm41,并对其进行了功能验证,证实了Pm41在小麦中抗Bgt的功能。
2022年8月,中国科学院遗传与发育生物学研究所刘志勇课题组联合赵玉胜课题组在Plant Biotechnology Journal杂志上发表了一篇题为“Provoking a silent R gene in wheat genome confers resistance to powdery mildew”的研究论文,该研究在前期从野生二粒小麦中克隆到抗白粉病基因Pm41的基础上,对该基因在小麦野生和栽培种质资源中的单倍型变异进行了深入分析,发现Pm41位点在野生二粒小麦群体中包含多种单倍型(Hap1-Hap7)(图6A),而在硬粒小麦和普通小麦中只存在3种单倍型Hap2(Pm41b,90%)、Hap3(Null,3-5%)和Hap7(5-7%)(图6B),显示该位点在小麦进化和驯化过程中存在非常明显的遗传瓶颈。基因序列和表达分析发现,单倍型Hap2和单倍型Hap4-Hap7在启动子和3'UTR区均存在转座子插入(图6C),导致基因沉默不表达,但均具有完整的潜在编码框。
研究团队以硬粒小麦和普通小麦中都占绝对优势比例的单倍型Hap2(Pm41b)为目标,设计构建了两个重组载体,分别是由玉米Ubiquitin强启动子驱动的Pm41b基因CDS和由Pm41a启动子驱动的Pm41b基因组序列,通过农杆菌介导的小麦稳定遗传转化分别获得了稳定的纯合转基因株系,发现其对小麦白粉病表现出免疫或高抗,表明重新激活沉默的Pm41b基因可以赋予其抗白粉病功能。此外,也未发现激活Pm41b基因对小麦主要农艺性状和产量有不良影响(图6G-J)。
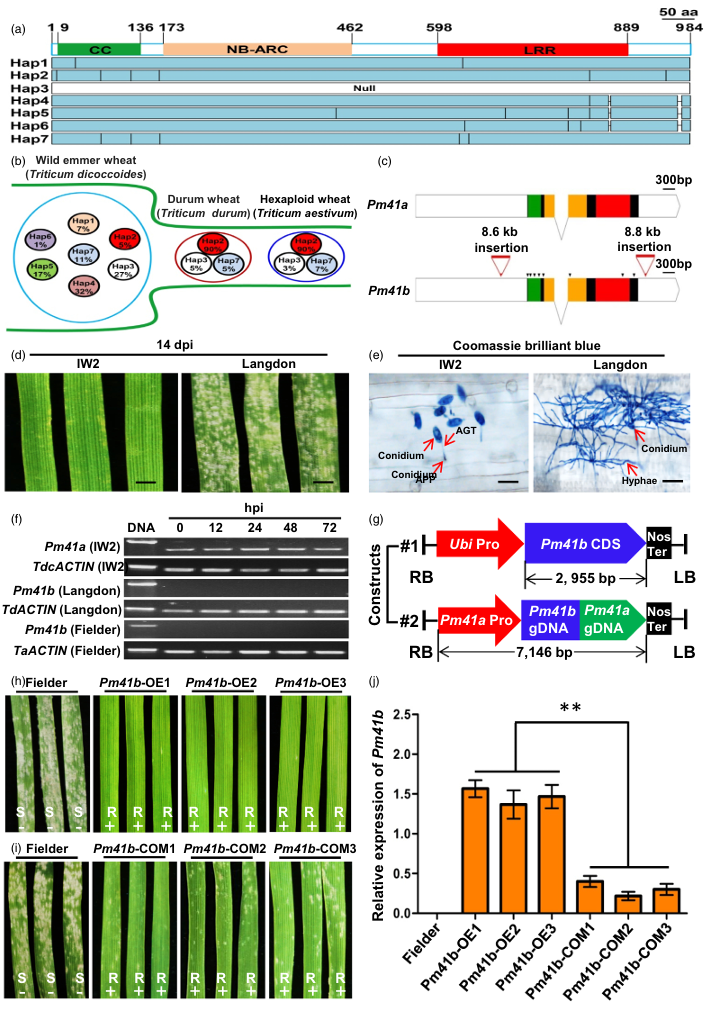
图6 激发沉默的Pm41b基因,赋予小麦白粉病抗性(Li et al.,2022)。(A)Pm41等位基因的单倍型分析;(B)野生二粒小麦Pm41等位基因的遗传瓶颈现象,从野生二粒小麦到硬粒小麦和普通小麦的传递过程中表现明显;(C)Pm41a和Pm41b的基因结构和变异;(D)在接种白粉病菌(Bgt)分离株E09后的第14天,对野生二粒小麦品种‘IW2’和硬粒小麦品种‘Langdon’的两叶期叶片进行观察;(E)考马斯亮蓝染色后的小麦白粉菌(Bgt)分离株E09的菌丝结构,在接种后5天(5 dpi)的观察结果;(F)在小麦品种“IW2”、“Langdon”和“Fielder”中对Pm41a和Pm41b基因进行的RT-PCR分析;(G)用于转化易感白粉病小麦品种“Fielder”的ProUbi : Pm41b和ProPm41a : Pm41b的示意图;(H-I)ProUbi : Pm41b和ProPm41a : Pm41b的T1代转基因植株感染反应;(J)ProUbi : Pm41b和ProPm41a : Pm41b的T2转基因植株中Pm41b的转录水平。
转座子与进化
转座子的活跃性与物种的适应性密切相关,它们不仅为生物进化提供了丰富的遗传材料,还在物种的适应性进化中扮演了关键角色,是基因组进化的驱动力之一,也是生物多样性和复杂性的重要来源。
2023年11月,中国科学院植物研究所郭亚龙课题组在The Plant Cell杂志上发表了一篇题为“Forces driving transposable element load variation during Arabidopsis range expansion”的研究论文。该研究利用全球广布的模式物种拟南芥的自然群体材料,综合运用群体遗传学和数量遗传学等多学科的交叉研究手段,解析了生境扩张过程中转座子负荷变异的模式和规律。感兴趣的小伙伴可以自行下载文章进行阅读,小远在此就不再过多的叙述了。
转座子与果实表皮颜色
玉米籽粒颜色变化的背后是转座子,其实类推一下,一些瓜果果皮的颜色图案变化也可能是转座子在操纵。果实的外观品质还是决定其市场接受度和经济价值的关键因素。
甜瓜(Cucumis melo L.)作为葫芦科甜瓜属的重要作物,其果实的外观特征尤其是果皮的颜色和图案,是消费者选择的主要依据之一。在自然界中,甜瓜的果皮表现出丰富的颜色和图案变异,这些变异不仅具有极高的观赏价值,而且为研究植物色素调控机制提供了天然的实验模型。
2024年1月,北京市农业科学院许勇课题组联合中国农业大学沈火林课题组在The plant journal杂志上发表了一篇题为“Recurrent excision of a hAT-like transposable element in CmAPRR2 leads to the “shooting star” melon phenotype”的研究论文。该研究揭示了甜瓜中由CmAPRR2中的hAT-like转座子反复跳跃介导的甜瓜表皮流星形状的形成。
团队在育种过程中,发现了一种名为“流星”(Shooting Star,SS)的甜瓜,它具有特殊的瓜皮外观,表皮镶嵌墨绿色斑纹,类似流星划过天际,而且这一类型甜瓜品质优良,肉质软糯香甜,但是高世代自交系每个瓜的墨绿色斑纹不规则、大小不一,斑纹数量随机,且出现少量纯墨绿皮色分离,影响品种的商业化开发,于是研究团队开始对这表型形成的背后的分子机制开展探究。
该研究首先通过电镜观测叶绿体发现,流星斑纹的形成主要由叶绿素的积累所致。并基于高世代群体表型分析,明确该“流星”表型是受单一基因调控,进一步采用BSA-Seq等正向遗传技术方法,挖掘到控制流星瓜斑纹的候选基因为叶绿素调控转录因子CmAPRR2基因(图7),该基因据前人报道是一个控制墨绿皮色基因。
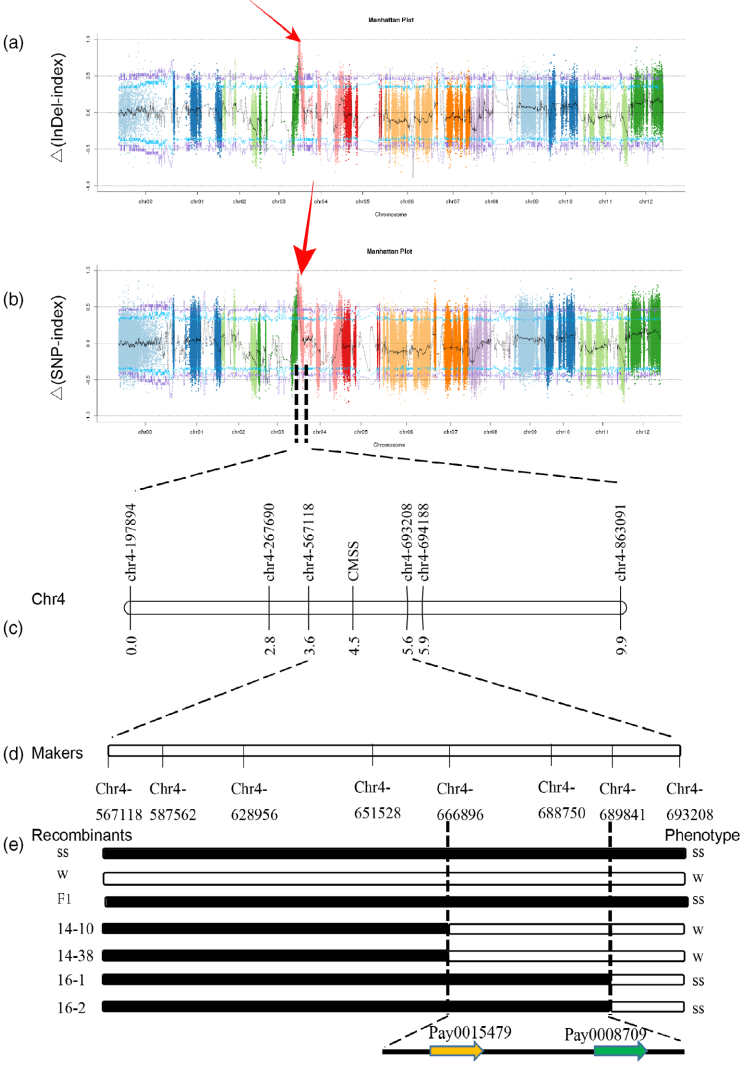
图7 BSA-Seq和Fine映射发现的CMAPRR2(PAY0008709)是流星瓜的候选基因(Zhang et al., 2024)。
对流星瓜(SS)CmAPRR2基因序列分析发现,该基因上插入了一个3526bp的片段。序列比对分析发现,CmAPRR2(SS)基因中的插入序列具有10bp的末端反向重复序列(TIR)与hAT DNA转座子高度相似。该插入序列包含三个功能域:N端ZnF-BED、DUF4413和C端Dimer-Tnp-hAT,这些都是hAT转座酶的特征,作者将其命名为Tcm1(Transposon Element of Cucumis melo)。
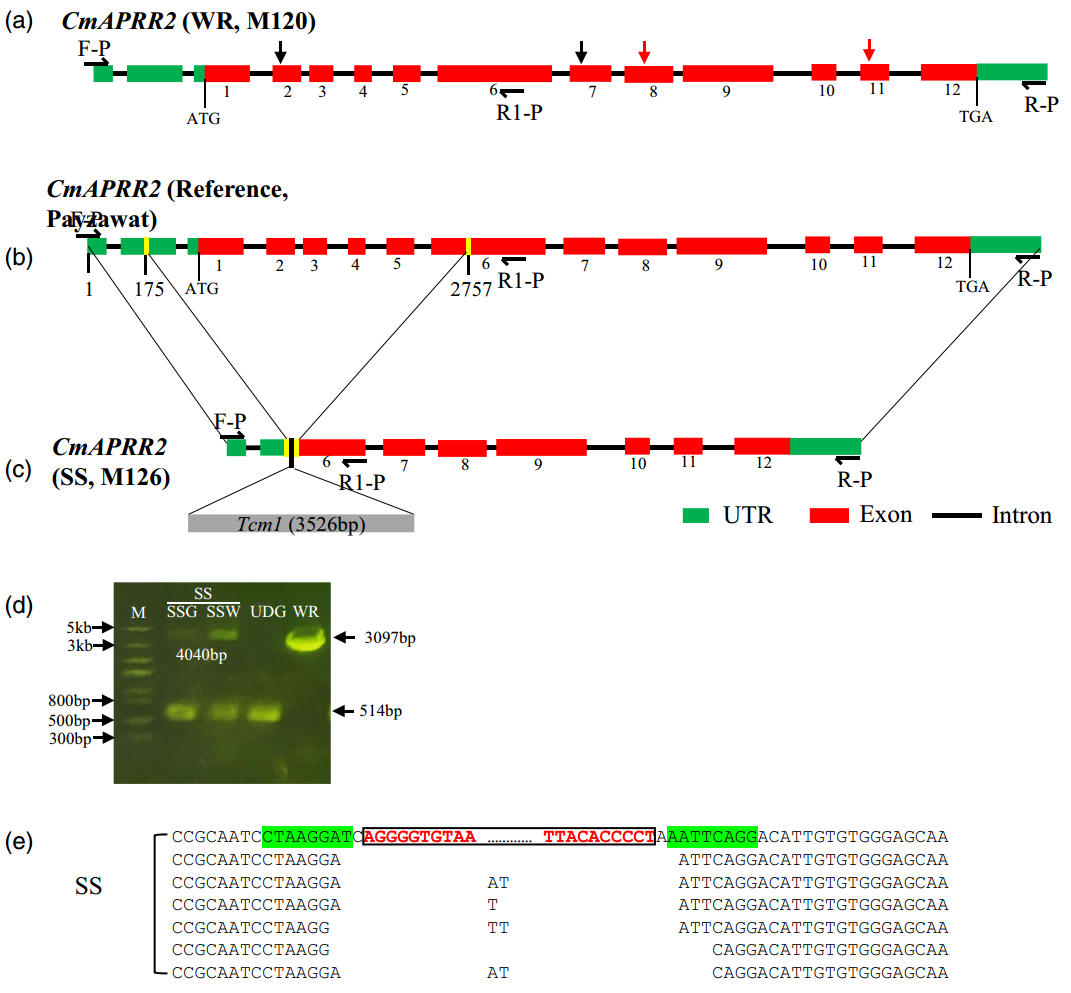
图8 CmAPRR2基因的结构(Zhang et al., 2024)。(A-D)CmAPRR2基因的结构在WR(A)、Payzawat参考基因组(B)和SS(C)中的情况,以及亲本系SS和WR的基因组PCR结果(D),黑色箭头表示同义SNPs,红色箭头表示导致提前终止的非同义SNPs;(E)SS中CmAPRR2插入的足迹分析,最上方的CmAPRR2序列是未发生切除的标准序列,黑色框中红色高亮的序列是hAT-like转座子的末端反向重复序列(TIR),绿色高亮的序列是可能的目标位点重复序列(TSD)。
进一步研究推测,流星瓜分离后代中流星瓜的白皮部分(SSW)是由Tcm1转座子的存在抑制CmAPRR2的表达,从而阻碍瓜皮中叶绿素的积累,形成了纯白色表皮;而流星瓜中斑纹(SSG)的形成是由于Tcm1转座子剪切跳出留下不规律残基,部分激活了CmAPRR2基因的表达,促进叶绿素的积累,进而形成了墨绿色斑纹;分离出的少量纯墨绿皮色,是Tcm1转座子全部跳出和留下的恒定残基,更强激活了CmAPRR2基因的表达,促进叶绿素的积累进而形成了全部墨绿色瓜皮转座子的发现在当时无疑是一个颠覆认知的存在,它挑战了人们对基因稳定性和遗传规律的固有理解。芭芭拉·麦克林托克在面对科学界的质疑和忽视时,始终坚守自己的研究,用扎实的实验数据和独到的洞察力证明了“跳跃基因”的存在。她的经历告诉我们,科学的进步往往需要冲破传统思维的束缚,勇敢探索未知的领域。正如麦克林托克在晚年所说:“如果你知道自己走在正确的道路上,并且内心坚定,那么无论别人说什么,都无法动摇你。”愿每一位在追求真理道路上的人,都能像她一样,坚守自我,勇敢前行,用科学的光芒照亮未知的黑暗。
References:
Reznikoff W S. Tn5 as a model for understanding DNA transposition[J]. Molecular microbiology, 2003, 47(5): 1199-1206.
Li M, Dong L, Zhu K, et al. Provoking a silent R gene in wheat genome confers resistance to powdery mildew[J]. Plant Biotechnology Journal, 2022, 20(11): 2039-2041.
Zhang W, Liao S, Zhang J, et al. Recurrent excision of a hAT‐like transposable element in CmAPRR2 leads to the “shooting star” melon phenotype[J]. The Plant Journal, 2024, 120(3): 1206-1220.
Jiang J, Xu Y C, Zhang Z Q, et al. Forces driving transposable element load variation during Arabidopsis range expansion[J]. The Plant Cell, 2024, 36(4): 840-862.
Lisch D. How important are transposons for plant evolution?[J]. Nature Reviews Genetics, 2013, 14(1): 49-61.




















 3370
3370

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








