本文内容速览:

当前,利用杂种优势是现代种业市场的主要手段。主粮作物、蔬菜的杂交种凭借显著的增产优势、突出的抗逆性能和品质提升特性,占据了巨大的市场份额。然而,这种优势主要依赖于种内或亲缘极近种间的有性杂交制种。对于亲缘关系较远的物种,由于生殖隔离的存在,很难挖掘更为丰富的杂种优势。之前小远给大家介绍过嫁接相关的内容,“嫁接之下,“新物种”能否“破茧而出”?”,大家感兴趣的也可以去看一看,但是嫁接技术无法将远缘物种的优异基因稳定遗传给后代,更无法直接用于大规模杂交制种。今天伯远生物给大家介绍另外一种技术——体细胞杂交技术,能一步到位将野生种的抗病、抗逆等“超能力”搬进栽培作物里。
1、体细胞杂交技术
植物体细胞杂交技术的基础在于获得具有再生潜力的植物原生质体。1970年,英国植物生理学家Cocking首次利用纤维素酶成功酶解番茄根细胞,分离出原生质体,为后续研究奠定了基础(Power et al., 1970)。1971年,Takebe 等人通过培养烟草叶片原生质体并成功培养出完整的再生植株,首次在实验上证实了植物原生质体的全能性(Takebe et al., 1971)。
植物体细胞杂交即原生质体融合,是在植物原生质体培养技术的基础上,借用动物细胞融合方法如聚乙二醇(PEG)化学融合法、电脉冲融合法等发展和完善的新型生物技术,包括原生质体制备、细胞融合诱导、杂种细胞筛选与培养及杂种植株再生与鉴定等技术环节。根据融合产物细胞核组分的不同,体细胞杂交可分为对称与非对称两类。
1.2 非对称体细胞杂交
非对称体细胞杂交又可以细分为自发形成的非对称性杂交和经诱导形成的非对称性杂交。自发形成的非对称性杂交主要是指远缘种属之间的诱导融合后由于离体培养过程中发生了两个亲本或一个亲本基因组部分丢失而形成不对称的组合。诱导形成的非对称性杂交主要指远缘的种属之间要得到有用的细胞杂种植株就必须使融合产物的细胞核基因组发生高度的不对称性,也就是使供体(携带目标性状基因,如抗病、耐盐等)的少量基因组组分导入或整合到受体(通常是需要改良的栽培品种)基因组去。通常会在杂交前对供体原生质体人为地施加诱导剂如X射线、C射线、紫外线、碘乙酰胺(IOA)、R6G-罗丹明6G等,诱导供体细胞核遗传物质发生选择性失活或断裂,从而促进融合后杂种细胞中受体(通常是具有完整基因组的亲本)染色体的稳定性和优势,实现不对称杂交或部分基因组转移。
非对称体细胞杂交常产生非对称杂种和胞质杂种。非对称杂种包含受体亲本完整的核基因组 + 供体亲本的部分核基因组(少量染色体或染色体片段),同时可能包含双亲的细胞质成分(叶绿体、线粒体),利用非对称杂种可以突破“远缘杂交伴随大量不良基因”的瓶颈,实现精准渐渗育种;胞质杂种包含受体亲本的完整核基因组 + 供体亲本的细胞质基因组(叶绿体和/或线粒体),此种杂种形式下供体核基因组完全丢失,利用胞质杂种可以解决“有性杂交中细胞质仅母系遗传”的限制,快速创建新型不育系或抗性种质。
2、体细胞杂交技术的应用
1972年,美国科学家Carlson等人利用细胞融合技术,首次实现了粉蓝烟草(Nicotiana glauca)与郎氏烟草(Nicotiana langsdorffii)两种不同烟草原生质体的融合,获得了种间体细胞杂种植株(Carlson et al, 1972)。该尝试成功以后,人们在细胞融合工作上开始了丰富的探索。
2.1 马铃薯番茄体细胞杂交
最具有代表性的案例是,1978年,德国科学家Melchers等人发表在Carlsberg Research Communications杂志上一篇题为“Somatic hybrid plants of potato and tomato regenerated from fused protopplasts”的研究论文,该研究将马铃薯和番茄的原生质体进行融合,期望得到地上结番茄,地下长土豆的马铃薯番茄(Potato-tomato),然而结果并非如预期的那样。
该研究使用聚乙二醇(PEG)和高钙离子浓度处理番茄变种cerasiforme的叶绿素突变体yellow green 6(yg6)的叶肉原生质体(绿色)和马铃薯双单倍体品系HH258的液体悬浮愈伤组织原生质体(无色)并促进其融合。融合产物可通过其一部分含绿色叶绿体(番茄来源)和另一部分无色质体(马铃薯来源)来识别(图1)。融合后的原生质体在富含营养的培养基上培养形成愈伤组织。部分愈伤组织再生出正常的绿色芽,这些绿芽被转移到土壤中或者嫁接在番茄砧木上。最终,不同杂种植株的外形偏向番茄,花、根等具有杂种的特点,但并未得到最初地上结番茄,地下长土豆的预期表型(图2)。
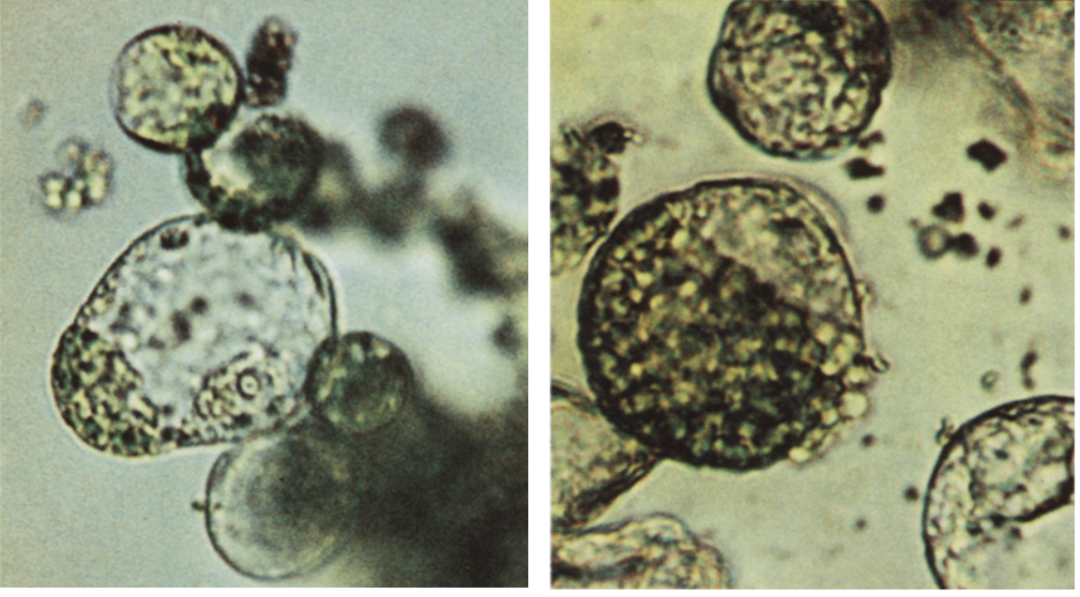
图1 由番茄和马铃薯原生质体融合产生的原生质体(Melchers et al., 1978)。

图2 马铃薯-番茄杂种花、根、株型表型(Melchers et al., 1978)。(A)花为重瓣花(可能由于染色体异常导致),花色有淡紫色和淡黄色(紫色可能来自马铃薯,黄色可能来自番茄),地下部分出现根状茎,有地下花蕾出现;(B)植株叶片富含花青素,株型更偏向于番茄。
与此同期或随后的实验中也有一些类似的组合,甚至包括更远缘的科间杂交。这些组合中得到的融合物大都不能分裂生长或仅开始分裂几次后便不再增殖,有些得到了连续增殖的细胞系,但却没有进一步的分化。实践证明,事情并非像人们想象的那样简单,远缘的体细胞杂交也受系统进化距离的限制,于是人们寻求更切合实际的杂交组合以及克服远缘杂交不亲和的方法。
目前人们较多选用近缘种内或种间以及较近缘属间的体细胞杂交组合,和远缘的体细胞杂交相比较,它具有更强的目的性。例如,茄子(Solanum melongena)和抗线虫的野生茄(Solanum sisybriifolium)经细胞融合产生抗虫的杂种植株;抗大豆花叶病毒的野大豆与栽培大豆细胞融合获优良抗病大豆株系等。这些研究表明,通过体细胞杂交将野生近缘种的有用性状导入栽培种是一条可行的育种途径。
2.2 小麦体细胞杂交
小麦野生近缘种如偃麦草、高冰草等有很多优异基因,为了更好地利用这些基因,突破小麦远缘杂交的生殖隔离限制,研究者们开发出了小麦体细胞杂交技术,通过原生质体杂交将野生近缘种(如偃麦草)的优异基因(如耐盐、抗病)精准导入栽培小麦,同步创制新型细胞质雄性不育系。
在这里不得不提的是山东大学生命科学学院夏光敏教授的一项研究,1996年,夏光敏团队在科学通报上发表了一篇题为“小麦与新麦草及高冰草属间不对称体细胞杂交的植株再生”的研究论文,该研究开创性地将紫外线用于小麦不对称体细胞杂交,相较于γ射线等诱导方式,紫外线能够引起DNA链更为广泛的断裂和缺口。
利用经紫外线照射后的新麦草、高冰草原生质体与小麦原生质体融合(图3a-b),对杂种植株进行植株形态、染色体和同工酶分析。在植株形态上,小麦(+)新麦草幼苗不均一,少数介于双亲之间(图3c),多数偏向小麦;小麦(+)高冰草植株偏向小麦(图3d)。植株根部相关染色体数目上,小麦(+)新麦草植株为40-44,含断裂染色体片段(图3e);小麦(+)高冰草植株为40-46,也同样包含断裂染色体片段(图3f)。小麦原生质体再生愈伤组织染色体数目90%以上在31-38之间。酯酶和过氧化物同工酶分析表明,融合再生植株均含有双亲谱带,有的有新带(图3g-h)。以上结果证明研究获得了小麦(+)新麦草和小麦(+)高冰草偏向小麦的不对称杂种植株。
小麦(+)新麦草和小麦(+)高冰草这两个组合的不对称杂种植株移至土中分别成活了3株和5株。这些杂种幼穗的外型均像小麦,在这些穗子的部分花中具有外形正常的1个雌蕊(具有3个羽毛状柱头)和3个雄蕊(图3i)。
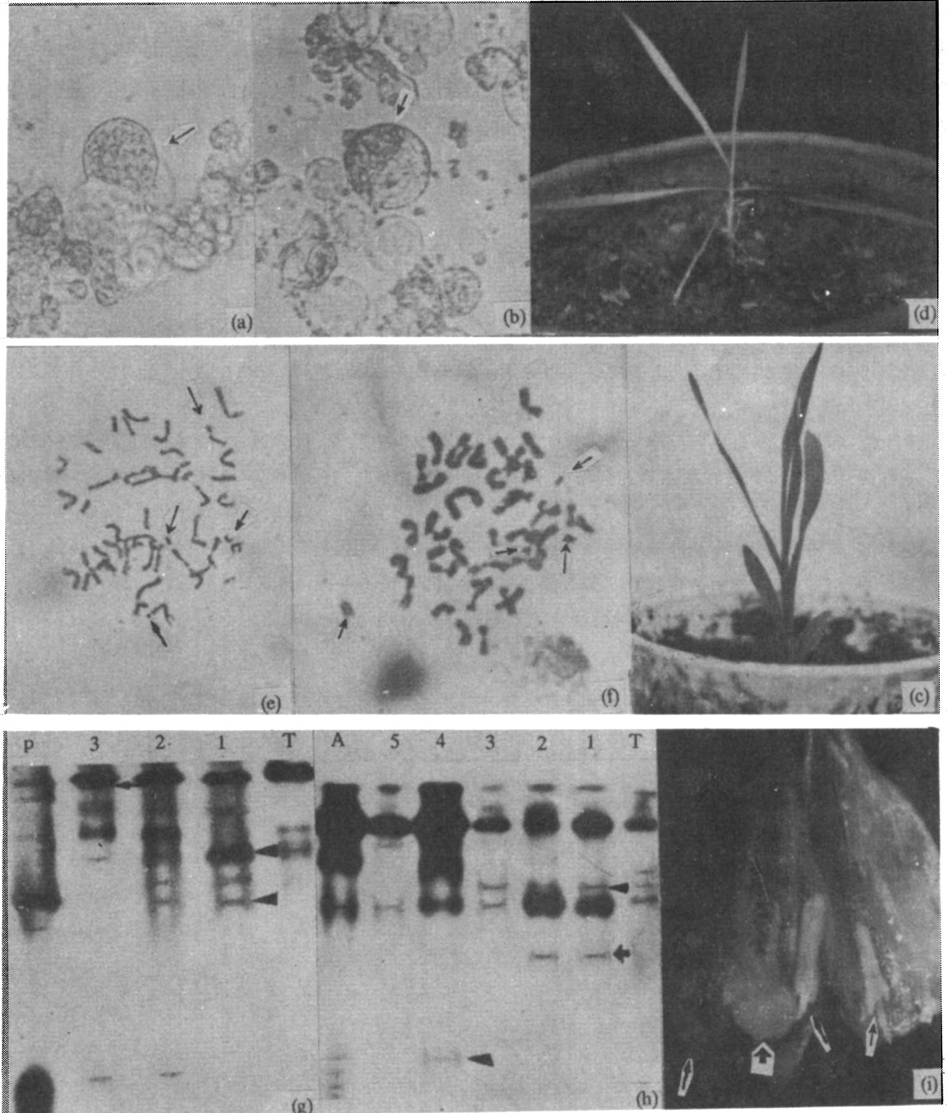
图3 小麦与新麦草及高冰草属间不对称体细胞杂交的再生植株(夏光敏等,1996)。(a)小麦与高冰草原生质体经融合处理形成的异源二聚体,↑指向高冰草原生质体;(b)↑指向小麦(+)高冰草原生质体异源融合体;(c)小麦(+)新麦草融合再生植株;(d)小麦(+)高冰草融合再生植株;(e)小麦(+)新麦草杂种3号植株根尖染色体,↑指向断裂染色体片段;(f)小麦(+)高冰草杂种2号克隆植株根尖杂色体,↑指向断裂染色体片段;(g)小麦(T),新麦草(P)及杂种1~3号植株过氧化物酶同工酶谱,▲指向特异带;(h)小麦(T),高冰草(A)及杂种1~5号克隆再生植株过氧化物酶同工酶谱,▲指向特异带,↑指向新带;(i)小麦(+)新麦草杂种植株的一朵花,↑指向具有3个柱头的雌蕊和花药。
该团队在后续的研究中利用该技术进行小麦品种选育,将长穗偃麦草的染色体小片段导入济南177,获得了转移异源染色体小片段的大量体细胞杂种新品系。其中高产、耐盐的小麦体细胞杂种新品系2004年通过山东省新品种专家委员会审定,定名山融3号。
山融3号在山东省区域试验和生产试验中表现优异,较对照品种德抗961显著增产(区域试验两年平均增产22.58%,生产试验增产7.17%),示范田单产达468.2 kg/667m²,而且抗旱性突出,适宜在山东等冬麦区旱地、旱肥地(自然肥力较高但缺乏灌溉条件、主要依靠自然降水(雨水)维持作物生长的耕地)及含盐量0.3%~0.5%的盐碱地种植(夏光敏, 2009)。山融3号的品种特性迅速得到了市场的认可,在2006年成为了山东省的主推品种,直至2018年仍然被列为盐碱地种植的推荐品种,在黄河三角洲地区广泛种植(Han et al., 2018)。
该团队目前还持续在此领域进行深耕,近十年来随着细胞遗传学工具“原位杂交”的发展,栽培型小麦与不同禾草类植物或禾谷类作物的不对称融合得到了极大的推进。利用基因克隆、基因组原位杂交(GISH)和分子标记技术,对小麦不对称杂种的遗传学、基因组、功能基因和农艺性状进行了系统地研究,以期能够阐明体细胞渐渗系基因组动态之间的功能联系。对这个方向感兴趣的小伙伴们可以自行查阅夏老师团队的相关研究成果,小远在此就不再讲述了。
2.3 柑橘体细胞杂交
世界柑橘育种可以分为4个时代,即利用自然变异时代(V1.0)、杂交产生变异时代(V2.0)、生物技术育种的细胞水平时代(V3.0)和分子水平时代(V4.0)。前两个时代是常规育种时代,后两个是实验室辅助即生物技术育种时代。在柑橘品种选育过程中,4代技术综合运用,相互结合,效率提高(邓秀新 , 2022)。柑橘体细胞杂交属于生物技术育种的细胞水平时代(V3.0)。
1992年,华中农业大学邓秀新院士在遗传学报上发表了一篇题为“原生质体融合获得柑桔种间体细胞杂种”的研究论文,该研究建立起了柑橘原生质体再生体系。研究将粗柠檬和哈姆林甜橙进行体细胞杂交,想要结合两者的优势创制出抗裂皮病、抗速衰病而且不易感火疫病的杂交种。粗柠檬原生质体与哈姆林甜橙胚性悬浮细胞系原生质体经PEG诱导融合,培养7天时原生质体恢复分裂。再生的胚状体在培养基中萌发出茎芽,经生根诱导后成为完整植株(邓秀新 , 1992)。在这一体细胞杂交技术体系建立以后,研究团队就在该领域进行了大范围的探索,创制出了 50 余例柑橘种间和属间的异源四倍体体细胞杂种。
其中以“国庆 1 号”温州蜜柑愈伤组织原生质体与“华柚 1 号”叶肉原生质体融合培养的二倍体胞质杂种植株,在2015 年 9 月获农业农村部植物新品种授权,定名为“华柚 2 号”。“华柚2号”是国际首例通过体细胞杂交技术直接培育的柑橘胞质杂种新品种(解凯东等, 2020)。

图4 无核柚新品种“华柚2号”(解凯东等, 2020)。
2.4 油菜体细胞杂交
十字花科植物菘蓝(Isatis indigotica),俗称板蓝根,在2004年前后,华中农业大学国家油菜工程中心开始利用体细胞杂交技术进行菘蓝与甘蓝型油菜的远缘杂交研究,想攻克油菜菌核病,但由于两者亲缘关系较远,没能获得预期的杂交品种,却意外培育出携带板蓝根各条不同染色体的甘蓝型油菜新材料。研究发现,这种新型材料对多种流感病毒表出显著抗性(金梅林等,2022)。
2021年12月,研究项目通过了省科技厅验收,研究成果获得国家专利局的认证。这种菜用型油菜品种被命名为“菘油1号”。该品种当前主要在云南、甘肃、湖北等地推广种植,平均亩产在800公斤至1000公斤,而且回收价格要高于普通油菜薹,农户每亩综合收益可增加约1500元,经济效益显著。

图5 板蓝根青菜“菘油1号”(From 板蓝根青菜官方号)。
体细胞杂交技术的应用还有很多,比如创制马铃薯与茄子、胡萝卜与羊角芹、甘蓝与白菜、棉花的不同品种、香蕉的不同品种等植物的体细胞杂交种,篇幅所限小远在此就不再罗列了。本篇文章主要是想向大家传达除了传统育种以及新兴的分子育种外,细胞工程育种在实际生产上也有很大的应用,大家可以在此做一个初步的了解。小远对这一技术的特点也给大家简单做一个总结。
技术优势:①克服远缘不亲和障碍,将不同亲缘关系(包括近缘和远缘)的植物基因组进行融合,以拓宽对野生基因资源的利用;②可同时转移细胞核和细胞质基因,使双亲胞质基因和核基因在杂种细胞中共存或重组,从而产生多种多样的,有性杂交无法实现的作物新类型;③可转移多基因编码的性状(如作物的产量、品质、抗逆等);④利用不对称的体细胞杂交,可使少数供体基因组进入受体,并使供体植物的染色体片段渐渗到受体的染色体,使外源的基因或基因组在作物中能够很快稳定及遗传,减少回交次数,加速杂种在育种中的利用。
技术壁垒:不育性及遗传稳定性:杂种后代的产生是体细胞杂交所面临的主要问题,这可能是由于遗传物质的不平衡、杂种染色体的不稳定、双亲核质不亲和等原因造成的。需要经过与亲本回交及胚胎拯救等方法加以克服。
这项技术在国内发展至今已经有50多年的历程,随着分子育种相关技术的发展,围绕体细胞杂种植株分子机制层面的解析也在稳步开展,大家如果对此感兴趣的话,伯远生物会在后续的文章中再为大家进行介绍。
References:
华中农业大学.甘蓝型油菜-菘蓝E单体附加系在抑制流感病毒中的应用:202110478900.7[P].2022-03-08.
邓秀新. 原生质体融合获得柑桔种间体细胞杂种[J]. 遗传学报: 英文版, 1992, 19(2): 140-144.
夏光敏, 王槐, 陈惠民. 小麦与新麦草及高冰草属间不对称体细胞杂交的植株再生[J]. 科学通报, 1996, 41(15): 1423-1426.
夏光敏. 山融 3 号[J]. 中国农业信息, 2009 (8): 38-38.
解凯东, 方燕妮, 伍小萌, 等. 无核柚新品种 ‘华柚 2 号’[J]. 园艺学报, 2020, 47(Z2): 2945-2946.
Carlson P S, Smith H H, Dearing R D. Parasexual interspecific plant hybridization[J]. Proceedings of the national academy of sciences, 1972, 69(8): 2292-2294.
Takebe I, Labib G, Melchers G. Regeneration of whole plants from isolated mesophyll protoplasts of tobacco[J]. 1971.
Power J B, Cummins S E, Cocking E C. Fusion of isolated plant protoplasts[J]. 1970.
Melchers G, Sacristán M D, Holder A A. Somatic hybrid plants of potato and tomato regenerated from fused protoplasts[J]. Carlsberg research communications, 1978, 43: 203-218.
Han H, Wang Q, Wei L, et al. Small RNA and degradome sequencing used to elucidate the basis of tolerance to salinity and alkalinity in wheat[J]. BMC plant biology, 2018, 18: 1-17.




















 3197
3197

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








