2025年1月24日,遵义医科大学基础医学院李晓飞团队在Journal of Pharmaceutical Analysis(IF:8.9)上发表了题为“Disorder of phospholipid metabolism in the renal cortex and medulla contributes to acute tubular necrosis in mice after cantharidin exposure using integrative lipidomics and spatial metabolomics”的研究性论文。

斑蝥素(CTD)是一种在临床用于治疗多种肿瘤的天然化合物,临床应用却因其可能引起急性肾损伤(AKI)而受到限制。然而,AKI的主要诱因及其内在机制尚待阐明。本研究结合动物模型、脂质组学、空间代谢组学、分子对接、Western blot等技术,发现CTD诱导的 AKI 小鼠SCr和BUN显著上升,导致急性肾小管坏死(ATN)。脂质组学结果显示CTD暴露后共鉴定出232种差异脂质代谢物,包括甘油磷脂(GP)和鞘脂(SL)代谢在内的11条通路发生代谢紊乱。空间代谢组学进一步揭示55种种脂质代谢物发生显著空间分布改变及9条代谢通路受到干扰。整合分析发现,GP代谢在肾皮质和髓质中被激活,而SL代谢在肾皮质中受到抑制。其中上调的LysoPC(18:2)、LysoPC(16:0/0:0)及甘油磷酸胆碱,及下调的SM(d18:0/16:0)、SM(d18:1/24:0)和 SM(d42:1)是关键差异脂质。在CTD组中,LysoPC (16:0/0:0)浓度达到1.1196 mg/mL,可加重人肾小管上皮细胞(HK-2)的急性肾小管坏死。小鼠及HK-2细胞经CTD干预后,LysoPC酰基转移酶活性受抑,胆碱磷酸转移酶1(CEPT1)被激活。综上,CTD通过激活甘油磷脂代谢、抑制鞘脂代谢,导致肾皮质和髓质出现ATN进而诱发AKI,其中LysoPC (16:0/0:0)、LysoPC酰基转移酶和CEPT1可能为潜在的治疗靶点。
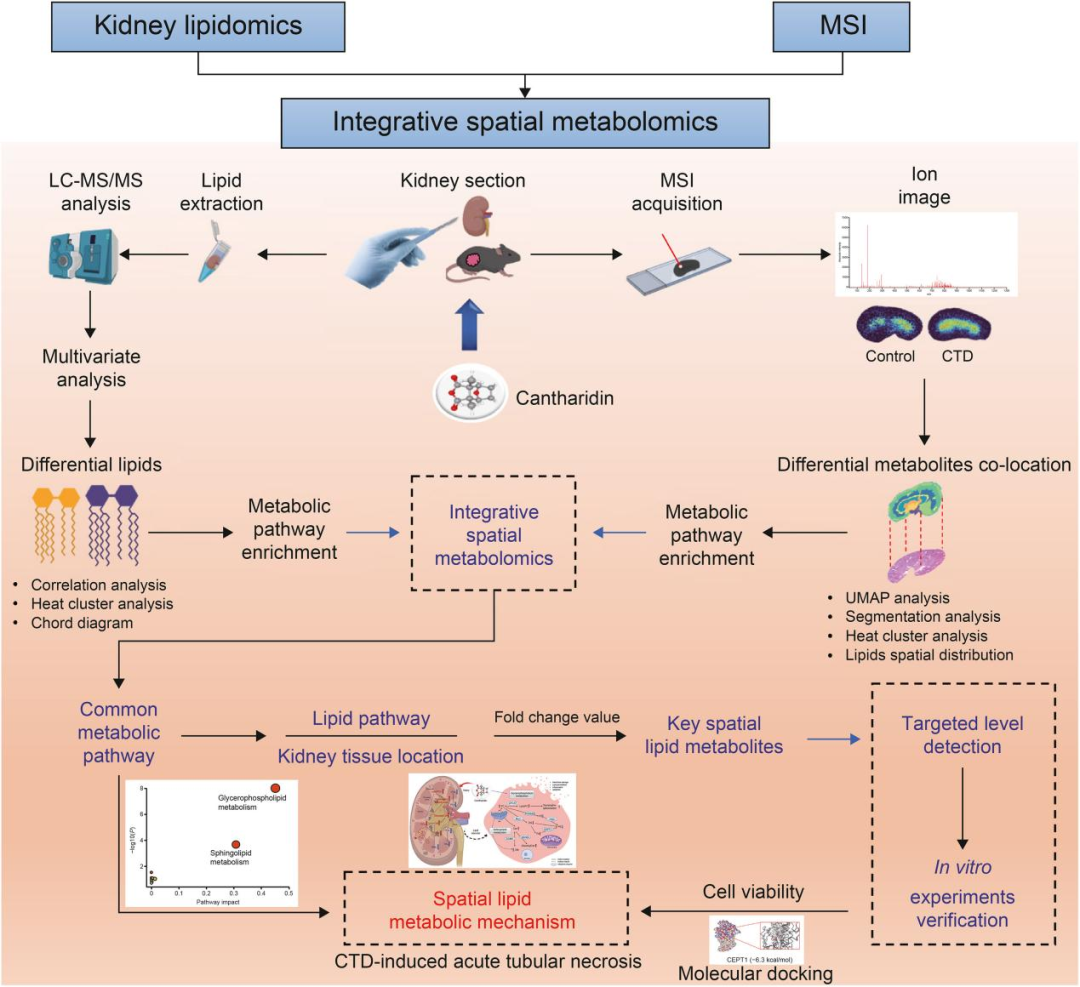
图1 通过脂质组学和空间代谢组学研究CTD诱导的AKI的研究策略(He et al., 2025)。
参考文献
1.Tianmu H, Kexin L, Lijuan X, et al. Disorder of phospholipid metabolism in the renal cortex and medulla contributes to acute tubular necrosis in mice after cantharidin exposure using integrative lipidomics and spatial metabolomics[J]. Journal of Pharmaceutical Analysis, 2025, 15(7):101210.




















 191
191

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








