研究背景
泛素化是一种关键的蛋白质翻译后修饰,参与调控蛋白质稳定性、信号转导、细胞周期等多种生命过程。去泛素化酶(DUBs)负责移除蛋白质上的泛素链,与泛素化过程共同维持细胞内蛋白质稳态。DUBs的异常活性与多种疾病(如癌症、神经退行性疾病)密切相关,因此成为潜在的治疗靶点。USP30是一种定位于线粒体外膜(OMM)的DUB,已被证实参与调控线粒体自噬(mitophagy)。USP30通过去除线粒体蛋白上的泛素链,抑制PINK1/Parkin介导的线粒体自噬过程。
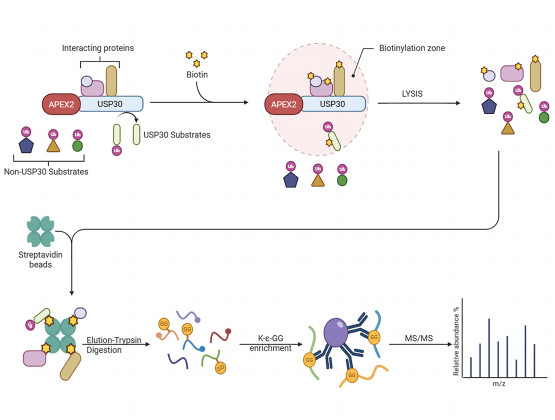
图1 实验原理图(Damianou et al., 2025)。
Oxford大学Kessler团队开发了一种整合“APEX2邻近标记”与“K-ε-GG泛素化富集”的新方法(proximal-ubiquitomics),并以USP30为模型,验证其在线粒体自噬过程中的底物识别能力。传统泛素组学(K-ε-GG IP)测的是全细胞所有泛素化事件,分不清哪些泛素化是USP30直接调控的。加上APEX2邻近标记后,只关注USP30周围20 nm以内的泛素化事件,极大压缩背景。
实验方法
①把USP30邻近的所有蛋白的快速生物素化,加生物素-苯酚(biotin-phenol)并H₂O₂触发APEX2催化功能,1 min内产生自由基,把生物素共价连接到邻近蛋白的酪氨酸上;
②细胞裂解,用链霉亲和素珠子(Streptavidin beads)来富集生物素化的蛋白;
③把富集到的蛋白先酶切成肽段,再用抗体富集含“K-ε-GG”泛素残基的肽,最后进行质谱鉴定。
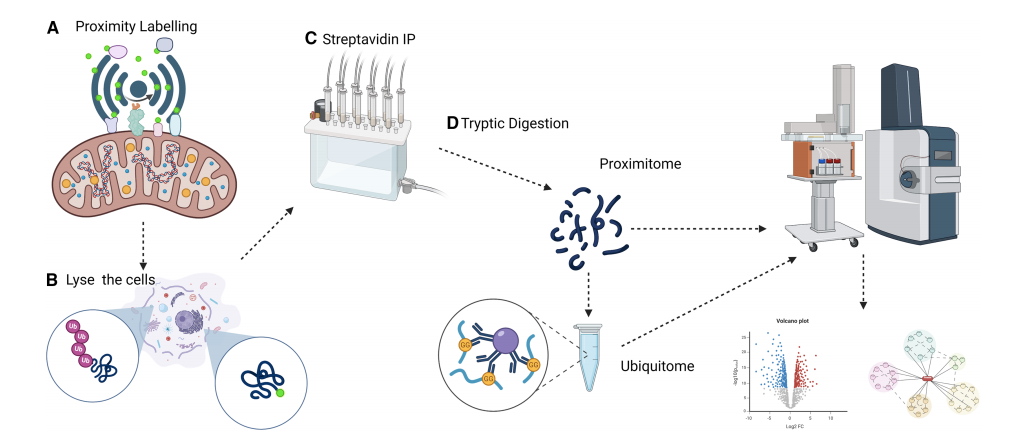
图2 USP30-APEX2邻近-泛素组学实验流程(Damianou et al., 2025)。
实验结果
图B为内源vs APEX2-USP30的表达量检测:融合酶条带清晰,表达量≈ 3.8倍内源水平,无过量表达导致的错误定位风险;
图C为HA-Ub-PA活性探针检测USP30酶活性,结果表明融合酶被探针共价捕获分子量↑,证明USP30的催化中心仍具活性;
图D为免疫荧光共定位,生物素信号(APEX2标记)与线粒体膜蛋白TOMM20完全重叠,融合酶仍在正确位置。
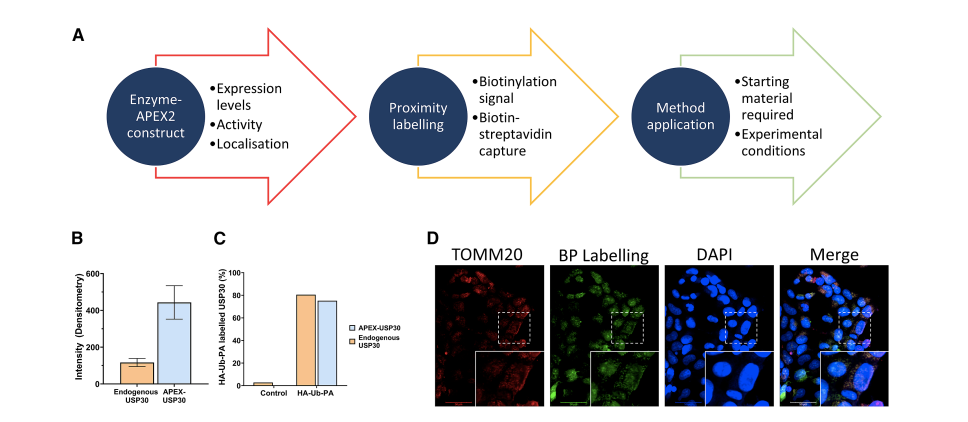
图3 USP30-APEX2 邻近-泛素组学实验的可靠性验证结果(Damianou et al., 2025)。
“邻近+泛素”双重过滤,让线粒体外膜泛素化蛋白的富集效率提升2倍,背景噪音大幅下降。
①总蛋白中,线粒体外膜蛋白OMM比例最低约10%——符合预期,全细胞蛋白里线粒体外膜只是小部分。
②在全细胞泛素化蛋白中,OMM比例稍有上升,但仍<15%,说明传统K-ε-GG富集对OMM没有明显偏好。
③邻近+泛素化蛋白中,OMM占比翻倍到近30%!,说明经过APEX2-USP30导航后,泛素化事件被定向浓缩在线粒体外膜;背景蛋白大量剔除,真正与USP30空间相邻的泛素化底物显著突出。
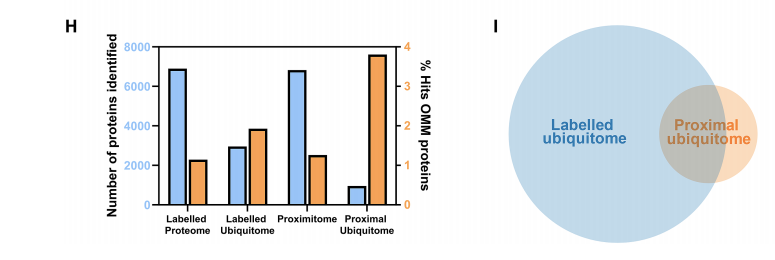
图4 “邻近+泛素”高效富集线粒体外膜的泛素化蛋白(Damianou et al., 2025)。
参考文献
Damianou A, Jones H B L, Grigoriou A, et al. Integrative proximal-ubiquitomics profiling for deubiquitinase substrate discovery applied to USP30[J]. Cell Chemical Biology, 2025, 32(5): 736-751. e8.





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








