蛋白质磷酸化作为最关键的翻译后修饰之一,对磷酸化的检测是研究蛋白功能重要手段之一。传统磷酸化检测技术(如磷酸化抗体Western Blot)往往难以区分不同磷酸化状态下的蛋白质亚型,而Phos-tag™技术凭借其独特原理,实现了对磷酸化蛋白的高分辨率分离与检测,成为研究蛋白磷酸化动态的利器。
01 Phos-tag™技术核心原理
Phos-tag™是一种人工合成的功能性分子,其核心为双核锌(II)复合物。该结构能特异性、高亲和力地与磷酸根基团(-PO₄³⁻)结合,结合强度远超传统抗体。在SDS-PAGE凝胶中加入Phos-tag™分子,磷酸化蛋白在迁移过程中会与凝胶中的Phos-tag™结合,导致迁移速率显著降低。磷酸化程度越高,结合的Phos-tag™分子越多,迁移越慢,从而在凝胶上形成清晰可辨的“阶梯状”条带,直观展示不同磷酸化修饰状态。
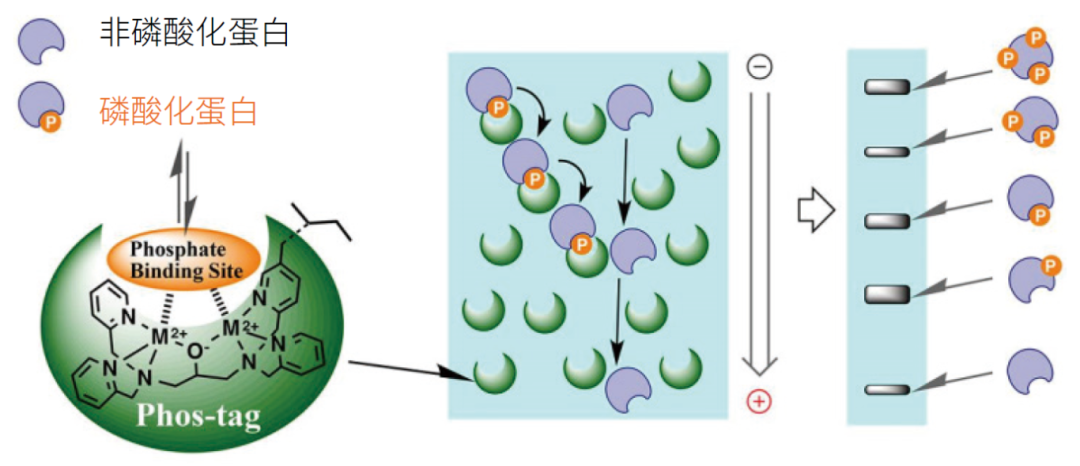
图片来源于网络
02 实验操作流程
实验前准备:
1、根据蛋白大小配制包含Phos-tag™和MnCl2的蛋白凝胶;
2、收集细胞并裂解提取总蛋白溶液(冰上操作,添加蛋白酶和磷酸酶抑制剂);
3、采用BCA或者Bradford法测定蛋白浓度确定上样量;
4、将蛋白样本进行SDS-PAGE凝胶电泳检测(操作同Western blot,但需全程低温进行);
5、电泳完成后,使用含EDTA的转膜液进行凝胶前处理,室温孵育10-20 min;6、前处理完成后,按Western blot转膜操作进行转膜处理;
7、使用BSA进行膜封闭,然后经一抗-二抗孵育后进行显影操作并采集信号;
03 结果分析
如图所示,ANGPTL4是蛋白激酶IRE1的底物蛋白,通过Phos-tag实验检测显示,IRE1能够明显促进ANGPTL4的磷酸化,而ANGPTL4 S30A突变则导致磷酸化丢失。说明IRE1激活ANGPTL4磷酸化的位点为S30氨基酸残基。
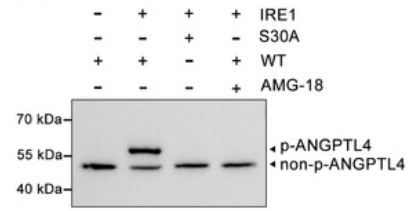
(Xiao J, et al. 2024)
04 常见问题分析
Q1:磷酸化条带信号弱或无信号
问题分析:
由于磷酸化修饰水平低并且是可逆过程,因此样本量不足、样本处理有误、磷酸酶抑制剂不足或失效,转膜效率低、封闭条件不当、抗体效价差等都可能导致磷酸化条带信号弱或者无信号。
解决方案:
需要在实验中优化样本处理条件、电泳参数设置以及转膜和抗体孵育流程;使用高效价抗体和适当封闭条件。并且一定要确保转膜前进行了充分的EDTA处理,避免因转膜前处理不当导致实验失败。
Q2:非特异性条带多,背景高
问题分析:
类似于Western blot实验,一抗或二抗浓度过高、封闭不充分、洗涤不彻底、抗体特异性差或者PVDF膜操作不当都可能导致非特异性结合或者高背景信号。
解决方案:
降低抗体使用浓度、优化封闭和洗涤条件以及使用特异性高的抗体能够对该问题进行一定程度的优化。
Q3:条带弥散、拖尾严重
原因分析:
蛋白样本降解(蛋白酶抑制剂失效或未用)、样本溶解不充分或有聚集、电泳缓冲液SDS浓度不足、凝胶聚合不均、Phos-tag™或Mn²⁺浓度过高以及电泳温度过高都可能导致类似问题。
解决方案:
在进行Phostag实验时,建议充分裂解样本,离心去除不溶物、使用新鲜有效的蛋白酶抑制剂和电泳缓冲液、电泳以及转膜时保证全程低温处理、优化Phos-tag™或Mn²⁺使用浓度。
Q4:磷酸化条带迁移位置不符合预期或与普通胶差别不大
原因分析:
主要原因可能是EDTA处理步骤被遗漏或处理时间不足,导致磷酸化蛋白未解离,未能有效转膜;Phos-tag™或Mn²⁺浓度过低,无法有效结合磷酸基团导致迁移延迟不明显;目标蛋白磷酸化位点少或修饰程度低;SDS-PAGE凝胶浓度过低,导致分离效果差。
解决方案:
转膜前对凝胶进行充分的EDTA前处理操作;优化Phos-tag™或Mn²⁺使用浓度;增加上样量或者刺激细胞增加磷酸化水平;使用合适浓度的凝胶浓度进行电泳。Phos-tag™或Mn²⁺浓度过低,无法有效结合磷酸基团导致迁移延迟不明显。
Q5:凝胶在操作中容易破碎
原因分析:
由于Phostag凝胶中添加Phos-tag™和MnCl2,导致其理化性质发生变化,因此较普通凝胶容易破碎。
解决方案:
小心操作,确保玻璃板干净平整;电泳后取胶可先将凝胶浸泡在转膜缓冲液(含EDTA)中一段时间使其略微溶胀变韧。
05 Phos-tag™技术的优势
(1)高分辨率分离:
可清晰区分同一蛋白的不同磷酸化亚型(单磷酸化、多磷酸化)。
(2)动态监测:
结合时间进程实验,可直观展示信号刺激或药物处理后目标蛋白磷酸化状态的动态变化。
(3)无需特殊抗体:
核心分离依赖于Phos-tag™凝胶,后续检测使用常规抗体即可(识别磷酸化或总蛋白)。
(4)相对定量:
通过比较不同条带的光密度,可对特定磷酸化状态进行半定量分析(需结合总蛋白水平)。




















 724
724

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








