目录
1 引言
流感是一种在人类历史中反复“刷新存在感”的呼吸道传染病。它不像某些病原体那样只在特定地区或特殊宿主中沉寂存在,而是以季节性流行与偶发性大流行为节律,持续挑战公共卫生体系。对免疫学而言,流感的意义也远超“常见呼吸道病毒”这几个字:它是抗原漂移与免疫逃逸的教科书案例,是评估疫苗诱导保护性免疫相关指标(correlates of protection, CoP)的经典模型,也是理解“免疫记忆如何在不断变化的抗原中维持有效性”的最佳试金石之一。
流感疫苗之所以每年都需要更新配方,本质上反映了病毒与宿主免疫系统之间的动态博弈。疫苗不是一劳永逸的盾牌,更像是一场每年被迫重修的“防御工程”。对大众而言,这容易被误解为“疫苗不行”;但对生物学与免疫学研究者而言,这恰恰说明疫苗在一个高度变动的病毒生态位中仍然能提供可测量、可积累且可策略性优化的保护。观察性研究与多国数据持续显示,季节性流感疫苗通常可提供中等程度的保护,且在匹配度较好的季节表现更佳;2022/23赛季的欧洲多中心结果也提示疫苗对甲型与乙型流感都有可观的疾病风险降低,儿童获益更为显著。(PMC)
本文以“流感疫苗的作用”为主线,尝试用免疫学语言串联四层逻辑:其一,流感病毒的结构与抗原演化为何决定了疫苗策略;其二,现有主要疫苗平台分别诱导了怎样的体液、细胞与黏膜免疫;其三,真实世界与随机试验数据如何共同勾勒“保护的量级、边界与不确定性”;其四,面向未来的“广谱/通用流感疫苗”应如何在免疫机制层面突破现有天花板。
2 流感病毒的抗原景观与疫苗设计的生物学约束
流感病毒属于正黏病毒科,A型与B型是人类季节性流行的主角。其表面两大糖蛋白——血凝素(HA)与神经氨酸酶(NA)——既是病毒入侵与释放的关键分子,也是适应性免疫识别的主要靶标。传统季节性疫苗的免疫学“核心任务”,很大程度上就是诱导足够水平、足够匹配的抗HA抗体。几十年来,血凝抑制(HI)抗体滴度被视为最经典且最广泛接受的保护相关指标之一,尽管在老年人等高风险人群中,HI滴度对真实保护的预测能力可能弱于健康成人,因此推动了研究者对HA茎部抗体、NA抗体、ADCC、T细胞反应等“扩展CoP”的持续探索。(CDC Stacks)
如果说HA头部是免疫系统最常“看到”、也最容易被病毒“换掉衣服”的区域,那么HA茎部与部分内部蛋白(如NP、M1)则更稳定,也更接近“广谱保护”的希望所在。这种结构-进化上的不对称性,解释了为什么传统疫苗在阻断同株或近缘株感染方面更可靠,而对漂移较明显的A(H3N2)等亚型往往表现更不稳定。与此同时,病毒在鸡胚中培养所产生的“适应性突变”(egg adaptation)可能改变疫苗株HA的抗原性,导致疫苗诱导的抗体与真实流行株之间出现额外偏差,因此细胞培养与重组蛋白等“去鸡胚化”的制造路径逐渐成为优化方向。(OUP Academic)
这一切共同构成了一个现实约束:季节性流感疫苗的目标从来不是“创造绝对屏障”,而是在有限可预测的抗原信息基础上,为群体免疫系统提供一个可以被快速动员的“预先训练版本”。免疫学意义上的“有效”,既包括降低感染概率,也包括降低病毒载量峰值、缩短病程、减少并发症风险与住院风险。这种多维度收益往往在“单看感染终点”的叙事中被低估。
3 现有主要流感疫苗平台及其免疫学画像
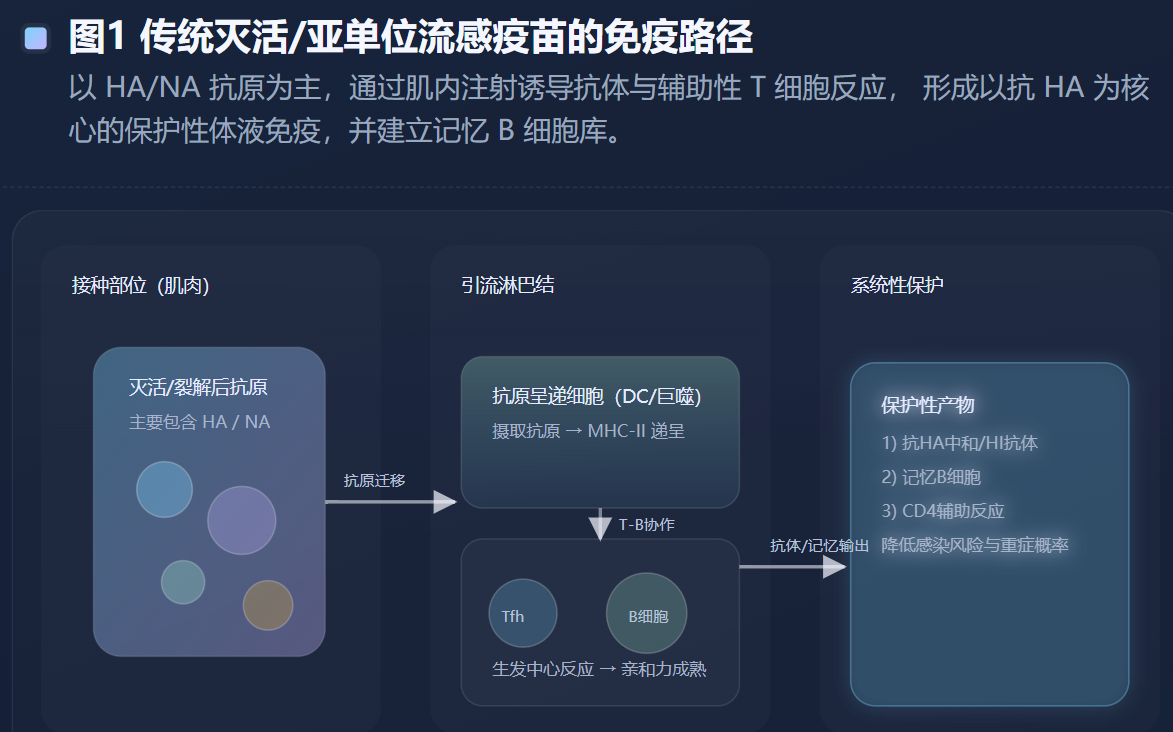
今天的季节性流感疫苗大体可分为灭活疫苗(IIV)、减毒活疫苗(LAIV)、重组HA疫苗(RIV)以及不同生产与增强策略的细分版本,例如高剂量(HD)、MF59佐剂、细胞培养(cell-based)等。它们的差异不仅是“工艺路径”,更是“免疫应答构型”的差异。
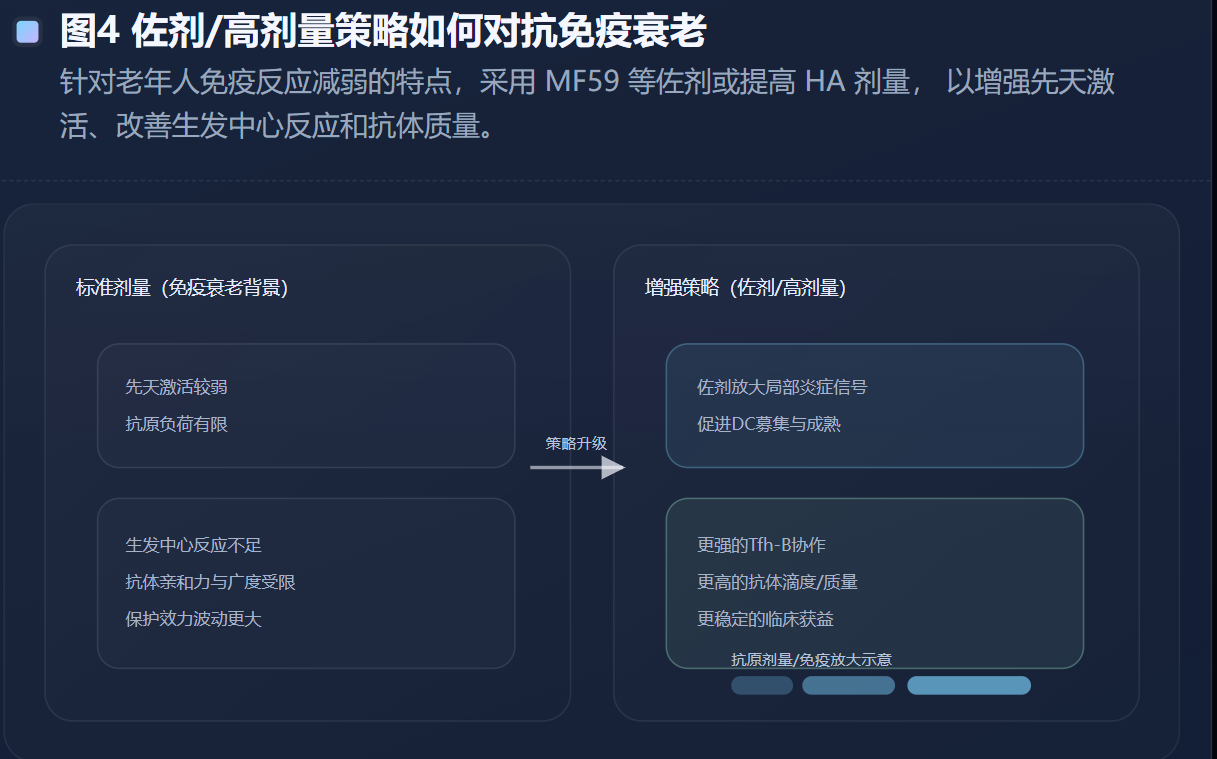
灭活疫苗是多数地区的主力。它通过肌内注射将HA等抗原递呈给抗原呈递细胞,引导B细胞分化为浆细胞并产生HI抗体,同时诱导一定的CD4 T细胞辅助反应。对多数健康成人而言,这套路径足以提供可观的季节性保护。但对免疫衰老背景下的老年人,常规剂量疫苗的免疫原性下降较明显,因此出现了“加抗原量或加佐剂”的增强型设计。npj Vaccines的一项老年人随机对照研究综述性讨论也指出,高剂量、MF59佐剂与重组HA等平台在某些免疫指标上优于标准剂量疫苗,体现出针对免疫衰老的“工程化补偿思路”。(Nature)
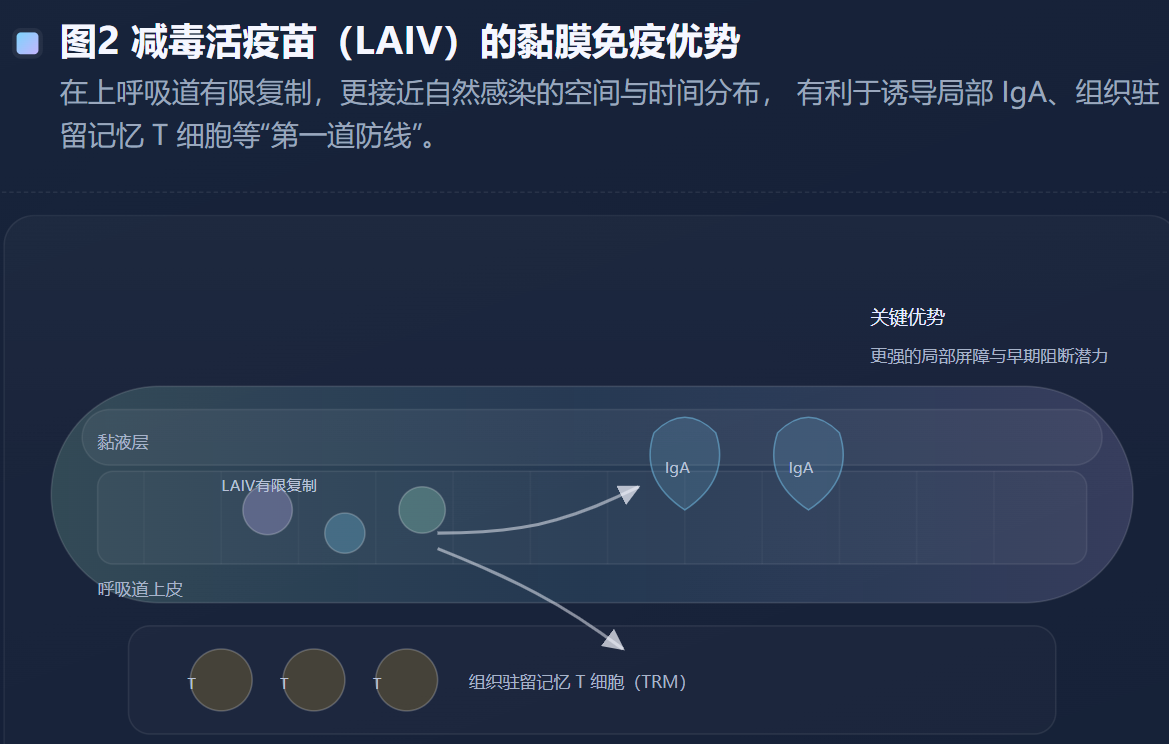
LAIV则更像是“以低风险方式模拟自然感染”。其在上呼吸道有限复制,能在局部黏膜层面诱导IgA与组织驻留记忆T细胞等更接近自然感染的免疫成分。综述指出,LAIV诱导的免疫反应具有更“广谱、类自然感染”的特征,在儿童中临床保护优势更明显,这也提示了黏膜免疫在流感防御中的重要性。(PMC) 这种优势并不必然在成人中同等复刻,部分原因可能与既往感染史、基线免疫景观以及鼻黏膜局部免疫微环境差异有关。
重组HA疫苗与细胞培养疫苗则主要从“抗原真实性与制造可控性”出发。重组技术绕开鸡胚培养潜在的抗原性偏移,理论上更能保留与流行株一致的表位构型,同时也便于快速放大产能。细胞培养路线同样减少鸡胚适应突变的影响,2024年的一项大规模回顾性TND研究围绕2017–2020多个流感季比较了细胞基与鸡胚基四价疫苗的相对有效性,其研究背景就强调“去鸡胚化”有望带来更接近野生型病毒抗原的免疫识别。(OUP Academic)
这些平台并非互相替代的简单关系,而更像是在不同人群、不同流行亚型背景下提供“可调节的免疫工具箱”。免疫学的难题在于:我们既要在群体层面推动高覆盖率,也要在个体层面推动更精准的“人群-平台匹配”。
4 免疫相关保护指标:从HI到更丰富的免疫维度
如果只用一句话概括流感疫苗免疫学的历史,那就是“HI抗体的成功与不够”。HI滴度长期作为监管与研发评估的关键指标,这种单一指标的优势在于标准化、可比性与可操作性,但挑战也同样明显:同样的HI滴度在不同年龄层、不同既往暴露史的人群中,对真实保护的映射并不完全一致。CDC与学界的综述性材料指出,HI仍是唯一被普遍接受的CoP,但在老年人、幼儿和某些免疫功能异常人群中,HI对保护的预测力下降,提示我们需要引入更复杂的免疫维度。(CDC Stacks)
近年来的研究逐渐强调至少三条“补充轴线”。第一条是针对HA茎部与NA的抗体反应。HA茎部相对保守,理论上更能跨亚型提供保护;NA抗体则与降低疾病严重度、缩短病毒排出时间等结局相关。第二条是细胞免疫,特别是交叉反应性的CD8 T细胞与帮助抗体成熟的Tfh细胞。一些研究与综述提及,增强型疫苗可在Tfh募集、NK细胞活化、ADCC相关抗体等方面展现优势,这可能是解释其在老年人中更好表现的免疫学线索之一。(Nature) 第三条是黏膜免疫,LAIV的经验表明,上呼吸道局部IgA与组织驻留记忆细胞可能是“降低感染门槛”的关键要素。(PMC)
这三条轴线共同指向一个趋势:未来的流感疫苗评估体系很可能从“单一血清学阈值”逐步走向“多参数保护概率模型”。在这个模型中,抗体的量与质、细胞免疫的广度与功能状态、黏膜屏障的即时响应能力,将共同决定一个人在特定季节、面对特定流行株时的真实风险。
5 临床试验与真实世界数据:作用大小、差异来源与可解释性
谈论“流感疫苗有多大作用”不能脱离具体终点、具体人群与具体季节。疫苗有效性(VE)在不同赛季波动是常态,部分波动来自疫苗株与流行株的匹配度,部分波动来自人群免疫结构、既往接种史与自然感染的复杂交互。
在增强型疫苗方面,高剂量灭活疫苗提供了经典的证据链。NEJM 2014年针对≥65岁人群的随机试验显示,高剂量三价灭活疫苗相对标准剂量疫苗的相对有效性为24.2%,提示“提高抗原负荷”能够转化为可测量的临床获益。(新英格兰医学杂志) 这一结果不仅是工艺层面的成功,更是免疫学层面的验证:在免疫衰老背景下,抗原量仍然是可被利用的“杠杆”。
重组疫苗同样展示了“去鸡胚化+高HA剂量”策略的潜力。早期关于三价重组HA疫苗(FluBlok)的研究显示,其在存在抗原漂移背景下仍能提供44.6%的保护效力(与安慰剂相比),并报告了对三种成分的较高HAI应答比例。(PubMed) 随着四价重组疫苗的发展,NEJM 2017年在50岁及以上成人中比较RIV4与标准剂量IIV4,结果显示RIV4组发生流感样病例的概率比IIV4低30%(95%CI 10–47)。(PubMed) 这提示在某些季节、尤其可能存在鸡胚适应与A(H3N2)抗原偏移压力时,重组路线能够为临床保护贡献额外的优势。
细胞培养疫苗的证据链更多来自真实世界与回顾性TND研究。2024年的一项覆盖三个流感季、基于超大规模医疗数据的研究聚焦4–64岁人群,围绕细胞基QIVc与鸡胚基QIVe估算相对有效性,研究动机与背景强调减少鸡胚适应突变可能带来更高的保护点估计。(OUP Academic) 虽然不同研究对具体点估计与显著性可能存在差异,但“制造平台影响抗原真实性,进而影响免疫识别”的机制逻辑已越来越具备跨研究一致性。
在老年人群的免疫原性比较研究中,佐剂与高剂量之间究竟孰优孰劣并非总是“非黑即白”。一项随机临床试验比较MF59佐剂三价疫苗与高剂量三价疫苗,报告A(H3N2)血清转换率在佐剂组为32.8%(112/342),高剂量组为38.5%(130/338),差异约-5.8%且未达到预设的非劣界值;与此同时,其他株的转换率、血清阳性率与部分GMT指标差异并不显著或呈现更复杂的年龄分层特点。(SpringerLink) 这一结果非常“免疫学真实”:当我们企图用单一指标宣布平台优劣时,真实的人群免疫系统常常给出更细腻也更难被一句话概括的答案。
从群体层面看,季节性流感疫苗的“中等保护”仍具重要意义。欧洲多国在2022/23赛季的中期分析提示,接种者在全人群层面对甲型与乙型流感的疾病发生都有实质性降低,并且儿童中观察到更高的保护幅度。(PMC) 这与免疫学直觉一致:儿童既往暴露史较短、免疫印迹较浅,疫苗诱导的“新记忆”更容易在免疫网络中占据优势位置。
6 表格:来自文献的真实数据对照
下面表格均基于公开英文文献中报告的数值整理,不额外推算未给出的数据。
表1 增强/新型平台的临床保护证据(代表性研究)
| 疫苗/策略 | 对照 | 人群与研究类型 | 主要结果(原文报告的效力/相对效力) | 来源 |
|---|---|---|---|---|
| 高剂量三价灭活疫苗(IIV3-HD) | 标准剂量IIV3-SD | ≥65岁,随机试验 | 相对有效性约24.2% | DiazGranados 等,NEJM 2014(摘要/报道信息)(新英格兰医学杂志) |
| 三价重组HA疫苗(FluBlok/rHA0) | 安慰剂 | 成人,临床试验 | 对“培养确诊且符合CDC ILI定义”的流感的效力44.6%(95%CI 18.8–62.6) | Treanor 等 2011 (PubMed) |
| 四价重组疫苗(RIV4) | 标准剂量IIV4 | ≥50岁成人,随机对照 | RIV4组“流感样病例概率”比IIV4低30%(95%CI 10–47) | Dunkle 等,NEJM 2017(摘要/报道信息)(PubMed) |
表2 老年人群佐剂与高剂量疫苗的血清学比较(A(H3N2))
| 指标 | MF59佐剂三价疫苗 aIIV3 | 高剂量三价疫苗 HD-IIV3 | 说明 | 来源 |
|---|---|---|---|---|
| 研究样本量(免疫原性人群) | 342 | 338 | 随机临床试验 | Schmader 等 2023 (SpringerLink) |
| A(H3N2) 血清转换人数(比例) | 112(32.8%) | 130(38.5%) | 以第29天转换率为主要终点 | Schmader 等 2023 (SpringerLink) |
| 组间差异(aIIV3 - HD-IIV3) | -5.8%(95%CI -12.9%~1.4%) | — | 文章报告的差异与置信区间 | Schmader 等 2023 (SpringerLink) |
表3 2022/23欧洲多研究网络的季节性疫苗有效性信号(中期)
| 终点/亚型 | 全人群趋势性结论 | 备注 | 来源 |
|---|---|---|---|
| 甲型流感 | 接种者疾病发生**≥27%**降低(中期综合结论表述) | 不同国家/研究点估计存在范围差异 | Kissling 等 2023 (PMC) |
| 乙型流感 | 接种者疾病发生**≥50%**降低(中期综合结论表述) | 儿童中保护幅度更高 | Kissling 等 2023 (PMC) |
7 机制层面的综合理解:疫苗如何“改变疾病轨迹”
将这些数据放回免疫学框架,我们会发现一个非常关键的事实:流感疫苗的主要贡献并非总是“完全阻断感染”,而是“重塑感染后的免疫动力学”。当疫苗诱导的记忆B细胞与循环抗体在暴露早期就能捕捉HA表位时,病毒复制的上升曲线会被压低,抗原负荷峰值下降意味着先天免疫炎症风暴的概率降低,继发性细菌感染的窗口缩小,而肺部与心血管等远端系统受到的免疫-炎症冲击也更轻。这也解释了为何即便在某些低匹配季节,疫苗仍能在住院和重症结局上保留更稳定的公共卫生价值。
LAIV提供的黏膜层级证据尤其值得强调。上呼吸道是流感病毒的第一战场,局部IgA与组织驻留记忆细胞的快速应答能够在病毒尚未扩散到下呼吸道前就“掐断燃料供应”。综述指出,LAIV诱导的免疫反应更接近自然感染,且在儿童中可呈现比灭活疫苗更广的临床保护。(PMC) 这对未来疫苗设计具有启发意义:如果我们能将“安全可控的黏膜免疫增强策略”与“高质量抗原呈递”结合,或许能同时提升“抗感染”与“抗重症”两类终点。
8 影响疫苗效果的关键生物学变量
流感疫苗效果的波动不是“随机噪声”,而是受一系列可被生物学解释的变量控制。病毒层面的变量包括抗原漂移速度、当季优势亚型(A(H3N2)常更具挑战性)、以及制造路径是否引入抗原性偏移。个体层面的变量包括年龄与免疫衰老、既往感染与既往接种史形成的“免疫印迹”,慢性疾病与免疫抑制状态,以及药物(如某些免疫调节或代谢相关药物)对免疫反应的潜在影响。群体层面的变量则涉及接种覆盖率、学校与养老机构等高接触场景的传播网络结构以及与其他呼吸道病原共流行时的竞争/协同效应。
这些变量共同说明一个现实:流感疫苗的作用需要“以系统视角理解”。在个体层面,它是风险管理工具;在群体层面,它是传播动力学的调节阀;在免疫学层面,它是一次对记忆系统的年度“微调与更新”。
9 面向未来:广谱与“通用”流感疫苗的免疫学路线图
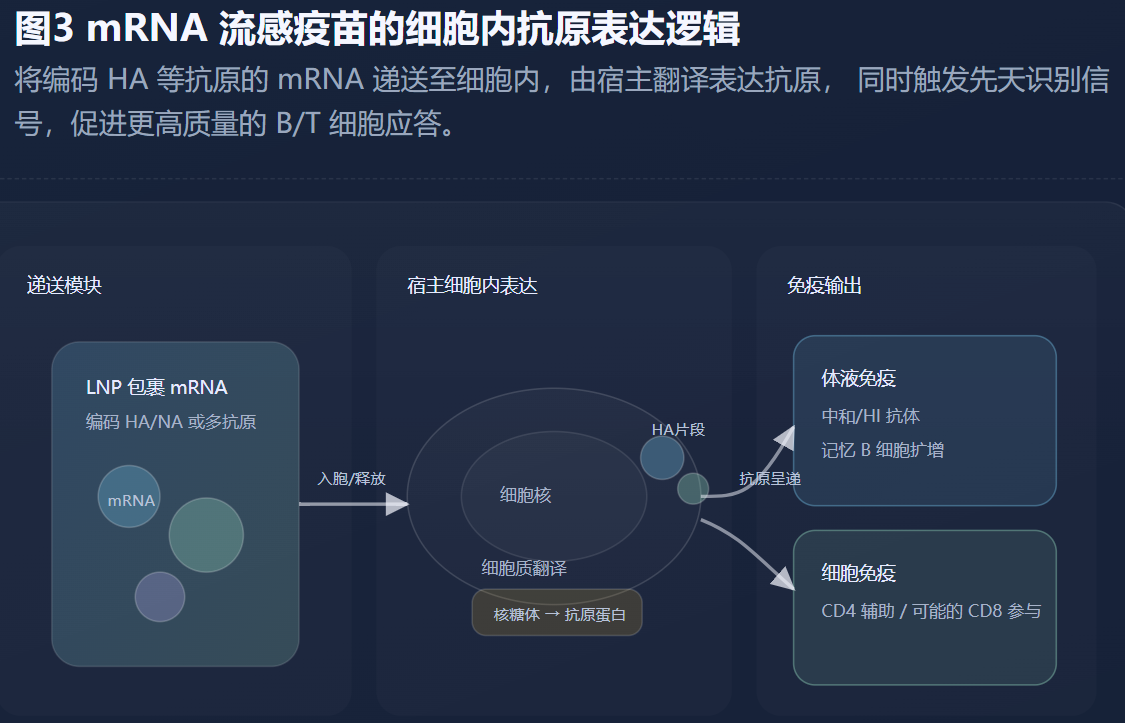
传统季节性疫苗的天花板,归根结底来自“头部HA的变动性”与“评估指标对真实保护维度的简化”。要想突破这一点,广谱疫苗需要同时在抗原设计与免疫诱导方式上升级。抗原设计方面,聚焦HA茎部的免疫原、马赛克/嵌合HA结构、以及将NA与内部蛋白纳入配方的多靶点策略,都在试图把免疫系统的注意力从“最易漂移的区域”引导到“更保守的区域”。免疫诱导方式方面,黏膜递送、合理佐剂组合以及可能的新平台(包括正在探索中的RNA路线)都在争取更平衡的体液-细胞-黏膜联合应答。近年来关于不同平台诱导免疫构型的综述也指出,现有疫苗在细胞免疫上仍有不足,而新平台有望带来更均衡的保护景观。(ScienceDirect)
然而,广谱并不等于“脱离季节更新”。更现实的短期路径可能是“双轨并行”:一方面继续优化季节性配方匹配度与制造技术(细胞基、重组、增强型疫苗的更精准使用);另一方面以多参数CoP框架推动广谱候选物的临床评价,从而逐步积累“跨季节、跨亚型可预测保护”的证据链。
10 结语
流感疫苗的“作用”不是一个单点答案,而是一组在免疫学层次上可被拆解、在临床层次上可被测量、在公共卫生层次上可被放大的效应。高剂量疫苗用随机试验告诉我们,在老年免疫衰老背景下,“加大抗原剂量”可以带来约24.2%的相对保护提升。(新英格兰医学杂志) 重组疫苗与早期FluBlok数据显示,绕开鸡胚制造并提高HA负荷,能够在某些漂移背景下仍维持可观的保护效力。(PubMed) LAIV的黏膜免疫优势提醒我们,真正的上呼吸道第一道防线可能是提升“抗感染能力”的关键。(PMC) 而当代对CoP的再思考则推动我们超越HI单一指标,转向更能解释人群差异与季节波动的多维免疫框架。(CDC Stacks)
如果把流感疫苗比作一门年度必修课,那么它教给免疫学的不是“完美答案”,而是“如何在一个不断变化的抗原世界里,让免疫记忆保持足够的现实有效性”。这门课程仍在更新,而我们对其作用机制的理解越精细,未来的疫苗就越有机会从“季节性修补”走向“更持久、更广谱的结构性防御”。
参考文献(英文为主)
-
Kissling E, et al. Interim 2022/23 influenza vaccine effectiveness: six European studies. 2023. (PMC)
-
DiazGranados CA, et al. Efficacy of High-Dose versus Standard-Dose Influenza Vaccine in Older Adults. New England Journal of Medicine. 2014. (新英格兰医学杂志)
-
Treanor JJ, et al. Protective efficacy of a trivalent recombinant hemagglutinin influenza vaccine (FluBlok). Vaccine. 2011. (PubMed)
-
Dunkle LM, et al. Efficacy of Recombinant Influenza Vaccine in Adults 50 Years of Age or Older. New England Journal of Medicine. 2017. (PubMed)
-
Schmader KE, et al. Immunogenicity of adjuvanted versus high-dose inactivated influenza vaccines in older adults: a randomized clinical trial. Immunity & Ageing. 2023. (SpringerLink)
-
Mohn KGI, et al. Immune responses after live attenuated influenza vaccination. 2018. (PMC)
-
Reber A, Katz J. Immunological assessment of influenza vaccines and correlates of protection. 2013. (CDC Stacks)
-
Cox RJ. Correlates of protection to influenza virus, where do we go from here? 2013. (PMC)
-
Jones CH, et al. Comparative analyses of immune responses induced by licensed influenza vaccines. 2024. (ScienceDirect)
-
Stein AN, et al. Relative Vaccine Effectiveness of Cell- vs Egg-Based Quadrivalent Influenza Vaccine over 3 seasons. Open Forum Infectious Diseases. 2024. (PubMed)























 938
938

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










