用于治疗感觉和运动周围神经的新型冷冻神经溶解装置
摘要
引言:冷冻神经溶解术是将低温直接应用于外周神经,以可逆性地阻断神经传导从而实现疼痛缓解。近年来开发的一种带有细规格针头和集成式皮肤加热器的手持式冷冻神经溶解设备,扩展了其临床应用范围,包括浅表神经的治疗,并进一步推动了术前疼痛、术后疼痛、慢性疼痛以及肌肉运动障碍的治疗。涵盖领域:冷冻神经溶解术通过对外周神经施加低温,引起华勒变性和神经再生,从而实现可逆性神经消融。过去50年的应用表明,该技术并发症和不良反应的发生率极低。传统上,冷冻探针需通过外科切口放置;但近年来的技术进步实现了经皮给药。一种新型手持设备目前已获准在美国使用。冷冻神经溶解术已被用于治疗术后疼痛状态、慢性疼痛状态以及痉挛。
专家评论:美国医疗系统的变化,例如推动减少阿片类药物使用和引入诊断相关组代码,以及最近的技术进步(包括一种手持装置,可在保护皮肤免受损伤的同时治疗浅表神经),可能有助于冷冻神经溶解术在治疗外周神经方面的重新兴起。
关键词:冷冻神经溶解术,冷冻镇痛,冷冻神经消融,感觉神经,术后镇痛,痉挛,慢性疼痛
1.0 引言
局部应用低温进行医学治疗已有数个世纪的历史,最早可追溯到公元前460年希波克拉底描述冷在镇痛和抗炎方面的特性[1]。此后,冷冻外科技术的进步使得更低的温度(低至‐196°C)可用于组织消融。此外,利用一氧化二氮或二氧化碳作为制冷剂(用于产生极低温度的物质)的技术发展已使得神经的可逆性破坏,也称为冷冻神经溶解术。这些技术采用了一种成熟的作用机制,自20世纪60年代初以来已实现商业化应用[3]。
近期,新一代冷冻神经溶解设备已经研发出来,有望拓展该技术的临床应用。iOvera°系统( Myoscience公司,美国加利福尼亚州弗里蒙特)是经美国食品药品监督管理局批准的II类医疗器械,适用于外科手术中的组织破坏以及外周神经的冷冻镇痛,以提供长期疼痛缓解。该手持设备利用压缩液态一氧化二氮,通过细规格封闭端针头对外周神经进行冷却,产生局部性、可逆性神经破坏,从而阻止神经信号传导。本文旨在综述其作用机制,讨论技术现状,并描述这些近期重大进展如何实现疼痛减轻、不自主肌肉运动减少以及阿片类药物使用降低。
2.0 背景
2.1 神经解剖学
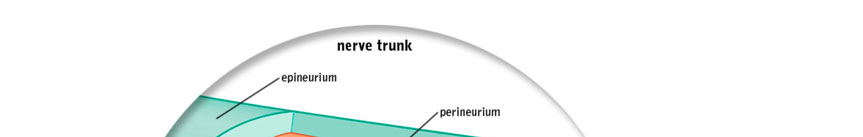
外周神经实现脊髓与身体组织/器官之间的通信。神经最内层的部分是轴突,负责在大脑和组织之间传导信号(图1)。在有髓神经中,这些轴突被由施万细胞同心层组成的髓鞘所包围,其功能是提高神经信号传导速度。内膜是一层疏松结缔组织,包裹着每根轴突。轴突被组合成称为神经束的束状结构,沿神经全长延伸。每个神经束周围并将其固定在一起的是束膜,这一覆盖结构呈同心层状,由扁平化的神经束膜细胞、基底膜和胶原纤维构成。神经外膜是一层致密结缔组织,覆盖并连接这些神经束,形成神经的外表面(图1)。

2.2 神经损伤分级
神经损伤的表征和分类已确立数十年。赫伯特·塞德登爵士首次在1943[4],发表了一个三级神经损伤分级,随后悉尼·桑德兰爵士于1951年发表了一个五级量表,对塞德登分级进行了更细致的划分(表1)[5]。这些分级将神经损伤按照温度[6, 7]进行分类:
- 第一度神经损伤(神经失用)是最轻微的神经损伤类型,其特征是神经沿轴突传导动作电位的能力受到破坏。损伤部位可能出现局部髓鞘受损,但神经结构整体和轴突基本保持完整且未发生变化。神经失用后的完全功能恢复时间可从几分钟到数周不等。
- Second degree神经损伤的特征是轴突发生可逆性变性过程,也称为华勒变性。轴突和髓鞘的变性最初发生在损伤部位,随后不久,轴突及其相关髓鞘的其余远端部分也发生变性。轴突的逆行性变性局限于损伤部位,而神经胞体保持不变。与神经失用相比,华勒变性导致更长时间的功能丧失。功能恢复取决于轴突再生并重新支配靶器官所需的时间。根据轴突损伤部位到靶器官的距离,信号传导的中断可能持续数周至数月。
- 三度损伤同样涉及轴突的华勒变性,但还包括内膜的损伤。研究表明,轴突再生会偏离受损的内膜管并进入束内结构,可能导致神经瘤形成[8]。靶组织的功能性再支配可能发生,但并不完全,通常需要数月到数年的时间[5, 6, 8]。
- 四度损伤涉及华勒变性以及内膜的损伤,同时还包括束膜和神经外膜的损伤。此类损伤的严重程度使得再生轴突可生长至束外结构,导致生长终止[9] ,并可能促进神经瘤形成[5]。手术修复可提高获得有效功能恢复的可能性,但靶组织的再支配仍不完全[10]。
- 第五度损伤描述了神经的完全横断。若不进行手术修复,将导致完全丧失功能恢复,并伴有瘢痕和神经瘤形成。由于缺乏神经支架结构,轴突在损伤部位异常再生,无法继续向远端神经残端生长[11]。此外,受损的感觉神经产生的自发性和异常信号传导会导致神经病理性疼痛症状,这在截肢后残肢痛中常见[12, 13]。
一般来说,神经损伤程度决定了神经随时间再生的能力。较轻的神经损伤形式(即神经失用和轴突断伤)允许正常的神经再生,因为神经支架结构的结构变化较小,使得轴突能够更完全地再生。更严重的损伤(即伴有结构损伤的轴突断伤或神经断伤)会导致神经通路中断,从而使神经的功能性再生更加困难甚至不可能。
3.0 作用机制
3.1 冷冻神经溶解术、华勒变性与神经再生
冷冻神经溶解术是将低温直接应用于周围感觉神经,导致其发生二度损伤[7]。在此温度范围内的治疗会引起轴突的可逆性变性,变性从治疗部位开始并向远端方向发展[8]。华勒变性(轴突和髓鞘当神经暴露于‐20°C至‐100°C之间的温度时,会发生变性)[7]。损伤发生后,轴突在损伤部位开始变性过程,并向远端方向发展。形态学上,该过程表现为串珠样外观,随后在暴露部位及其远端的轴突出现颗粒状崩解[14]。同时,髓鞘经历变性阶段,巨噬细胞和施万细胞发挥作用以清除细胞碎片。随后轴突开始再生,施万细胞经历增殖和分化阶段,重新形成轴突的支架结构。神经元、施万细胞、巨噬细胞与周围环境之间发生多种细胞‐[3]信号因子相互作用,促进再生轴突的再生、再髓鞘化、延长和导向[[3, 8, 15‐19]
这些结构可作为支架,引导再生轴突实现最佳恢复,而轴突再生的可靠性依赖于周围内膜、束膜和外膜结构的完整性。信号因子促进轴突再生。因此,神经轴突能够沿着先前建立的路径再生,最终重新支配肌肉或感觉感受器[6, 22‐24]。再生以每天约1‐2毫米的速度进行。
相比之下,三度、四度和五度损伤(由低于‐100°C的温度、横断或热损伤引起)会导致不可逆神经损伤,破坏无细胞神经结构,有时还会导致神经瘤形成和异常轴突再生[7, 25]。
对周围神经在发生冷冻损伤后的行为学、电生理学和病理恢复的研究已使用多种动物模型进行[26‐28]。历史数据显示,外周神经在直接接触可释放低至‐120°C制冷温度的冷冻探针后,可在数月内恢复其结构和功能[29, 30]。最近一项针对成年雌性斯普拉格‐道利大鼠(n=27)单侧胫神经应用冷冻神经溶解装置的临床前研究显示,其组织学结果与既往采用不同冷冻温度的研究结果相似[31, 32]。苏木精和伊红(H&E)染色(图2)和免疫荧光(图3)均观察到轴突丢失,提示发生了华勒变性。组织学分析显示,在2周时出现脱髓鞘和轴突变性

治疗后数周,轴突和施万细胞出现紊乱,但损伤并未累及神经外膜和束膜。免疫荧光染色显示轴突逐渐再生和再髓鞘化。在16周时,轴突再生和再髓鞘化已完成,轴突密度测量显示本研究中已恢复至正常水平。对运动神经进行的低温治疗未导致神经功能和结构出现任何永久性或长期改变。暂时性的轴突丢失表现为经治疗的后肢运动功能丧失,导致脚趾伸展功能和行走步态出现完全可逆的功能缺陷。
导致特定感觉和运动周围神经发生华勒变性的冷冻神经溶解术可缓解由多种疾病状况引起的疼痛和运动功能障碍,且不会损伤周围组织。
3.2 治疗可重复性
最近的一项动物研究通过生理功能评估和组织学分析,评价了长期且重复的冷冻神经溶解治疗对坐骨神经的影响[21]。生理功能测量显示,每次治疗后脚趾伸展能力和运动功能均出现一致性的减弱,但在治疗后8周观察到完全正常功能的逐渐恢复。短期组织学结果显示,治疗后7天内发生轴突变性,而束膜和外膜结构保持完整。随后观察到进行性轴突再生,并在末次治疗后24周恢复至正常结构。重复治疗也表现出每次连续治疗后减弱和完全恢复的可重复模式。长期随访还表明神经再生稳定,形态学和功能上均未出现累积性变化。类似地,组织学结果发现所有动物的正常周围组织结构(肌肉、脂肪和血管)均完全恢复(图4)。

4.0 冷冻神经溶解术的安全性
使用一氧化二氮或二氧化碳进行的冷冻神经溶解术是一种本质上安全的技术,因为治疗温度不会低于任一气体的沸点(一氧化二氮:‐88°C;二氧化碳:‐79°C),从而确保所产生的神经损伤是可逆的,并且对结缔结构无影响。此外,已发现许多周围结构,如神经和血管的结缔组织以及骨骼,均能抵抗冻伤[33]。结果是神经和血管的细胞外基质及支架结构保持完整,使得受影响的轴突/髓鞘或血管细胞能够再生并修复损伤部位。相比之下,热损伤不仅会破坏细胞,还会破坏结构基质,导致治疗窗更窄[34‐36]。最近一项研究[20]表明,在发生创伤性周围神经损伤后,再生的髓鞘变薄且节间长度缩短。这归因于对重新分化的施万细胞刺激不足和/或抑制信号的作用。目前尚不清楚冷冻神经溶解术后再生是否会出现这种情况,因为已有研究表明治疗后的再生速率和功能恢复具有可重复性[21]。这种差异可能是由于冷冻神经溶解术后引发的化学级联反应与创伤性损害后的反应不同,因为冷冻神经溶解术引发的炎症反应有限。冷冻神经溶解术内在安全性的证据可从其长达半个世纪的历史中找到:在50多年的应用中,尚未有永久性神经损伤的发表病例,仅有一例治疗后出现神经炎的报告[37]。这些发现与周及同事[38]引用的一项研究结果一致,该研究中6,000名接受冷冻神经溶解术治疗急慢性下腰痛的患者均未报告后续出现神经瘤或神经炎。
动物研究中对神经和血管应用冷的组织学结果支持了这些数据。例如,一项针对大鼠进行单次或3次重复冷冻神经溶解治疗的研究显示,在治疗后8‐32周,血管、脂肪组织和周围肌肉均表现正常[21]。在同一项研究中还发现,靠近神经的小动脉在

4.1 副作用和禁忌症
冷冻神经溶解术的潜在副作用包括治疗部位的出血、瘀伤、发红和感染。不出所料,治疗神经的区域可能会出现感觉缺失区域。在治疗慢性疼痛时,提前进行诊断性阻滞可使患者在实施冷冻神经溶解术前体验治疗效果。冷冻神经溶解术的常见禁忌症包括患有冷球蛋白血症、冷荨麻疹和雷诺综合征的患者。
如果目标神经相对较浅,治疗部位附近的皮肤和毛发可能会受到影响。为了保护皮肤和毛发,一些专为浅表神经治疗设计的新型冷冻神经溶解装置配备了集成式皮肤加热器,可防止真皮层或毛囊发生坏死。然而,当使用未配备皮肤热保护功能的冷冻神经溶解装置时,可能出现皮肤色素沉着过度或减退,并在治疗部位出现脱发,尤其是在治疗眶上神经时,在眉毛区域尤为明显[37]。
5.0 技术现状
冷冻探针由一个空心套管组成,其内部包含一个较小的内套管。加压冷冻气体(约800磅/平方英寸)通过内套管输送,并释放到远端较大的外套管中。气体在套管尖端迅速膨胀,吸收周围热量,这一过程称为焦耳‐汤普森效应(图5)。由于温度下降,探针尖端形成冰球(图6A和图6B)。随后,气体通过外套管排出。通过这种方式,封闭端套管确保无气体注入体内。大多数冷冻探针均集成有热敏电阻以监测尖端温度,并采用绝缘设计,允许进行电流应用,结合神经刺激器辅助运动神经定位,并限制冰球仅在探针尖端形成。大多数冷冻探针包括近端绝缘部分和远端非绝缘部分,但有一种探针( Atricure‐美国,美国北卡罗来纳州罗利)为柔性且无绝缘设计,用于术中肋间冷冻神经溶解术。冷冻探针的尺寸和探针长度根据医疗需求而有所不同(表2)。冷冻探针可为可重复使用或一次性类型。
5.1 主机连接式设备
对于主机连接式设备,冷冻探针通过一根长的柔性管与控制台和冷冻剂罐相连(图7)。由于基于控制台的设备具有高气体压力,因此无论冷冻探针处于何种角度都能正常工作,且较大的制冷剂罐可支持更多的冷冻循环。所产生的冰球直径范围为3.5至5.5毫米[37]或直径6毫米[41]。可重复使用的探针和管路可通过蒸汽或气体进行灭菌(Epimed国际,美国德克萨斯州农夫分支),在欧洲则有一次性系统( MetrumCryoflex,波兰华沙)。这些控制台系统通常还包含感觉和运动刺激组件,可在清醒患者中实现更精确的感觉神经定位,并确认是否存在预期或非预期的运动刺激。这些系统的探针通常较大( 12至16规格),尽管目前也正在开发较小的系统(20至25规格)。一般来说,探针越大,
冰球越大,被纳入冰球内的神经就越多,这应能提高成功产生病灶的概率。然而,这种较大的探针可能更难放置,且在处理浅表神经时,较大的冰球也会增加皮肤损伤的风险。
一种用于术中肋间冷冻神经溶解术的新型控制台系统现已可用于治疗胸部手术后的术后疼痛;该系统采用柔性无绝缘探针,可沿其整个长度进行冷冻,在伤口闭合前将其沿神经走向放置(Atricure‐美国, 北卡罗来纳州罗利,美国)。由于探针具有柔韧性,可塑形以贴合肋骨轮廓。该系统仅在术中使用,为开胸手术后提供术后镇痛。
5.2 手持设备
目前,仅有一种手持式冷冻神经溶解设备:iovera°系统(Myoscience,加利福尼亚州弗里蒙特, 美国)。iovera°系统的冷冻探针直径范围为0.4‐0.7毫米,由电池供电的便携式手柄进行控制(图8)。治疗过程中,压缩一氧化二氮从一次性消耗品卡盒中流经绝缘手柄,用于冷却无菌、一次性、单患者使用的智能探头(图8)。当前可用的iovera°系统智能探头包括三针6.9毫米头端(27G)和单针55毫米头端(22G),其对应的冰球尺寸分别为5.7毫米×7.8毫米和9.4毫米×5.4毫米[42]。由于6.9毫米头端用于治疗浅表外周神经,因此设计了集成式皮肤加热器,以保护真皮和毛囊免受皮下血管闭塞及随之而来的皮肤坏死,这种情况可能发生在没有皮肤加热器的更大、连接控制台的探针使用时。
该手持设备可用于多种场景,但需要将患者摆放至适当体位,以确保手柄保持垂直,从而维持制冷剂的压力。尽管智能探头为无菌状态,手柄和一氧化二氮罐并非无菌。因此,在无菌环境中必须使用无菌套或生物闭塞性敷料作为隔离屏障。该设备不具备感觉或运动刺激功能,而且由于探头必须至少基本保持直立,可能需要采用超声或透视定位
然而,由于手柄具有便携性,且充电底座占用空间小,该设备可能更适合在办公环境、医院或多个科室共用手柄的门诊手术中心中使用。



6.0 临床应用
6.1 术后疼痛的围手术期治疗
术后疼痛是高达60‐90%的手术病例在术后24小时内面临的问题[43]。在某些情况下,疼痛往往难以控制达数天或数周。例如,接受全膝关节置换术(TKA)的患者通常会经历1‐2个月的显著术后疼痛[44‐ 46]。然而,最常用的镇痛药——阿片类药物——常伴随恶心、呕吐、瘙痒、呼吸抑制、镇静和肠梗阻等不良副作用[44, 46, 47]。此外,处方阿片类药物滥用的风险持续存在并不断加剧,据估计,美国每年因处方阿片类药物非医疗用途造成的经济成本超过530亿美元2011[48]。就在2014年,美国卫生与公共服务部指出,联邦机构应推广非阿片类药物治疗,作为整体疼痛管理计划的一部分[49]。此外,包括美国麻醉医师协会在内的多个组织也建议采用个体化多模式治疗方案来管理疼痛,以尽量减少阿片类药物需求[50, 51]。
冷冻神经溶解术可能是多模式镇痛方案的极佳补充,可提供强效的局部镇痛,其持续时间通常可达数周至数月。术前冷冻神经溶解术可能有助于减少手术前后对阿片类药物和非甾体抗炎药(NSAIDs)的需求。
例如,隐神经髌下支(IPBSN)是一种单纯的感觉神经,支配膝关节囊的前下方以及膝关节前内侧皮肤 [52‐56]。多项研究(包括两项随机、双盲、安慰剂对照试验)已探讨了对IPBSN进行选择性神经阻滞在治疗术后膝痛方面的有效性[57‐61]。特雷斯科特于2003年描述了采用冷冻神经溶解术治疗IPBSN相关膝痛的方法。2006年,伦德布拉德[62]建立了一种利用超声识别IPBSN并在其周围注射左布比卡因(奇洛卡因,艾伯特斯堪的纳维亚公司,索尔纳,瑞典)的技术。该方法的成功率达90%,阻滞持续时间通常超过16小时,因此可能适用于膝部外科手术后的术后镇痛。
尽管目前尚未发表关于冷冻神经溶解术的确定性研究,但已有来自局部麻醉剂诱导麻醉的证据表明,冷冻神经溶解术可提供术后镇痛效果。一项随机、双盲、安慰剂对照的临床试验(n=64)针对接受前交叉韧带(ACL)修复术的患者,在手术前10‐20分钟对隐神经髌下支(IPBSN)实施左布比卡因(奇洛卡因,艾伯特斯堪的纳维亚公司,索尔纳,瑞典)阻滞[57]。术后16‐24小时,阻滞组疼痛评分高于3分(满分10分)的患者比例低于假手术组(P=0.0117)。另一项类似的随机、双盲、安慰剂对照临床试验(n=68)针对接受单纯膝关节镜手术的患者,结果显示在手术前接受IPBSN局部麻醉阻滞的患者,其术后早期数字评分量表(NRS)疼痛评分(术后即刻和1小时)显著降低(P=0.03)[58]。这些患者在治疗后12周还报告了更少的恶心症状以及显著改善的莱什霍尔姆膝关节评分(活动水平的衡量指标)(P=0.03和P=0.04)。
一项概念验证研究表明,冷冻神经溶解术也可用于有效阻断隐神经髌下支(IPBSN)至少30天[63]。在该研究中,通过解剖标志定位IPBSN[54]。随后,采用一种方法定位支配大腿前上部的股前皮神经( AFCN)。膝关节囊,并可能提供额外的术后缓解,在尸体模型[64]中进行了定义和验证。
一项近期对100名接受全膝关节置换术(TKA)的患者的回顾性病历审查比较了冷冻神经溶解治疗组与历史对照组。其中一半患者在TKA术前五天接受了针对IPBSN和AFCN的冷冻神经溶解治疗( iOvera°系统,Myoscience,加利福尼亚州弗里蒙特,美国)。另一半患者接受了相同的标准化围手术期和术后护理,但未接受冷冻神经溶解治疗(非随机化)。在术后12周内,冷冻神经溶解治疗组所消耗的阿片类药物吗啡当量平均值(2069mg)低于对照组(3764mg;P<0.0001)。冷冻神经溶解治疗组的平均住院时间也短于对照组(0.8天vs.1.7天;P<0.0001)。尽管两组在疼痛和功能评分方面表现相似,但接受冷冻神经溶解治疗的患者仅需使用一半剂量的阿片类药物即可达到相似的镇痛效果。此外,冷冻神经溶解治疗组的住院时间更短,并且在术后6周(p=0.0037)和12周(p=0.0011)时,通过膝关节损伤和骨关节炎转归(KOOS)症状子评分评估,其症状改善程度显著优于对照组。
一项随机、双盲、假手术对照试验目前正在重新检验这些发现,并采用前瞻性实验研究设计( http://www.clinicaltrials.gov;NCT02284113)。该研究还将测量患者满意度和康复终点,如关节活动范围和行走能力。本文提出的结果表明,冷冻神经溶解术可能作为全膝关节置换术多模式镇痛方案的一部分具有前景,并且可能是减少术后阿片类药物使用和住院时间的有效且安全的方法。
其他随机对照试验表明,冷冻去神经术可显著减少开胸手术[65]和扁桃体切除术[66]后持续性术后疼痛和/或阿片类药物需求。
6.2 术后冷冻神经溶解术
TKA术后持续性神经卡压和神经痛并不少见,部分原因是止血带[67]对神经造成的创伤,部分原因是手术本身[52]对膝部神经造成的创伤;这可能导致全膝关节置换术效果不佳。
最近报道了一例冷冻神经溶解术治疗全膝关节置换术后顽固性膝痛的病例。在全膝关节置换术后3个月,该75岁女性患者报告明显的膝关节僵硬和难以缓解的疼痛。她还表示由于膝痛导致日常活动困难且影响睡眠。经过33次个体化术后物理治疗后,患者因未见进展而被终止治疗;尽管其X光片显示为对线良好且固定牢固的骨水泥型全膝关节置换术,但仍计划接受全身麻醉下膝关节手法松解。经与外科医生讨论后,在门诊使用iovera°系统(Myoscience,加利福尼亚州弗里蒙特,美国)对隐神经髌下支(IPBSN)进行冷冻神经溶解治疗,采用解剖标志和超声引导神经定位。治疗后15分钟,疼痛视觉模拟评分(VAS)从基线时10/10降至0/10。在接受冷冻神经溶解治疗后,患者允许对其膝关节进行积极的松解,伸展和屈曲范围均有所增加。经共同决定,取消即将进行的手术,并重新开始物理治疗。10周后随访时,患者已能参与强化的家庭锻炼计划,关节活动范围和功能得到改善,并对手术结果非常满意。
在第二个病例报告中,一名59岁肥胖男性在双侧全膝关节置换术后出现持续3个月的严重的持续性双侧大腿疼痛。他被诊断为由于股外侧皮神经(LFCN)卡压引起的股外侧皮神经卡压综合征,但物理治疗无效且多种镇痛方案均未见效。使用Myoscience,加利福尼亚州弗里蒙特,美国生产的 iOvera°系统,在超声引导下对双侧神经进行了冷冻神经溶解术。患者术后立即感到疼痛缓解,并在3个月随访时报告VAS疼痛评分为2/10。
术后冷冻神经溶解术的其他用途包括治疗疝修补术后疼痛、[70]以及开胸手术后疼痛[71] 。冷冻神经溶解术可能是治疗这些疼痛的有效方法,且应在考虑更具侵入性的解决方案之前予以考虑。随着对围手术期冷冻神经溶解术兴趣的增加,可能会出现其他适应症。
6.3 慢性疼痛的治疗
感觉性周围神经的冷冻神经溶解术已应用数十年,用于治疗慢性疼痛[37, 72‐75]。许多患者由于疼痛限制了其完成某些活动的能力,导致康复效果不佳。然而,冷冻神经溶解治疗可使患者在无痛状态下进行康复训练,从而提高完成物理治疗的能力。由于冷冻神经溶解术允许神经完全再生,患者在治疗后可恢复功能。非对照研究表明,冷冻神经溶解术可缓解多种疾病患者的疼痛,包括带状疱疹后神经痛 [76],、枕神经痛[77],和神经瘤[78‐80], ,以及难治性面部疼痛[29, 75, 81‐83], 、颞下颌关节[84], 、腰椎小关节[85], 、肋间神经痛[86, 87], 、足底筋膜炎[88], 、幻肢痛[89],以及会阴和盆腔疼痛[90]。疼痛缓解持续时间从两个月到数年不等[75, 81]。超声引导提高了冷冻神经溶解术的定位准确性,从而提升了治疗效果[91]。
6.4 腰椎小关节疼痛的治疗
最近有三项前瞻性临床试验描述了使用冷冻神经溶解术治疗腰椎小关节疼痛的情况。其中一项针对46例患者的研宄显示,接受冷冻神经溶解术治疗(LloydNeurostat2000,斯彭布利医疗系统,英国汉普郡)后,患者的平均疼痛VAS评分从基线时的7.7显著下降至6周时的3.2,3、6和12个月时分别为3.3、 3.0和4.2(p<0.0001)。唯一的并发症是迷走神经性晕厥。
另一项研究[93]表明,在接受冷冻神经溶解术(LloydNeurostat,斯彭布利医疗,英国汉普郡)治疗的50名患者中,62%的患者疼痛减轻超过50%(被视为有效)
在1年后,76%的患者VAS疼痛评分降低了3分或以上。研究结果还显示,在未接受过脊柱手术的患者中,有85%为应答者,而在接受过既往脊柱手术的患者中,仅有47%为应答者。此外,在冷冻神经溶解术前无法工作的患者中,有64%在治疗后恢复了工作。所有50例患者(包括应答者和非应答者)在各次术后随访中的平均VAS评分均有显著改善,且治疗未出现任何并发症。
一项后续研究[94]利用计算机断层扫描在76例患者中定位内侧神经支,然后进行冷冻神经溶解治疗( SpemblyMedical,英国汉普郡)。结果与之前的研究一致,即在治疗1年后,56%的患者为应答者(疼痛VAS降低>50%),应答者的疼痛缓解中位持续时间为14个月。同样,研究发现,对于相关脊柱节段无既往手术治疗的患者,其疼痛缓解持续时间明显长于曾接受过手术的患者(p<0.03)。此外,61%的患者减少了止痛药物的使用,而停止工作的患者中有29%在治疗后能够重返工作岗位。部分患者接受了第二次(n=18)、第三次(n=7)和第四次(n=1)治疗,其疼痛缓解持续时间与首次治疗相似(p<0.05)。整个研究人群中,没有患者报告任何副作用。
6.5 骨关节炎继发性慢性膝关节疼痛的治疗
一项小规模的概念验证研究(n=10)采用解剖标志[63, 64],考察了对隐神经髌下支进行冷冻神经溶解术治疗骨关节炎所致慢性膝关节疼痛的效果。使用iOvera°系统(Myoscience,加利福尼亚州弗里蒙特,美国)治疗后,平均疼痛评分(NRS)从基线的6分分别降至治疗后0天、7天和30天的1分、2分和2分。在治疗后7天和30天时,90%的患者表示愿意再次接受该治疗。这些结果与一项未发表的临床试验(http://www.clinicaltrials.gov;NCT01704157;Myoscience,存档数据)一致,该试验中33名膝关节骨关节炎成人患者接受了隐神经髌下支的冷冻神经溶解术。治疗后7天时
治疗后,91%的受试者疼痛减轻;治疗30天后,0‐10疼痛数字评分平均降低4分(p<0.0001)。77%的受试者每题平均西安大略和麦克马斯特大学骨关节炎指数(WOMAC)改善≥2分,总分降低86分,较基线改善70%(p<0.0001)。一项随机、双盲、假对照试验正在进行中,以提供确凿数据( http://www.clinicaltrials.gov;NCT02260921)。
6.6 痉挛的治疗
痉挛是一种运动障碍,常见于中风、创伤性脑损伤、脊髓损伤、脑瘫和多发性硬化患者[95]。痉挛的临床表现包括肌肉痉挛、不自主抽动、反射亢进以及肌肉和关节僵硬[95]。明显的痉挛及相关异常姿势可引起疼痛和力量丧失、灵巧性下降、活动范围受限;影响日常活动和睡眠;干扰步态与平衡;并损害生活质量[95, 96]。
目前治疗痉挛的方法包括口服药物、鞘内巴氯芬和苯酚、酒精或肉毒杆菌毒素的局部注射。尽管这些治疗方法均可能有效,但每种方法都有其局限性。口服药物会引起全身副作用,且不适合用于治疗区域或局灶性痉挛[97]。鞘内给药可降低全身副作用的发生率,但具有侵入性且成本较高[97]。苯酚或酒精注射常伴有疼痛,并可能导致组织坏死和感觉异常[97]。肉毒杆菌毒素在治疗大肌肉时效果可能有限,可能导致临床耐药,并存在扩散至非目标肌肉的风险,从而引起非预期的肌肉无力[98, 99]。
6.6.1 运动神经的治疗
最近两项临床前研究报告描述了使用冷冻温度治疗运动神经以潜在治疗运动障碍的可行性[21, 32]。第一项研究[32]表明,冷冻神经溶解术
对大鼠胫神经的治疗导致后肢生理功能暂时性(8周)下降。神经的组织学观察显示,治疗后2周出现脱髓鞘和轴突变性,随后在治疗后16周实现完全轴突再生和再髓鞘化。神经的功能和结构未出现永久性或长期改变。第二项研究的结果[21]确定,即使经过多次治疗,动物在治疗区域及其周围的所有神经和组织均实现了完全再生,且无纤维化活动或瘢痕组织形成。
6.6.2 上肢痉挛的治疗
使用酒精或苯酚进行神经松解术治疗痉挛已有多年历史,但药物意外扩散的风险限制了其应用。自1998[100],以来,文献中已有冷冻神经溶解术用于治疗痉挛的病例报告,而冷冻神经溶解术的精确神经溶解能力可能具有重要价值。一项小型概念验证研究探讨了冷冻神经溶解术在治疗上肢痉挛中的应用 [101]。在两个不同中心的19名患者接受了肌皮神经的冷冻神经溶解治疗(iOvera°系统, Myoscience,加利福尼亚州弗里蒙特,美国);通过超声和/或神经刺激定位神经。治疗后1周和4周,分别有74%和79%的患者在改良Ashworth量表(MAS)上显示出至少1分降低。在4周随访时的应答者中,20%出现1分降低,27%为2分降低,47%为3分降低,7%为4分降低。所有治疗后时间点,患者在改良Ashworth量表(MAS)、Tardieu量表V1和V2以及痉挛数字评分量表(NRS)上均表现出统计学显著的临床改善。最常见的副作用是治疗部位的瘀伤、肿胀和局部疼痛。尽管这项针对冷冻神经溶解术治疗上肢痉挛的首次检查显示了统计学显著的临床改善,但仍需进一步研究。
7.0 专家评论与五年展望
冷冻神经溶解术是一种经过充分验证的技术,拥有50多年的证据支持。然而,由于缺乏培训项目,该技术一度不再流行。新型冷冻神经松解技术的出现、对周围神经病变可能导致持续性疼痛问题的认识,以及相关领域的发展相结合,推动了该技术的重新应用。
外周神经的超声定位,以及认识到积极的术前疼痛管理可以预防长期疼痛状况,这些因素共同导致了对冷冻神经溶解术的兴趣重新兴起。该技术具有可逆性、持久性,且在诊所或手术室中易于实施,可提供疼痛缓解。
随着减少阿片类药物使用的趋势不断加强,冷冻神经溶解术在治疗慢性或术后疼痛方面的吸引力日益增加,因其已被证明具有比全身药物治疗方案或其他神经溶解疗法更优越的安全性。冷冻神经溶解术还可能为运动障碍(如痉挛)提供治疗选择。此外,冷冻神经溶解术可能成为一种经济上更具吸引力的治疗方式,特别是在术后疼痛治疗方面,因为它有可能减少与阿片类药物相关的副作用、急性护理机构费用、医院获得性感染,并促进更早重返工作。
8.0 结论
冷冻神经溶解术是一项成熟的技术,已使用50多年,并已被证明是外周感觉神经治疗的一种安全有效的选择。新的技术进步(如手持式iovera°系统)使得治疗更加灵活且侵入性更小,或许更适合治疗浅表神经。这促使人们重新关注冷冻神经溶解术作为治疗急性和慢性疼痛以及潜在运动障碍的手段。本文所呈现的临床证据突显了在不断变化的医疗环境中,冷冻神经溶解术在外周神经治疗方面可能产生的影响。





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








