第2章 阳极氧化:一种用于骨科应用的钛基植入物的有前景的纳米改性技术
2.1 引言
人们已做出许多尝试来改善钛基植入物的表面特性(例如,形貌、化学成分和表面能),这些特性直接决定了植入后植入物‐环境相互作用 [1–3]。这些表面改性技术包括机械方法(例如,喷砂)、化学方法(例如,酸蚀)、涂层(例如,等离子喷涂)等 [4–9]。通过这些传统方法,由于形成了理想的微米级表面粗糙度、更有利的表面化学成分和/或成骨细胞偏好的新形貌,已实现了与骨更好的结合能力。然而,这些机械和化学方法均无法产生可控的表面形貌。此外,这些方法有可能形成表面残余。因此,迫切需要替代方法来改性钛表面,以促进新骨生成。
其他改善骨结合的方法包括在钛基植入物表面涂覆羟基磷灰石(HA)或其他磷酸钙,通常通过等离子喷涂 [2] 实现。这是因为羟基磷灰石和其他磷酸钙是骨组织的主要无机成分,并已被多项研究证实可直接与邻近骨结合 [10–13]。然而,此类涂层由于与金属基底的粘附力较弱以及植入后发生溶解,常出现长期失效问题。因此,在骨科应用中,迫切需要一种可将羟基磷灰石牢固沉积于钛表面并具有最佳生物活性的替代方法。
在这方面,目前的一种策略是使钛基植入物具有纳米级表面特征,因为天然骨是一种纳米结构材料。需要注意的是,I型胶原蛋白(骨的有机基质)是一种三螺旋结构,长度为300 nm,宽度为0.5 nm,周期性为67 nm,而 HA(骨的无机矿物相)长约20–40 nm。此外,羟基磷灰石晶体在胶原网络中呈现出独特的排列模式[14]。这些表明,骨细胞可能更适应纳米尺度而非微米尺度的环境。最近观察到,人成骨细胞最初会黏附在纳米相钛和普通钛的晶界上;在表面具有更多晶界的纳米相钛上,成骨细胞黏附更为显著[15]。
然而,这种纳米相钛(纳米颗粒压坯)通过冶金技术制备后的机械强度不足以作为钛合金等块体材料使用。因此,针对现有钛基植入物的合适纳米表面改性方法正在被积极研究。
一种称为阳极氧化或阳极氧化的电化学方法,是用于阀金属以生成保护层的成熟表面改性技术[4]。在过去的几十年中,该方法已成功用作骨科植入物的表面处理,并且近年来取得了一些新进展。本章将概述阳极氧化技术,并讨论与骨科应用相关的阳极氧化钛的工艺参数、微观结构和成分以及生物学反应。最后,本章还将探讨具有纳米结构的阳极氧化钛上增强的成骨细胞功能的机理。
2.2 钛的阳极氧化
2.2.1 阳极氧化过程基础
典型的阳极氧化工艺包括碱洗、酸活化和电解液阳极氧化。酸活化是在硝酸和氢氟酸(HF)用于去除天然二氧化钛层和表面污染物。电解质阳极氧化在电化学池中进行,通常采用三电极构型(钛阳极、铂阴极和Ag/AgCl参比电极)。当在阳极和阴极之间施加恒定电压或电流时,电极反应(氧化和还原)结合场驱动离子扩散,导致在阳极表面形成氧化层。
主要化学反应特别针对钛阳极氧化列于下(2.1)–([4])。
在Ti/Ti氧化物界面:
Ti, Ti2þ þ 2e ð2:1Þ
在Ti氧化物/电解质界面:
2H2O, 2O2 þ 4Hþ ð2:2Þ
2H2O, O2 þ 4Hþ þ 4e ð2:3Þ
在两个界面处:
Ti2þ þ 2O2, TiO2 þ 2e ð2:4Þ
由于二氧化钛的电阻率高于电解质和金属基底,施加电压主要降落在阳极的氧化膜上。只要电场足够强以驱动离子通过氧化膜传导,氧化膜就会持续生长。这解释了为何最终氧化膜厚度d几乎与施加电压U呈线性关系:
d aU ð2:5Þ
其中a通常是一个在1.5–3 nm/V [4]范围内的常数。
2.2.2 工艺参数的影响
阳极氧化后所得氧化膜性能(如纳米粗糙度程度、形貌、化学成分等)随施加电位(电压)、电流密度、电解液组成、pH值和温度等不同工艺参数而在较宽范围内变化。磷酸‐H3PO4,、硫酸‐H2SO4,、乙酸‐CH3COOH及其他酸类、中性盐和碱性溶液均被广泛用作钛阳极氧化的电解质。Sul 等人[16]研究了这些电解质在钛表面详细的电化学氧化层生长行为。通常发现,在所有电解质中(包括 H3PO4, H2SO4, CH3COOH 和 NaOH、Ca(OH)2中,H2SO4中的阳极氧化物厚度最高。重要的是,酸性电解液中的氧化物形成能力超过了氢氧化物溶液。通常,H3PO4和 H2SO4被用于在高电压下生成厚(数十微米)且具有微孔结构的氧化层。相比之下,近年来发现含氟溶液能够形成具有生物启发性的纳米管结构 [17–25]。由于上述讨论的纳米结构在生物应用中的重要性,本节将对此进行讨论。
阳极氧化过程可以在恒定电压(恒电位的)或恒定电流(恒电流的)条件下进行。如果施加电压超过氧化物的介电击穿极限,氧化物将不再具有阻止进一步电流流动和氧化层生长的电阻性,从而导致更多的气体析出和火花放电。因此,该技术被称为阳极火花沉积(ASD)或微弧氧化(MAO)。
例如,有报道称H3PO4和H2SO4的击穿电位分别约为80伏特和100伏特[26]。在低于击穿极限的情况下,使用非氟化电解质所形成的阳极氧化膜相对较薄且通常无孔。
阳极氧化过程中通常需要保持恒定温度,以在整个区域维持均匀的场增强溶解。由于温度升高会加快化学溶解速率,因此工作温度通常保持在相对较低的水平,以防止氧化物完全溶解[26]。
2.2.3 粗糙表面的制备
阳极氧化技术于20世纪30年代初被发现,并在20世纪60年代得到广泛研究,以增强钛植入物的骨整合[27]。这些研究通常采用高电压阳极氧化(即 ASD),将钛置于电解质溶液中进行处理,使电解质中的离子嵌入氧化层,从而形成微孔结构[27–35]。表2.1列出了部分ASD研究中的阳极氧化参数。
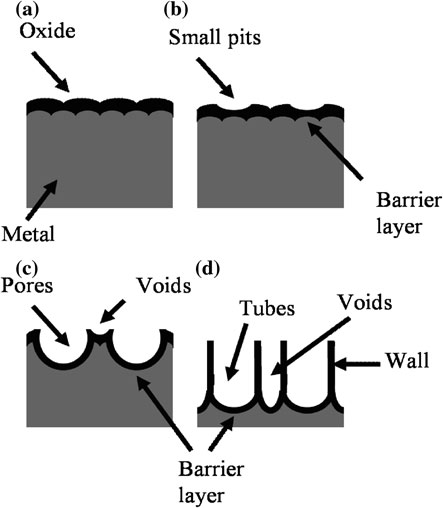
ASD的机理通常由雪崩理论描述。在阳极氧化过程中,阳极上新形成的氧化层对电流起到介电屏障的作用,并持续生长直至达到介电击穿极限。一般来说,由于存在缺陷、局部应力和不均匀氧化膜厚度等因素,阳极氧化层并不均匀。当施加电压增加时,薄弱点处的电势降超过介电极限,从而引发火花放电。这些位置的局部温度可高达数千开尔文,导致局部熔化过程。阳极氧化钛的热应力促使薄弱点倍增,即形成级联过程,并导致介电质击穿。图 2.1 所示了崔等人提出的多孔二氧化钛形成的示意图。[26]。
基本上,阳极膜生长由氧化膜形成速率与电解质性质决定的氧化物溶解速率之间的平衡所决定。同时,电解质的性质与其他工艺参数密切相关,如电解液浓度、施加电压、电流密度、pH值等。详细解释可参见 elsewhere [16]。
| 电解液组成 | 摩尔浓度 | 电压 (电流) | 时间(秒) | 温度 (°C) | 参考 |
|---|---|---|---|---|---|
| 硫酸 | 1 | 125 | – | – | 津等格尔 [28] |
| 硫酸 | 0.5, 1, 3 | 90, 155, 180 | – | – | 杨等 [29] |
| 乙酸 | 1 | 80 | – | RT | 拉尔松等 [30] |
| 乙酸 | 0.1 | 40–80 | 8–67 | 17 | Sul 等人 [16] |
| 磷酸 | 2 | 175 | – | 25 | 津格尔 等 [28] |
| 磷酸 | 0.2 | 200, 300, 350 (70 A/cm2) | – | 20 | 朱等人 [31] |
| 磷酸 | 1 | 40–80 | 10–47 | 17 | Sul 等人 [16] |
| 钠 三聚磷酸盐 | 0.15 | (210 A/cm2) | – | – | 基耶萨 等 [27] |
| 氢氧化钠 | 5 | 10–20 | – | 25 | 黄等 [66] |
| 氢氧化钠 | 0.1 | 40–80 | 22–110 | 17 | Sul 等人 [16] |
| 氢氧化钙 | 0.1 | 40–80 | 13–53 | 17 | Sul 等人 [16] |
| 钙 甘油磷酸盐 and 乙酸钙 | 0.02/0.1 | (70 A/cm2 ) | 1530 | 4.1–4.5 | 基耶萨 等 [27] |
| 钙 甘油磷酸盐 and 乙酸钙 | 0.03/0.15 | 200, 260, 300 (70 A/cm2 ) | 20 | 朱等人 [31] | |
| 钙 甘油磷酸盐 and 乙酸钙 | 0.15/0.02 | 190–600 | 180 | – | 李等人 [32] |
| 钙 甘油磷酸盐 and 乙酸钙 | 0.02/0.15 | (70 A/cm2 ) | 1800 | – | 苏等人 [33] |
| 钙 甘油磷酸盐 and 乙酸钙 | 0.02/0.15 | 350 | 1200 | 20 | 孙等人 [34] |
| β‐甘油磷酸盐和 乙酸钠 | 0.06/0.3 | 250–350 (50 安培/平方厘米2 ) | – | – | 菲尼等人 [35] |

2.2.4 纳米粗糙度的形成
尽管通过钛阳极氧化生成微结构的技术已经很成熟,但目前的研究重点是创建受生物启发的纳米表面结构。研究表明,可在铬酸中通过钛阳极氧化在 10–40 V[36]下形成多孔纳米结构。通过钛阳极氧化获得的另一种独特表面形貌是自有序纳米管结构[17–25]。在这些研究中,使用含氟电解质溶液,且施加的电压必须远低于介电击穿电压。用于创建钛纳米结构的一些具体阳极氧化参数列于表 2.2中。
Zwilling等人首次报道了在相对较低的电压下,需要氟离子在钛表面形成多孔二氧化钛纳米结构[37]。然而,该研究并未报道纳米管结构。1999年, Grimes及其同事通过在稀释(0.5–1.5 重量%)的水性HF溶液中对钛进行阳极氧化(10至40伏特之间),成功制备出自有序的纳米管阵列[17]。研究发现,纳米管直径由施加电压决定,而管的最终长度与阳极氧化时间无关。
在20伏特下,使用0.5% HF溶液处理20分钟,纳米管直径约为60纳米,管长为200纳米(图2.2)。随后,他们开发了一种通过在0.5 % HF中线性改变电压从10至23 V来制备锥形、圆锥状二氧化钛纳米管的方法(图2.4)[18]。
Schmuki及其同事还观察到在HF/H2SO4或CH3COOH/NH4F电解质溶液中自组织的纳米管状二氧化钛薄膜[19]。
此外,纳米管结构(纳米孔结构)也在有机电解质中实现。Choi等人利用纳米压痕钛在乙醇HF溶液中进行阳极氧化,制备出具有500纳米孔间距的孔阵列(图2.3 和 2.4)[26]。Schmuki’团队报道了使用非水混合物制备的纳米管结构乙醇和氟化铵的氟化物,且未进行印迹处理[20]。然而,在这些研究中,二氧化钛纳米管的深度仅限于几百纳米。最近,格赖姆和施穆基的研究团队均报道了长达数微米的高长径比二氧化钛纳米管’s’团队[21–24]。格赖姆’团队报道了在pH 4.5的NaF或KF溶液中通过钛阳极氧化形成长达4.4 μm的二氧化钛管阵列(图2.5)[21]。他们还报道了使用DMSO/乙醇/HF电解质制备出厚度达2.3 μm的纳米管结构(图2.6)[22]。与此同时,施穆基’团队成功利用中性氟化物溶液制备出长达2.5μm的纳米管结构[23]。他们通过调控电化学参数以增强纳米管底部的酸化过程实现了这一结果。
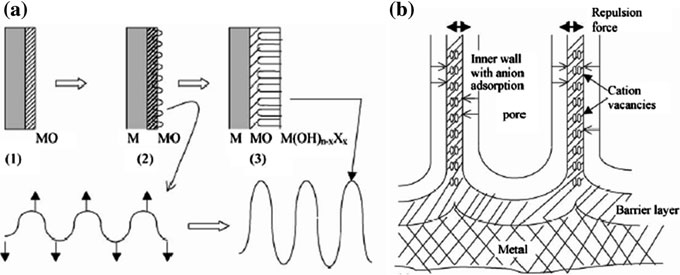
化学溶解、场助溶解和氧化是氟电解质阳极氧化中的三个主要反应。其中,场增强溶解被许多研究人员认为是二氧化钛管状结构形成的主导机理[17– 24]。纳米管的演化结构如图 2.7所示。Grime 和同事基于点缺陷模型提出了一种机理 [18]。
Grime 提出,初始孔形成是由于在薄弱点处的局部溶解所致,并且孔之间会存在未阳极氧化的金属部分。随后,在这些孔间区域通过电场增强的氧化/ 溶解作用形成空隙(图2.8)。空隙与孔保持平衡生长,最终形成纳米管结构。然而,该理论未能解释空隙是如何产生的,以及如何导致孔分离成独立的单个纳米管。最近,Raja 等人[25]提出,氧化层的不稳定性以及自有序结构可以通过扰动理论来解释;二氧化钛层中单个纳米管从相互连接的纳米孔中分离出来可能是由于阳离子空位的排斥力所致(图 2.9)。
| 电解质(pH值) | 电压 (V) | Time (h) | 温度 (°C) | 厚度 (nm) | Pore 直径 (nm) | 参考 |
|---|---|---|---|---|---|---|
| CH3COOH 和 0.5 摩尔 氢氟酸 | 10 | 4 | – | 60 | 500 (inter) | Choi等 [26] |
| 0.5 或 1.5%氢氟酸 | 10–40 | <1 | 18 | 250 | 25–65 | Gong等 [17] |
| 0.5 % HF | 10–23 | <1 | – | 300 | 22–76 | 莫尔等人 [18] |
| KF 和 NaF (4.5) | 25 | 20 | – | 4400 | 115 | 蔡等人 [21] |
| DMSO 和 CH3COOH 和 4 % HF | 20 | 70 | RT | 2300 | 60 | Ruan 等[22] |
| 1 M H2SO4和 0.15% HF | 30 | 24 | – | 540 | 140 | 贝拉内克 等[19] |
| CH3COOH 和 0.5 % NH4F | 20 | 1 | – | 200 | 30 | 土等屋[20] |
| 1 M (NH4)2SO4 和 0.5 % NH4F | 20 | – | – | 2500 | 100 | Macak 等[23] |
| 1 M (NH4)H2PO4 和 1 M H3PO4和 0.5 % HF | 20 | 40 | – | 4070 | 50 | Ghicov 等[24] |
| 0.138 M HF 或 NaF + 0.5 M H3PO4 | 20 | – | 24 | 500 | 100–120 (外层) | Raja 等人 [25] |






2.2.5 化学成分对照组
电解质中含有的离子通常存在于较厚的多孔ASDfilm中,且这些元素的浓度从外层向基底方向逐渐降低[31]。例如,在使用H3PO4电解质进行阳极氧化后,发现磷被嵌入到二氧化钛层中[38]。对于含有钙和磷的电解质,如甘油磷酸钙(Ca‐GP)和乙酸钙(CA),氧化层中同时含有钙和磷,其Ca/P比接近羟基磷灰石(HA)的1.67[39]。经过额外的水热处理(例如高压蒸汽),羟基磷灰石晶体随机析出在阳极氧化物film表面。这些羟基磷灰石晶体通常呈柱状或针状(图2.10)。这可能是由于

另一种制备HA涂层的方法,而非等离子喷涂。与等离子喷涂羟基磷灰石相比,此类HA涂层的优势将在后续章节中讨论。
另一种报道的方法是将结晶二氧化钛浸入模拟体液中(SBF)以在阳极氧化钛上形成磷灰石层,因为具有锐钛矿和金红石型二氧化钛表面的阳极氧化钛已被证明可在体外诱导磷灰石形成。杨等[29]在H2SO4阳极氧化后将钛金属浸入SBF中6天,观察到均匀的磷灰石形成(图2.11)。该方法的一个优点是所得磷灰石层的组成和表面形貌与天然骨非常接近,但此类涂层的粘附强度尚不明确。

同样,采用两步法在具有纳米管结构的阳极氧化钛上制备纳米级羟基磷灰石[40]。具体而言,将阳极氧化钛用氢氧化钠处理,在纳米管壁顶部边缘形成生物活性钛酸钠结构的纳米纤维,然后将其浸入模拟体液中以诱导生成纳米级羟基磷灰石(图图2.12)。该技术可用于在钛基植入物上构建结合良好的生物活性纳米羟基磷灰石层,其尺寸和形状可模拟骨骼中的天然羟基磷灰石。先前的研究支持在阳极氧化钛结构上引入纳米羟基磷灰石的优势,研究表明,与传统的微米晶粒尺寸羟基磷灰石相比,纳米羟基磷灰石能显著增强成骨细胞功能[14]。

2.3 阳极氧化氧化膜的结构与性质
2.3.1 结构
ASD膜的结构和性能被Kurze等人广泛研究。[38]ASD得到的二氧化钛层典型形貌为粗糙多孔,并带有裂纹(图 2.13和 2.14)。孔的尺寸从几百纳米到几微米不等,具体取决于工艺参数,在同一阳极氧化表面上也不均匀。此外,这些孔相互连通并具有层状结构,即彼此重叠。孔的形状大多为圆形或不规则形。据报道,随着电流密度增大(图 film粗糙度增加(图 2.13),[27, 41]施加电位升高(图 2.14)以及电解质浓度增加[29],孔径也随之增大。氧化物膜的厚度随时间增加,可达数十微米。
相比之下,生物仿生纳米管结构具有高度有序性。孔径由电压决定,可在几十纳米到约100纳米范围内调节。管状结构氧化层的厚度最初形成时为几百纳米,但通过控制pH值和电解质,可将其延长至几微米。通常情况下,同一试样内纳米管结构的尺寸是均匀的,但由于基底表面缺陷等差异,也可能存在变化。


2.3.2 耐腐蚀性与粘附强度
阳极氧化后,保护性氧化层的厚度增加,这可以减少在人体内的离子释放。氧化阻挡层(相对较薄的多孔氧化结构下方的非多孔氧化层)被认为有助于提高耐腐蚀性。然而,有研究表明,随着火花涂层厚度的增加,植入物的机械性能可能会受损 [27]。
阳极氧化层与钛基体之间的界面通常没有显示出任何不连续性[27]。此外,经过水热处理的钛表面上的羟基磷灰石晶体逐渐生长,并消耗阳极膜中的钙和磷。因此,基底、阳极膜以及羟基磷灰石膜之间的界面非常牢固。据报道,阳极氧化膜与钛基体之间的粘附强度为25 MPa[42] ,而石泽和小木 [39, 43]在使用低浓度电解液的情况下,报道了水热处理后氧化物/羟基磷灰石涂层与基底之间的粘附强度高达40 MPa。这些数值等于或高于等离子喷涂羟基磷灰石在钛表面的粘附强度,后者根据不同的工艺参数被报道在 15至30 MPa之间[44, 45]。此外,阳极氧化后经水热处理生成的羟基磷灰石 (AH‐HA)似乎比等离子喷涂羟基磷灰石(PS‐HA)更稳定。据报道, PS‐HA在模拟体液中的剪切强度在4周后从28.1 MPa下降至20.4 MPa[46];与此同时,石泽等发现AH‐HA在4周后仍保持较高的耐久性
在模拟体液中300天[39]。因此,从机械性能角度来看,水热处理的阳极氧化钛将比羟基磷灰石等离子喷涂钛更优。
2.3.3 阳极氧化钛的生物学特性
2.3.3.1 体外研究
显然,涂层强度、机械性能等并非骨科植入物唯一需要关注的问题,还需评估其细胞相容性以及促进骨生长的能力。大多数研究报道了体外条件下骨细胞对阳极氧化及阳极氧化后水热处理钛表面的反应。菲尼等人报道,在非阳极氧化钛、钙磷富集阳极氧化钛以及阳极氧化并水热处理钛表面,成骨样细胞(HOS‐TE85,人骨肉瘤细胞系)的粘附、铺展、增殖和分化情况相似 [35]。然而,在后两种基底上观察到未贴壁细胞数量意外增加,但未贴壁细胞的比例处于10–20%范围内,这在细胞相容性材料中属于正常范围。相比之下,罗德里格斯等人[47]使用成骨前体细胞系(ATCC, CRL‐1468)进行为期8天的研究发现,阳极氧化并水热处理钛表面的骨钙素产生量增加,但在对照钛表面碱性磷酸酶(ALP)活性最高。骨钙素和ALP均为成骨细胞分化以沉积钙的标志物。他们解释说,ALP活性的降低部分归因于成骨前体细胞的成熟,部分归因于矿化基质生成的增加。李等人同样使用Ca‐GP和 CA作为电解质,报道当阳极氧化电压超过190 V时,成骨性的MG63细胞增殖减少;然而,当电压高于300 V时,人骨肉瘤细胞系的碱性磷酸酶活性增加[32]。
朱等人 [31]研究了阳极氧化钛表面的形貌与成分对成骨细胞(Sa OS‐2,源自人骨肉瘤)反应的影响。他们的细胞实验显示,在由Ca‐GP和 CA组成的电解质中进行阳极氧化后,无细胞毒性,并且细胞贴附和增殖增加。具有微孔的表面上的细胞呈现不规则多边形生长以及更多的片状伪足,而对照钛表面上的细胞则显示出大量粗大的应力纤维和强焦点接触。然而,他们未发现碱性磷酸酶活性存在显著差异。苏等人 [33]研究了类似于朱氏配方的水热处理阳极膜,当在未处理、阳极氧化以及阳极氧化/水热处理的表面上培养成骨细胞(ROS 17/2.8,大鼠骨肉瘤细胞系)4天后,通过 MTT法检测细胞活力,未观察到统计学差异。相比之下,他们发现水热处理对早期成骨细胞贴附有影响,6小时后细胞呈现更充分伸展形态,而阳极氧化和对照钛表面上的细胞则呈现细胞圆形形态(图2.15)。
上述体外研究中的不同观察结果可能归因于使用了不同的阳极氧化参数和不同的细胞系。最佳阳极氧化条件仍在研究中。
由于纳米管结构相对较新,目前完成的细胞相容性研究较少,尚需进一步探讨其作为新型钛骨植入物表面的潜力。然而,由于二氧化钛管状结构的尺寸和有序性在一定程度上模拟了骨的自然环境,因此非常值得探究与传统的多孔阳极氧化钛结构相比,纳米管结构在促进骨细胞功能方面是否具有形态或尺寸上的优势。
目前,我们的研究重点是成骨细胞在具有纳米管状二氧化钛结构的阳极氧化钛上的功能。这些结构与龚等人[17]。(0.5 % HF,20伏特,20分钟)形成的结构类似。阳极氧化后,管状结构的表面粗糙度增加(图2.16)。纳米管内径约为70纳米,深度约为200纳米。为了研究纳米粗糙度和形貌的影响,制备了具有介于非阳极氧化对照组和纳米管结构之间的纳米颗粒结构和中等粗糙度的中间样品(0.5 % HF,10 V,20 min)(图2.16)。

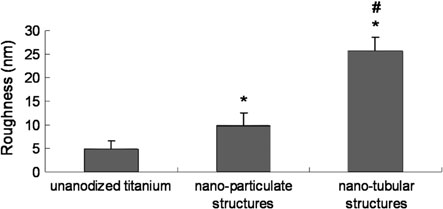
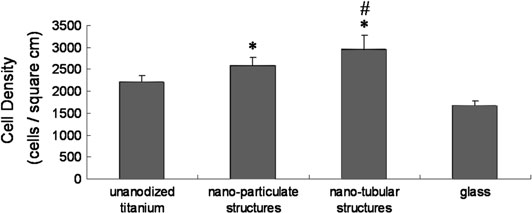
实验结果显示,在培养4小时后,随着阳极氧化钛粗糙度的增加,成骨细胞黏附增强(图2.17)。成骨细胞形态在纳米管结构和非阳极氧化钛之间差异明显。大多数细胞在具有纳米管结构的阳极氧化钛上充分铺展,而在对照组上则多呈圆形(图2.18)。培养4周后,具有纳米管结构的阳极氧化钛促进成骨细胞钙沉积的效果在所有样品中最高。这些结果表明,阳极氧化到钛表面的特殊纳米管结构可能提供了促进骨细胞功能的最佳表面粗糙度。

2.3.3.2 成骨细胞功能增强的机理
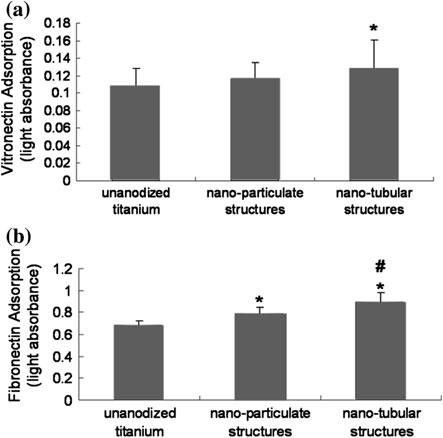
此外,已对纳米管样品上蛋白质(纤维连接蛋白和玻璃粘连蛋白)的吸附进行了研究,以探讨成骨细胞黏附增强的机理。纤维连接蛋白和玻璃粘连蛋白是参与成骨细胞粘附[48–50]。结果表明,与未经阳极氧化的钛样品相比,纳米管结构上纤维连接蛋白(增加15%)和玻璃粘连蛋白(增加18%)的吸附显著增加(图 2.19)。由于细胞通过预先吸附的蛋白质粘附到钛表面,因此在具有纳米管结构的阳极氧化钛基底上纤维连接蛋白和玻璃粘连蛋白吸附的增加,可能解释了所观察到的增强的成骨细胞功能。
2.3.3.3 体内研究
尽管体外实验可快速评估细胞相容性,但体内研究对于全面评价新骨生成是必要的。表2.3列出了关于骨组织对阳极氧化钛植入物反应的体内研究调查。
与体外分析一样,氧化层特性不仅包括厚度,还包括形貌、化学成分、结晶度和表面粗糙度。
一些体内研究主要关注厚的多孔氧化涂层对新骨生成的影响。在乙酸中阳极氧化形成的厚度小于200纳米的氧化膜,在植入兔模型6周后,与未阳极氧化的样品相比无显著差异[30]。相比之下,通常使用H3PO4/H2SO4电解质形成厚度达数十微米的阳极氧化膜。在兔模型中,通过H3PO4/H2SO4电解质溶液形成的微米级厚多孔阳极氧化物膜显示出增强的骨结合能力[51–53]。
更重要的是,表面化学成分的变化在诱导新骨生成方面可能发挥更为重要的作用。一些体内研究聚焦于富含钙磷的阳极氧化钛,无论是否经过水热处理[32, 35, 54–57]。
| Implant | Treatment | Chemical composition | Oxide thickness (µm) | Oxide/HA morphology(pore size, µm) | Oxide/HA crystallinity | Roughness (µm) | Test | Animal and time(week) | References |
|---|---|---|---|---|---|---|---|---|---|
| ND | Push-out | ||||||||
| cylinder | ND | Push-out | Ishizawa et al.[54] | ||||||
| Screw | 32.3/40.8 nm (rms) | Contact ratio | Larsson et al.[30] | ||||||
| 1.2(Sa) | RTQ, RFA | Henry et al. [51] | |||||||
| Screw | 1.97(Ra) | AI | Fini et al. [35] | ||||||
| Rod | Ca-P AO w/or w/o HT | Ti, O, Ca/P, HA | 5 | porous(1– 3)/columnar | N/C | 1.97(Ra) | AI | Rats 4, 8 | Fini et al. [35] |
| Screw | Ca-P AO and HT | Ti, O, Ca/P, HA | ND | porous | ND | 1.97(Ra) | AI, push-out strength | Sheep 4, 8, 12 | Giavaresi et al.[55, 56] |
| Screw | Ca-P AO w/or w/o HT | Ti, O, Ca/P, HA | ND | Porous/needle-like | A+ R/C | ND | Percent bone contact, RTQ | Rabbits 6,12 | Son et al. [57] |
| Screw | AO | Primary TiO2 | 0.2–1 | Porous(1.27–2.10) | N, A, A+ R | 0.96–1.04 (Sa) | RTQ, RFA | Rabbits 6 | Sul et al. [52, 53] |
| 0.82–1.04 (Sa) | RTQ, BMC | ||||||||
| AO and HT | TiO2, HA | <10 | Porous(1–3) | A+ R | |||||
| E/M and AO | Mainly TiO2 | 0.18–0.2 | Pores and pits | N | |||||
| AO | Ti, O, C, P/S | 1/10 | Porous(1–10) | A+ R | |||||
| Screw | AO | Ti, O, S, P, Ca | 1.1–1.3 | Porous(<1.5) | A or N | Sul[59] |
Abbreviations: AO Anodization, HT Hydrothermal treatment, E Electropolished, M Machined. C Crystalline, N Noncrystalline, A Anatase, R Rutile, RTQ Removal torque values, RFA Resonance frequency analysis, AI Affinity index, BMC Bone to metal, ND Not determined
石泽等人制备了1–2μm的HA薄膜于阳极氧化层上,并将其与非阳极氧化钛上的骨生长进行比较[54]。他们通过推出试验发现,阳极氧化钛在植入兔子体内8周后形成了牢固的骨结合。继其体外研究之后,菲尼等人[35]发现阳极氧化钛上的亲和指数最低,而阳极氧化并经水热处理的钛上则最高。阳极氧化钛上骨接触较低可能是由于非晶态二氧化钛层在体内的还原和降解所致,而羟基磷灰石晶体有助于骨对抗。贾瓦雷西等人[55, 56]也支持水热处理生成的羟基磷灰石在促进骨长入和骨矿化方面的积极作用。孙等人[57]报告称所有样品的骨接触百分比无显著差异,但发现阳极氧化植入物在植入兔子体内6周后拔出扭矩强度显著增加。
石泽等[58]研究了AH‐HA和PS‐HA在体内的溶解情况。总体而言,由于 AH‐HA具有相对较高的结晶度和较薄的厚度,其耐久性明显优于PS‐HA。
石泽等还发现这两种HA具有不同的骨反应[58]。具体而言,新骨在整个 AH‐HA区域上均匀薄层分布,而新骨则从周围骨组织向PS‐HA区域生长。
这可能是由于两者降解特性的不同所致。上述大多数研究的一个缺点是钛阳极氧化后化学成分和表面形貌均发生变化,因此难以单独验证某一材料特性的作用。然而,苏[59]通过保持表面形貌和粗糙度不变,仅改变化学特性 (具体为通过阳极氧化使植入物富含S、P和Ca),间接验证了体内化学结合的存在。
拔出扭矩值(RTQ)在含钙阳极氧化钛植入物与未阳极氧化钛植入物以及含硫阳极氧化钛植入物与未阳极氧化钛植入物之间显示出显著差异(图 2.20)。与对照组相比,S、P和Ca植入物的骨与金属接触分别高出186%、 232%和272%。这些结果

证实了在阳极氧化过程中掺入二氧化钛层的离子可能在增强骨并置方面发挥重要作用。
2.4 未来方向
作为一种表面改性方法,阳极氧化可实现所需的化学成分和/或形貌改变,并可与其他处理方法(如水热法)结合使用。
首先,阳极氧化提供了一种可控的方法来形成纳米粗糙度甚至纳米特征。通常,骨整合的实现依赖于两种机理:生物力学嵌合和生物相互作用。对于生物力学嵌合而言,其取决于表面粗糙度和不规则性。目前由钛合金制成的股骨柄通常具有宏观纹理,以提供此类表面特征,使骨组织能够机械嵌合。而对于生物相互作用,则涉及复杂的系统。考虑到不同尺度的粗糙度,据报道,增加微米/亚微米粗糙度可增强骨细胞功能,例如碱性磷酸酶活性 [60, 61],而一些其他研究则揭示了在多孔纳米或纳米相材料上细胞‐植入物相互作用的增强[14, 15, 62, 63]。理想情况下,未来的钛植入物应具备宏观、微观和纳米三个尺度的粗糙度。实现这一目标的一种可能方法是:先对植入物采用抛光和机械研磨等技术以形成微米级粗糙度,再通过快速阳极氧化过程诱导形成纳米管结构。
其次,使用阳极氧化钛制备的微米/纳米羟基磷灰石薄膜相比传统方法具有一些优势。尽管等离子喷涂目前仍广泛用于钛表面的HA涂层制备,但阳极氧化在将钙和磷引入钛涂层方面具有重要作用。例如,阳极氧化能够在各种形状的钛植入物表面形成均匀且薄的羟基磷灰石或磷酸钙层。此外,沉积在阳极氧化钛上的羟基磷灰石可具有纳米尺度的结构。目前仍需进一步深入研究的一个问题是磷灰石晶体与阳极氧化物之间的结合强度。
此外,阳极氧化可用于将药物递送整合到钛基植入物中,以增强新骨形成。多孔ASD表面可用作药物储存与释放的基质[64];同样,纳米管结构可作为化学介质(如骨形态发生蛋白‐2(BMP‐2)和成骨蛋白‐1(OP‐1, BMP‐7))的储库[65]。未来的研究应集中于将这些生长因子嵌入可在钛上精确控制的独特孔隙率中,用于骨科应用。
总之,阳极氧化作为一种快速且高效的钛基植入物改性方法,在延长其10‐15年使用寿命方面显示出巨大前景。
 阳极氧化钛植入物的纳米改性
阳极氧化钛植入物的纳米改性





















 323
323

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








