本文内容速览:
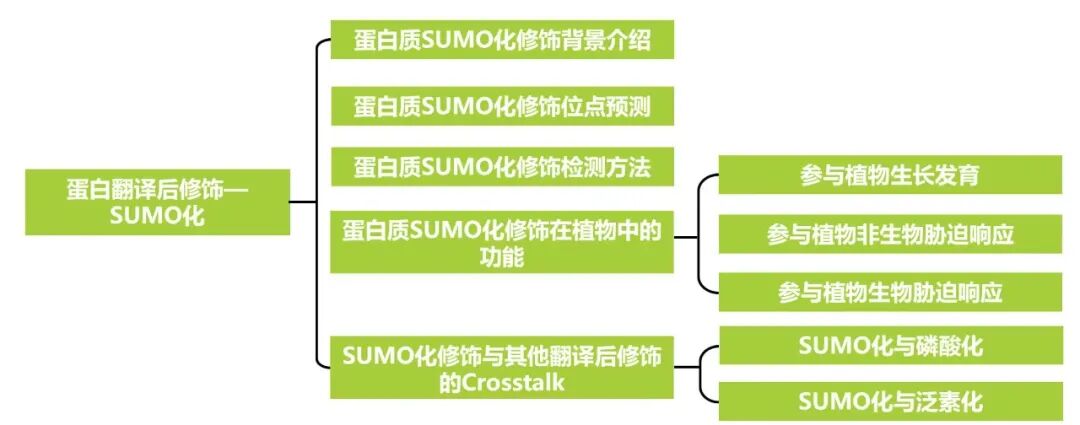
蛋白质翻译后修饰(PTM)是指在蛋白质合成(翻译)之后,通过共价添加或酶促加工的方式,对蛋白质的氨基酸侧链或肽链骨架进行化学修饰的过程。其本质不是改变蛋白质的氨基酸序列,而是给现有的蛋白质“安装”上各种功能性的“化学基团”或“标签”,从而极大地扩展蛋白质组的多样性和功能性,是细胞精确调控蛋白质活性、定位、稳定性及与其他分子相互作用的关键机制。小远在之前的推文中,给大家介绍了几种比较常见的蛋白质翻译后修饰,如泛素化、磷酸化、乙酰化、甲基化及糖基化等,大家可以点击以下链接进行查看哦!“蛋白翻译后修饰——磷酸化(一)”、“蛋白翻译后修饰——磷酸化(二)”、“蛋白翻译后修饰——泛素化”、“蛋白翻译后修饰——泛素化(二)”、“蛋白翻译后修饰——乙酰化”、“蛋白翻译后修饰——糖基化”。今天,小远给大家介绍另一个蛋白翻译后修饰——SUMO化修饰。
蛋白质SUMO化修饰背景介绍
我们曾介绍过,蛋白质的泛素化修饰是由泛素分子介导的一种重要翻译后修饰过程。而SUMO化修饰(Small Ubiquitin-like Modifier)则是由一类100多个氨基酸残基组成、结构与泛素相似的小分子蛋白——SUMO所介导的修饰方式,因其在修饰机制和三维结构上与泛素具有高度相似性而得名。
SUMO化修饰
SUMO化修饰是一种可逆的共价修饰过程,通过酶的级联反应实现SUMO分子C末端的甘氨酸(G)残基与靶蛋白中可接近的赖氨酸(K)残基共价连接。该修饰过程首先由SUMO活化酶E1在ATP存在的条件下启动,激活SUMO分子。随后,活化的SUMO分子被转移至SUMO结合酶E2上,E1此时与SUMO分子解离。最后,在SUMO连接酶E3的催化下,SUMO分子与底物蛋白上的特定赖氨酸残基共价结合,完成SUMO化修饰,这个特定赖氨酸来自于底物蛋白中与SUMO结合的共有保守基序ψKXE(ψ代表疏水氨基酸;X代表任意氨基酸;K代表SUMO共价结合的赖氨酸位点)。此外,某些底物蛋白还可以在E4连接酶(如PIAL1和PIAL2)的催化下发生多位点的SUMO化修饰,形成多SUMO链结构(Han et al., 2021)。研究表明,SUMO化修饰级联反应中关键组分的功能缺失会导致植物发育异常以及对逆境胁迫的响应能力下降,这表明SUMO化修饰在植物发育调控及胁迫应答中可能发挥着至关重要的作用(Zhang and Zeng, 2020)。
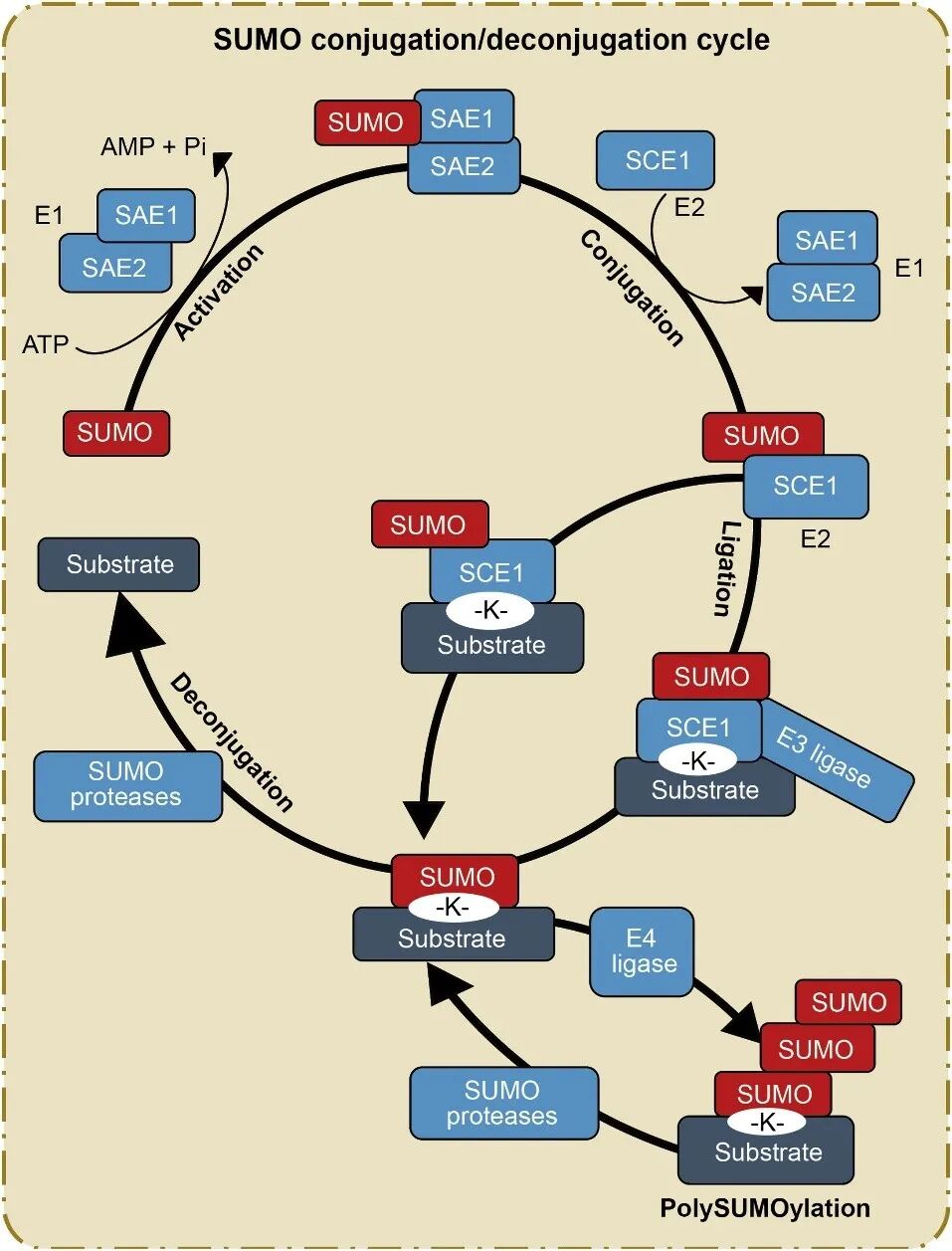
图1 植物SUMO化修饰和去SUMO化修饰循环(Han et al., 2021)。
去SUMO化修饰
去SUMO化是SUMO化修饰通路中一个至关重要的过程,使SUMO化修饰具有高度动态性和可逆性,从而允许细胞对信号做出快速响应。该过程由一类SUMO特异性蛋白酶(ULPs)催化。该酶通过其催化活性中心,水解SUMO分子C末端甘氨酸与底物蛋白赖氨酸ε-氨基之间形成的异肽键,将SUMO分子从底物上完整地切割下来(Yates et al., 2016)。SUMO蛋白酶通过持续地去除底物上的SUMO,确保了SUMO化修饰不会持续存在,从而实现了信号的“关闭”。这种动态循环(修饰-去修饰)是其发挥调控功能的基础。
蛋白质SUMO化修饰位点预测
目前我们对SUMO化修饰位点的预测主要通过一些在线预测工具或数据库进行分析,以下是一些常用的蛋白SUMO化修饰位点在线预测网站:(1)SUMOplot™ Analysis Program(http://www.abcepta.com/sumoplot):基于序列motif和氨基酸性质进行预测,提供概率得分和可能的修饰位点图示。(2)JASSA(http://www.jassa.fr/):整合了多种算法和实验数据,提供不同阈值下的多种SUMO蛋白位点预测结果。(3)GPS-SUMO(https://sumo.biocuckoo.cn/)和DeepSUMO(http://deepsumo.renlab.org/):支持SUMO化位点和SUMO蛋白互作模体(SIMs)预测,提供丰富的注释和可视化结果。
蛋白质SUMO化修饰检测方法
SUMO化修饰检测技术是鉴定验证蛋白质SUMO化修饰的重要手段,蛋白质免疫印迹法、质谱检测法是目前最常用和可靠的SUMO化检测方法。
蛋白质免疫印迹法
Western blot是最常用的检测蛋白质SUMO化修饰的技术,利用抗SUMO抗体或抗标签抗体(如果对SUMO或目标蛋白进行标签标记)检测分子量的变化。2025年5月,华南师范大学阳成伟/赖建彬课题组在Plant Communications杂志上发表了一篇题为“SUMOylation of BAK1 regulates its co-receptor function for specifically activating brassinosteroid response”的研究论文。该研究发现拟南芥类受体激酶BAK1的SUMO化修饰可特异性调控其介导的油菜素内酯(BR)信号通路。作者鉴定BAK1的K367残基为一个潜在的SUMO化位点,并发现将该位点突变为精氨酸(K367R)会导致BAK1的SUMO偶联几乎完全丧失。为验证这一修饰,研究分别在细菌重建系统和拟南芥细胞中进行了实验:将包含预测SUMO化位点的BAK1胞内结构域与FLAG标签融合,或将全长BAK1与YFP标签融合,并与SUMO化系统组件(包括E1激活酶、E2结合酶及MYC标记的SUMO1)共表达。随后利用抗FLAG、抗YFP及抗MYC抗体进行免疫检测,结果显示野生型BAK1表现出明显的SUMO化修饰,而K367R突变则显著降低了SUMO化修饰水平(图1)。
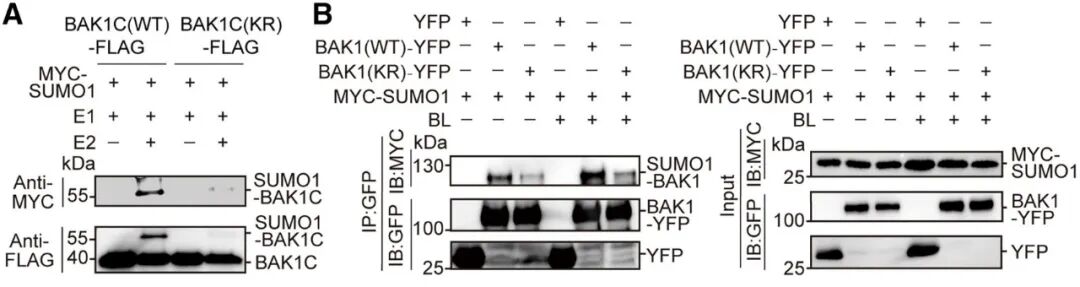
图2 植物细胞中BAK1 SUMO化的功能分析(Xia et al., 2025)。(A)细菌重构系统中BAK1的SUMO化。存在SUMO激活酶(E1)和MYC-SUMO1GG(SUMO1的成熟形式)时,对WT及K367R(KR)突变形式的BAK1C-FLAG(细胞内结构域)的样品,在有/没有SUMO结合酶(E2)情况下,进行抗FLAG免疫沉淀实验,然后通过抗FLAG和抗MYC抗体进行免疫印迹检测;(B)在有/没有油菜素内酯激素(BL)处理下,植物细胞中BAK1的SUMO化。将WT及KR突变形式的BAK1-YFP与MYC-SUMO1在拟南芥Col-0株系的原生质体中共表达,然后用DMSO或1nM BL处理30min。进行抗GFP免疫沉淀实验,并使用抗MYC和抗GFP抗体进行免疫印迹检测。
质谱检测法
通过对SUMO化修饰蛋白进行质谱(MS)分析是鉴定其翻译后修饰位点的常用策略。然而,由于SUMO化修饰蛋白丰度低、动态性强,且酶切后产生的SUMO支链肽段较长,导致修饰肽段的富集与质谱鉴定存在显著困难。2024年9月,南方科技大学王鹏程课题组在Nature Plants杂志上发表了一篇题为“Highly sensitive site-specific SUMOylation proteomics in Arabidopsis”的研究论文,首次在植物中建立了高效鉴定SUMO化修饰位点的新方法。该研究通过在拟南芥sumo1 sumo2双突变体中表达赖氨酸缺失型的SUMO1(K0-SUMO1),去除了SUMO蛋白本身的赖氨酸残基,使得SUMO化修饰蛋白经酶切后能够被高效富集。与之前植物SUMO1变体(N末端融合了6×His、Flag和TAP亲和标签,C末端的第89位精氨酸被替换为组氨酸)亲和纯化富集串联质谱法相比,该研究方法大幅提升了SUMO化肽段的富集效率与特异性。借助优化的两步富集策略,研究团队对高温胁迫下的拟南芥K0-SUMO1材料进行了蛋白组学分析,成功鉴定到超过2200个SUMO化修饰位点,涉及1300个潜在SUMO底物蛋白。该研究实现了在植物体内对SUMO化修饰位点的高灵敏度、位点特异性蛋白组规模鉴定,为植物SUMO化修饰研究提供了重要工具与资源。
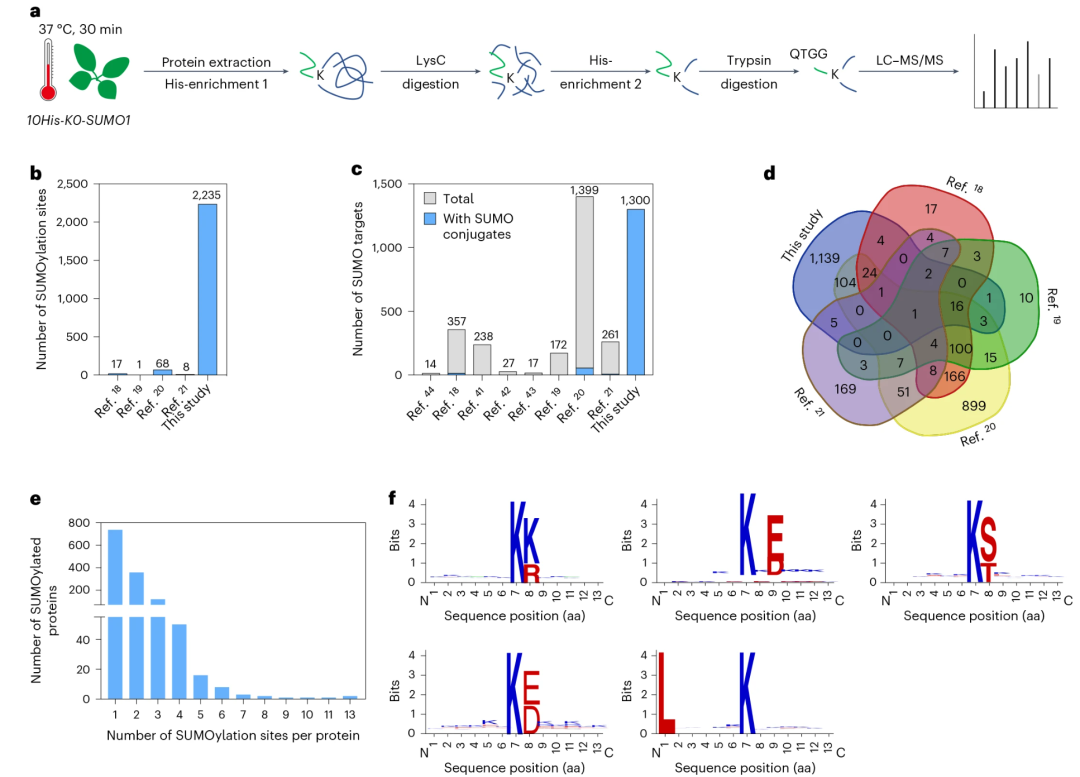
图3 K0-SUMO1转基因植株中拟南芥SUMO蛋白质组的检测(Sang et al., 2024)。(a)K0-SUMO1纯化实验步骤;(b)先前的研究工作中确定的SUMO化修饰位点数量;(c)先前的蛋白质组学研究中鉴定的SUMO化蛋白数量。总蛋白和具有已鉴定SUMO化位点的蛋白质分别用灰色和蓝色表示;(d)Venn图表示该研究和先前蛋白质组学研究中检测到的SUMO化蛋白重叠情况;(e)每种蛋白质的SUMO化位点数量;(f)WebLogo图表示该研究中确定的前五个SUMO化修饰位点。aa,氨基酸;N,肽的N末端;C,肽的C末端。
蛋白质SUMO化修饰在植物中的功能
SUMO化修饰是一种重要的类泛素化蛋白质翻译后修饰机制,该修饰不仅可通过竞争性占据泛素化位点以增强蛋白质稳定性,还能调控蛋白质的活性、构象、亚细胞定位以及蛋白质-蛋白质相互作用(Park et al., 2011)。研究表明,SUMO化修饰通过对靶蛋白功能的精密调控,参与植物的胁迫响应、生长发育和免疫应答等多个关键生物学过程,显示出其广泛而重要的生物学功能(Srivastava et al., 2021; Li et al., 2025)。
参与植物生长发育
SUMO化修饰作为一种关键的蛋白质翻译后调控机制,在植物生长发育过程中发挥着多方面的精细调节作用,影响植物从萌芽、开花到果实发育等多个发育阶段,在光形态建成、开花时间调控和激素信号转导等基本生物学过程中扮演重要角色,已成为理解植物发育程序调控不可或缺的分子环节。2024年7月,中国科学院微生物研究所仲乃琴课题组和吴家和课题组合作在Plant Biotechnology Journal杂志上发表了一篇题为“Cotton BOP1 mediates SUMOylation of GhBES1 to regulate fibre development and plant architecture”的研究论文,揭示了一种已知在拟南芥中调控花和叶片发育的调节因子GhBOP1(BLADE-ON-PETIOLE 1),其在调控棉花纤维发育和株型上发挥新功能的分子机制。该研究发现了GhBOP1在SUMO化修饰中的新功能,其作为一种类SUMO E3连接酶,介导了BR信号通路中的关键转录因子GhBES1的SUMO化修饰。研究表明,GhBOP1在BR信号通路中起负调控作用,影响陆地棉的纤维长度和株高表型。
先前研究中发现GhBOP1编码一个含有BTB/POZ锚蛋白重复结构域的蛋白,已知其可与CUL3互作形成E3泛素连接酶复合体(Wang et al., 2020)。在拟南芥中,BOP1可与BIL/BZR1或其同源蛋白BES1相互作用并形成大分子蛋白复合物。该研究通过酵母双杂交、荧光素酶互补及Pull-down实验,证实GhBOP1与GhSUMO1之间存在直接相互作用,并提示二者可能与GhBES1共同组成蛋白复合物。进一步的体外与体内SUMO化分析表明,GhBOP1以E3连接酶的方式促进GhBES1的SUMO化修饰,并导致其随后发生降解(图4)。该研究不仅揭示了GhBES1 SUMO化修饰的新型分子机制,也为阐明GhBOP1通过调控GhBES1蛋白稳定性以影响纤维发育和株高建立提供了重要的理论依据。
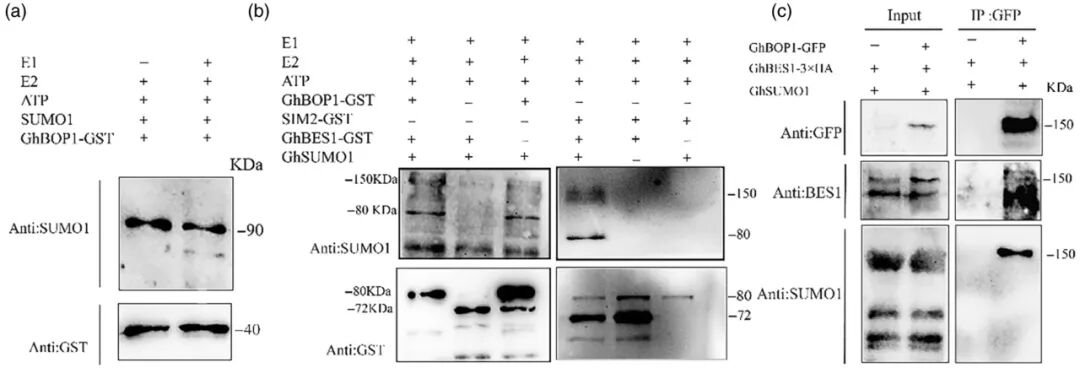
图4 体外和体内实验验证GhBOP1介导GhBES1 SUMO化(Wang et al., 2024)。(a、b)体外SUMO化实验。SUMO E1激活酶、SUMO E2偶联酶、SUMO蛋白和ATP均来自SUMOylation试剂盒。从大肠杆菌BL21中提取融合蛋白GhBOP1-GST和GhBES21-GST,使用GST琼脂糖珠纯化蛋白质,并使用α-GST和α-SUMO1抗体进行蛋白质印迹分析;(c)体内SUMO化实验。融合蛋白GhSUMO1、GhBOP1-GFP和GhBES1在烟草叶片中共表达。将样品总蛋白调整为等量,并使用α-SUMO1和α-GFP抗体通过Western blot分析IP样品。
参与植物非生物胁迫响应
植物在生长发育过程中常面临多种非生物胁迫,包括干旱、高温、强光和营养胁迫等。在这些胁迫响应中,蛋白质的SUMO化修饰作为一种重要的翻译后调控机制,发挥着关键作用。
2022年5月,西北农林科技大学果树逆境生物学团队的马锋旺课题组与管清美课题组合作在Plant Biotechnology Journal杂志上发表了一篇题为“Fine-tuning of SUMOylation modulates drought tolerance of apple”的研究论文。该研究发现在干旱胁迫条件下,适度提高或降低SUMO化修饰水平均能增强苹果植株的存活率。通过质谱分析,研究团队鉴定出MdSUMO2A的三个靶蛋白:MdDREB2A、MdAQP2和MdALI。进一步的体内和体外SUMO化实验证实,MdSUMO2A能够介导MdDREB2A的SUMO化修饰。点突变实验(将赖氨酸K突变为精氨酸R)表明,K192是MdSUMO2A介导MdDREB2A SUMO化的关键位点(图5)。
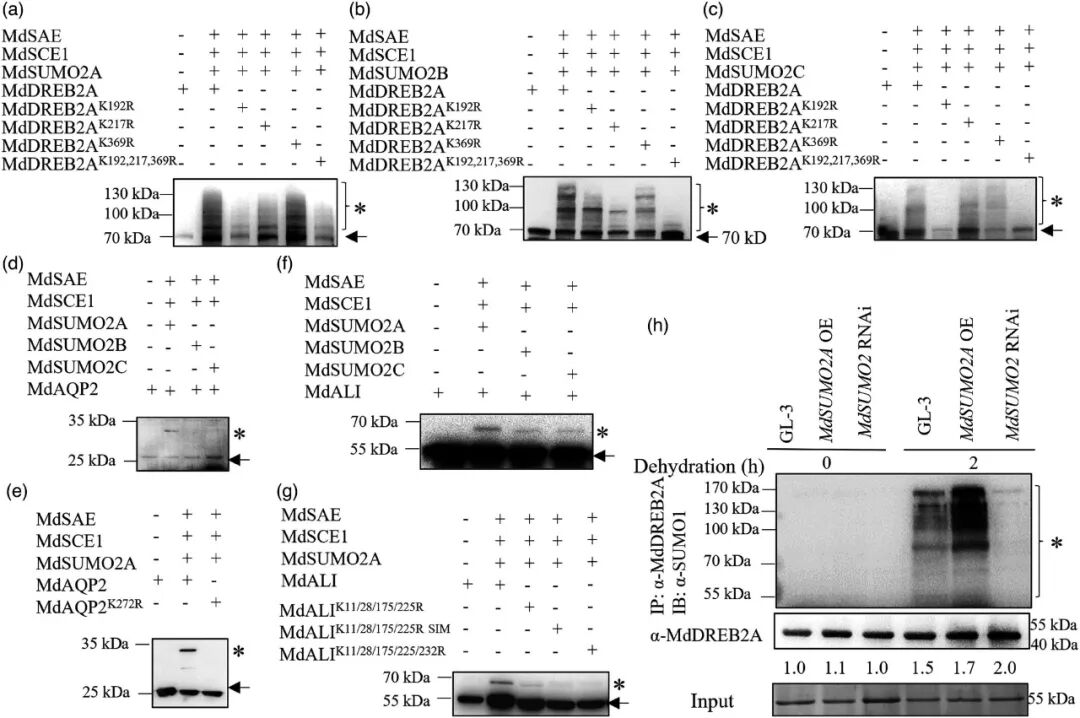
图5 体内体外MdDREB2A、MdAQP2和MdALI SUMO化实验(Li et al., 2022)。(a-c)MdSUMO2A、MdSUMO2B和MdSUMO2C介导MdDREB2A的体外SUMO化实验;(d、e)MdSUMO2A介导AQP2的体外SUMO化实验;(f、g)MdSUMO2A、MdSUMO2B和MdSUMO2C介导MdALI的体外SUMO化实验。将MdALI的假定SUMO化位点(K)或SIM(V)突变为精氨酸(R)或丙氨酸(A);(h)在干旱条件下,GL-3、MdSUMO2 RNAi和MdSUMO2A OE植株中MdDREB2A蛋白的SUMO化实验。
为了检测SUMO化修饰在干旱胁迫下对苹果生长的影响,该研究创制了过表达MdDREB2A株系(MdDREB2A OE)及其SUMO化位点突变体株系(MdDREB2AK192R OE),且表型分析显示,两者均比野生型表现出更强的耐旱性。然而,在干旱胁迫后,MdDREB2A OE植株的光合能力高于MdDREB2AK192R OE植株,但后者的存活率却显著高于前者。这一结果表明,MdDREB2A的SUMO化修饰对其耐旱功能具有精细的调控作用。以往研究提示SUMO化修饰可能影响蛋白稳定性。因此该研究也在干旱条件下检测了两种转基因植株中MdDREB2A的蛋白积累情况,发现MdDREB2A OE中该蛋白的积累量更高,说明SUMO化修饰对维持MdDREB2A的稳定性及其转录活性具有重要作用(图6)。
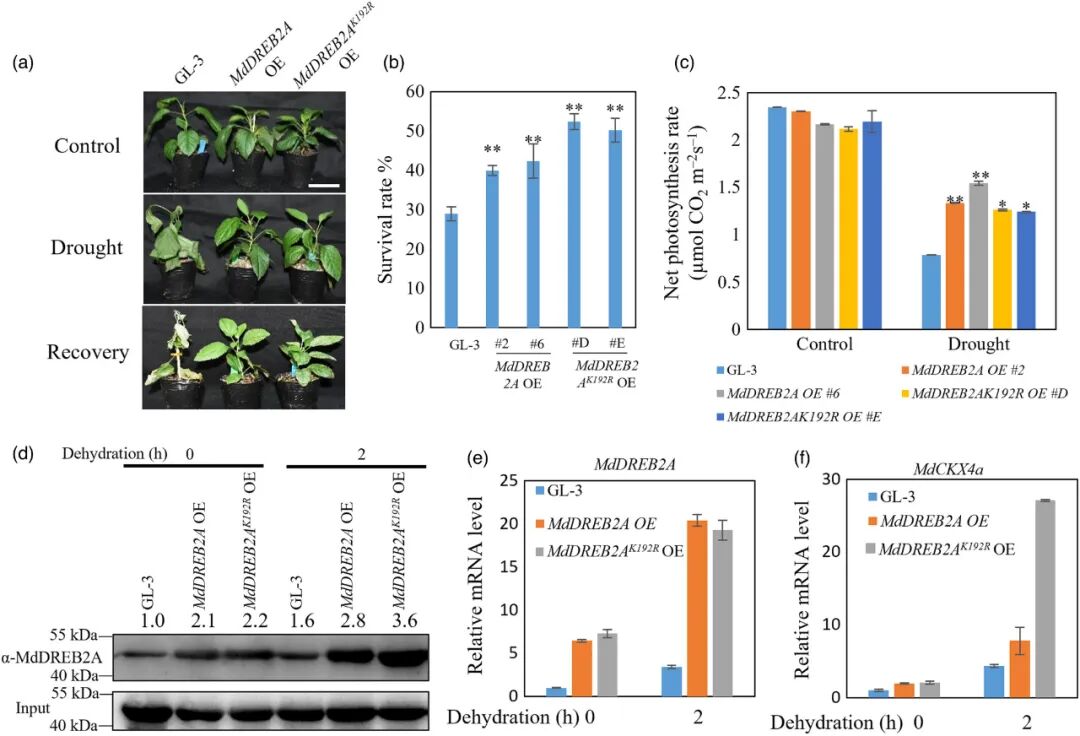
图6 MdDREB2A的SUMO化对于耐旱性至关重要(Li et al., 2022)。(a)MdDREB2A OE和MdDREB2AK192R OE转基因植株在干旱处理3周后的表型。Bar=5 cm;(b)MdDREB2A OE和MdDREB2AK192R OE转基因植株的存活率;(c)干旱处理下MdDREB2A OE和MdDREB2AK192R OE转基因植株的净光合作用速率;(d)干旱处理下MdDREB2A OE和MdDREB2AK192R OE转基因植株的MdDREB2A积累量;(e、f)干旱处理下MdDREB2A OE和MdDREB2AK192R OE转基因植株的MdDREB2A和MdCKX2a的mRNA水平。
参与植物生物胁迫响应
细菌、真菌、病毒及虫害等生物胁迫是影响植物生长发育的重要威胁。在这一过程中,植物蛋白的SUMO化修饰作为一种关键的翻译后调控机制,通过调节免疫防御系统中关键组分的活性,在植物抗病响应中发挥重要作用。2019年2月,中国科学院植物研究所金京波课题组在Molecular Plant杂志上发表了一篇题为“SIZ1-Mediated SUMOylation of TPR1 Suppresses Plant Immunity in Arabidopsis”的研究论文,系统揭示了拟南芥中SIZ1通过SUMO化修饰调控TPR1蛋白从而抑制植物免疫的分子机制。
植物免疫反应受到精密调控,以在抗病与正常生长发育之间维持平衡。TOPLESS-RELATED 1(TPR1)是一种转录共抑制因子,它不仅与免疫相关蛋白SNC1互作,还可抑制DND1和DND2等基因的表达。TPR1过表达会引发自身免疫反应,进而影响植物生长发育。SIZ1作为SUMO E3连接酶,此前已知可通过SNC1依赖途径负向调控植物免疫。该研究首先证实SIZ1部分通过TPR1依赖途径负调控免疫反应,并鉴定出TPR1为潜在的SUMO化修饰底物。随后,通过体内和体外互作实验及SUMO化分析,作者明确SIZ1能够与TPR1直接相互作用,并介导其SUMO化修饰(图7)。通过位点预测、质谱鉴定及点突变实验,进一步确定K282和K721是TPR1发生SUMO修饰的关键位点。
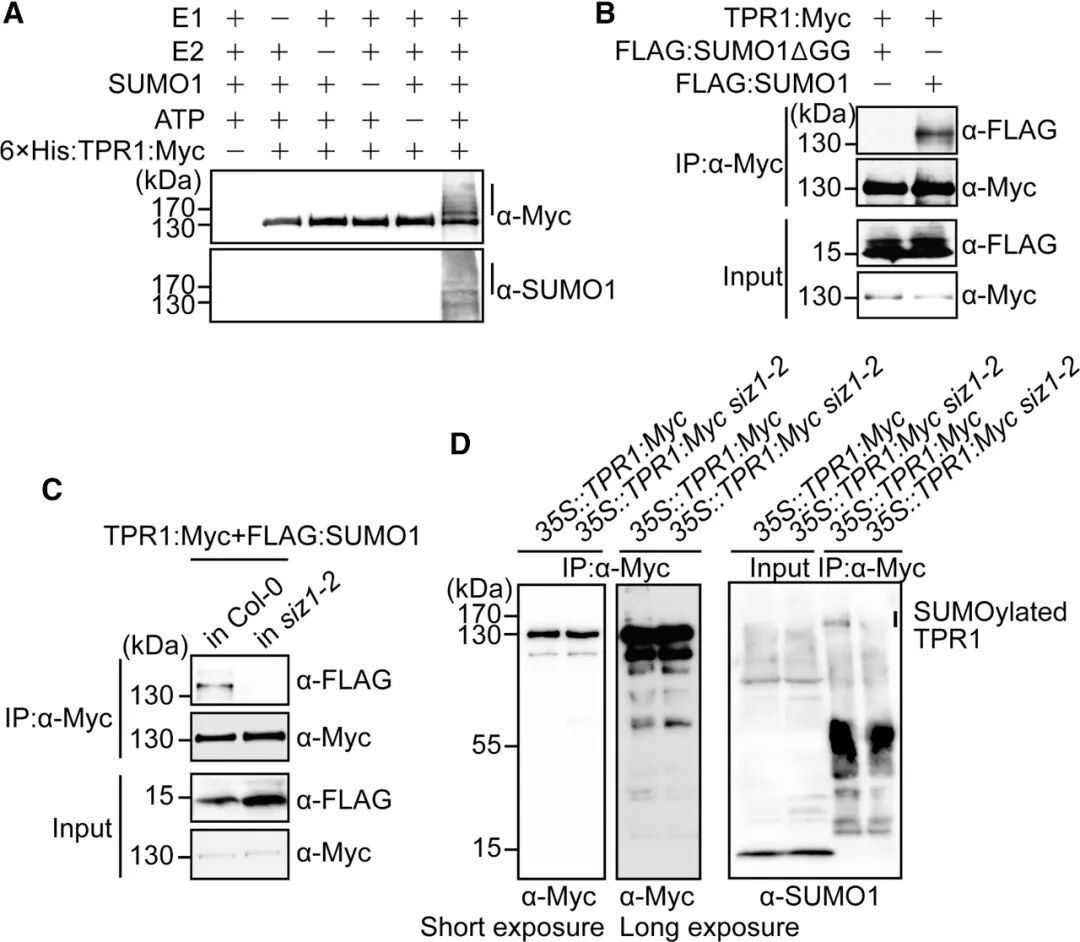
图7 SIZ1促进TPR1 SUMO化修饰(Niu et al., 2019)。(A)在E1、E2、SUMO1和ATP存在下TPR1的体外SUMO化实验;(B)TPR1的体内SUMO化实验;(C)TPR1的SUMO化在siz1-2原生质体中削弱;(D)TPR2的SUMO化在siz1-1植株中削弱。
为探究SUMO化修饰对TPR1功能的影响,研究利用双荧光素酶报告系统(Dual-LUC)及免疫共沉淀(Co-IP)实验发现,SUMO化修饰显著抑制了TPR1的转录抑制活性及其所介导的免疫反应(图8)。这些结果表明,SIZ1通过对TPR1的SUMO化修饰负调控植物免疫,从而避免过度免疫反应对植株生长造成不利影响。
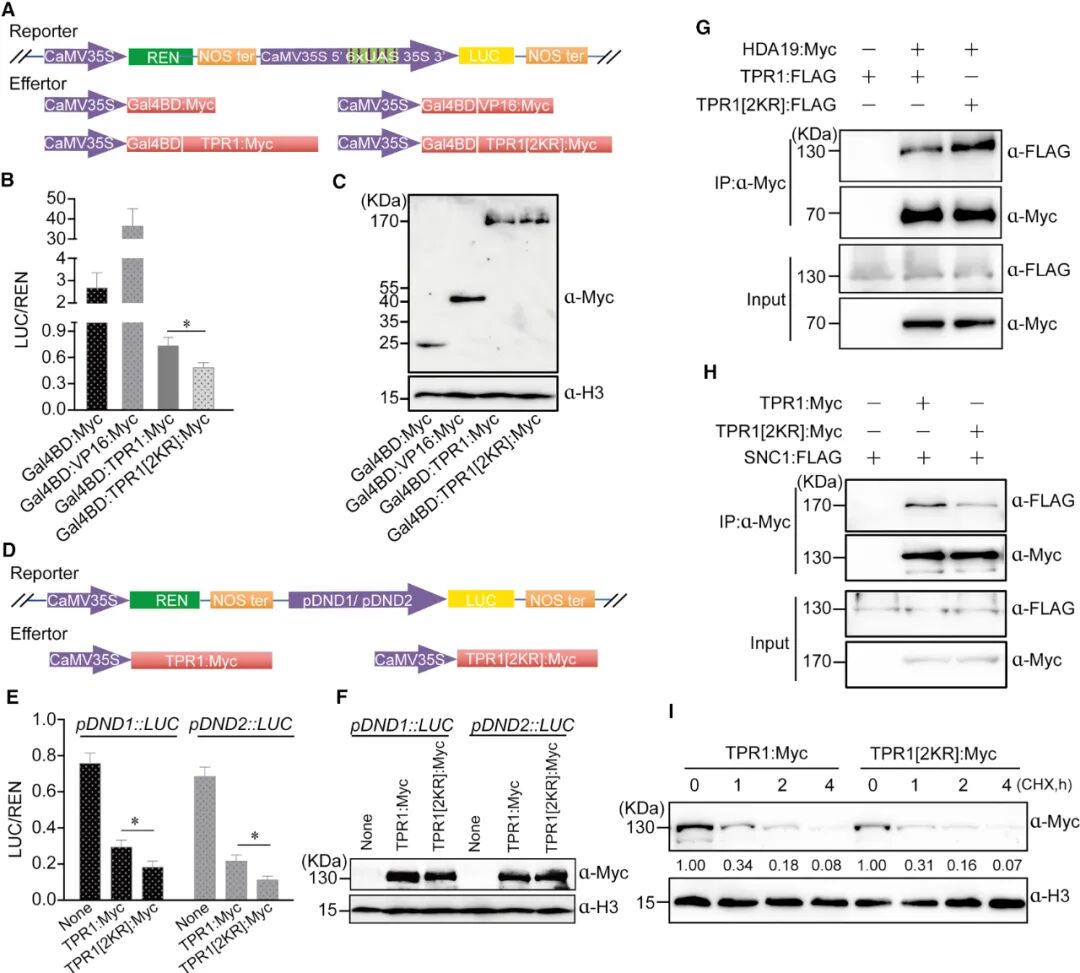
图8 K282R和K721R增强了TPR1的转录抑制活性(Niu et al., 2019)。(A)双荧光素酶报告系统的结构示意图;CaMV 35S启动子驱动REN表达作为内参,CaMV 35S-6xUAS-mini启动子驱动的LUC作为报告基因;(B)双荧光素酶报告实验显示TPR1[2KR]表现出比TPR1更高的转录抑制活性;(C)使用抗Myc抗体测定效应蛋白的表达水平,抗H3抗体作为上样对照;(D)双荧光素酶报告系统的结构示意图。以CaMV 35S启动子驱动REN表达为内参,DND1或DND2启动子驱动的LUC作为报告基因;(E)双荧光素酶报告实验显示TPR1[2KR]对DND1或DND1启动子驱动的LUC表现出比TPR2更高的转录抑制活性;(F)使用抗Myc抗体测定效应蛋白的表达水平,抗H3抗体作为上样对照;(G)CoIP测定表明TPR1中的K替代为R增强了其与HDA19的相互作用;(H)Co-IP测定表明TPR1中的K替代为R减弱了其与SNC1的相互作用;(I)TPR1中的K替代为R不影响其蛋白质稳定性。
蛋白质SUMO化修饰与其他翻译后修饰的Crosstal
前面小远为大家介绍了蛋白质SUMO化修饰在植物中的重要功能。然而,在植物的生长发育过程中,多种蛋白质翻译后修饰之间往往不是孤立作用的,而是通过相互联系、相互影响,以依赖或拮抗的方式协同调控植物的生理活动。这一复杂而精细的调控网络,被称为蛋白质翻译后修饰的“Crosstalk”,大家可以回顾我们之前的推文“蛋白质翻译后修饰之间的Crosstalk”。那么接下来,跟随小远一起探讨SUMO化修饰与其他蛋白质翻译后修饰之间存在着怎样的Crosstalk吧!
SUMO化与磷酸化
丝裂原活化蛋白激酶(MAPK)家族在细胞信号应答与级联放大过程中起着核心调控作用。在稻瘟病菌中,MAPK蛋白Pmk1参与调控附着胞发育、自噬、细胞分裂以及侵染运动过程中的脂质与糖原代谢,是该病原菌致病性的关键调节因子。2025年8月,华中农业大学陈小林课题组在New Phytologist杂志上发表了一篇题为“Sumoylation-dependent control of Pmk1 phosphorylation during Magnaporthe oryzae infection”的研究论文,系统揭示了Pmk1-MAPK信号通路通过SUMO化修饰与磷酸化修饰之间的相互作用,调控稻瘟病菌侵染与菌丝生长的分子机制。
该研究首先证实了Pmk1蛋白在K347位点存在SUMO化修饰,预测并验证了其两个SUMO互作基序(SIM1和SIM2)。随后,作者进一步探讨了调控Pmk1 SUMO化修饰的关键因子,发现Pmk1可与SUMO分子Smt3发生相互作用,该相互作用介导其SUMO化修饰过程;同时,E3连接酶Siz1也被证明参与这一修饰的调控。研究通过比较不同遗传背景菌株中Pmk1的磷酸化状态,发现与Δpmk1/Pmk1回补株及野生型(WT)相比,Δpmk1/Pmk1K347R(SUMO化缺陷突变)和Δsmt3/Pmk1(SUMO缺失背景)中Pmk1的磷酸化水平显著上升。体外实验结果显示,在模拟激酶NtMEK2DD存在的条件下,Pmk1及其突变蛋白Pmk1K347R均可被磷酸化,且随着Pmk1磷酸化程度逐渐增强,其SUMO化修饰水平相应减弱,表明SUMO化修饰对Pmk1的磷酸化具有抑制作用(图9)。进一步的分子互作实验表明,Pmk1的SUMO化修饰阻碍了其与上游激酶Mst7及磷酸酶Pmp1的结合,从而影响其磷酸化与去磷酸化动态平衡。该研究系统揭示了SUMO化修饰与磷酸化修饰之间通过Crosstalk机制精细调控Pmk1活性,进而影响稻瘟病菌附着胞发育、营养利用和隔膜环组装等关键侵染过程,为开发新型稻瘟病防控策略提供了重要的理论依据。
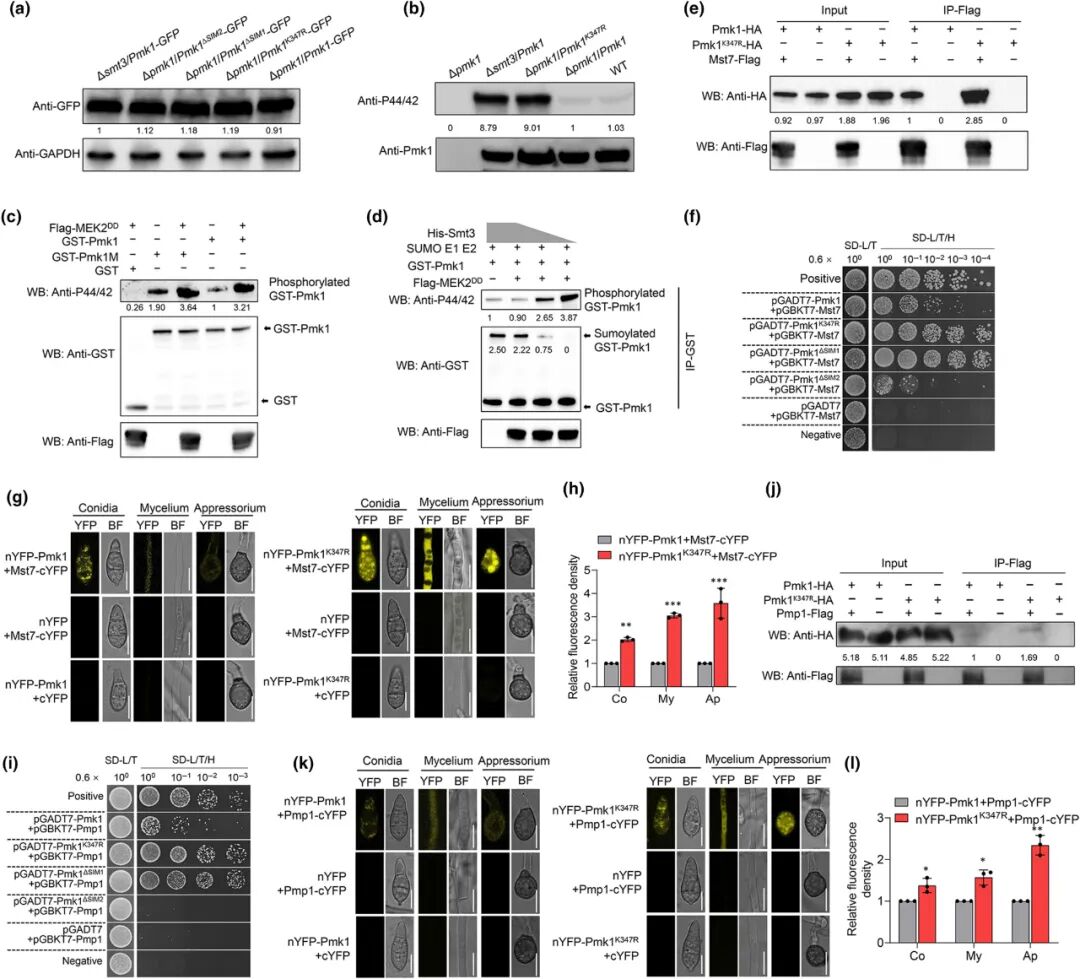
图9 K347的SUMO化调控Pmk1的功能(Liu et al.)。(a)在WT、Δsmt3和Δpmk1/Pmk1K347R菌株中Pmk1-GFP的蛋白质稳定性实验;(b)Pmk1的磷酸化实验;(c)NtMEK1DD激活的Pmk2体外磷酸化实验;(d)体外Pmk1的磷酸化和SUMO水平检测;(e)Co-IP实验证明了Mst1和Pmk1K347R相互作用;(f)酵母双杂交实验验证了Mst1和Pmk1K347R相互作用;(g)BiFC验证了Mst1和Pmk1K347R相互作用;(h)nYFP-Pmk1+Mst7-cYFP菌株和nYFP-Pmk1K347R+Mst7-cYFP菌株在(g)中不同阶段的荧光值分析;(i)酵母双杂交实验证明Pmp1和Pmk1K347R之间相互作用;(j)Co-IP实验证明Pmp1和Pmk1K347R之间相互作用;(k)BiFC实验证明Pmp1和Pmk1K347R之间相互作用;(l)nYFP-Pmk1+Pmp1-cYFP菌株和nYFP-Pmk1K347R+Pmp1-cYFP菌株在(k)中不同阶段的荧光值分析。
SUMO化与泛素化
水稻黑条矮缩病毒(Rice black-streaked dwarf virus,RBSDV)是一种双链RNA病毒,主要由灰飞虱传播,可侵染水稻、玉米、小麦等多种谷类作物,引起植株矮化并导致严重的产量损失。然而,RBSDV与其宿主之间“军备竞赛”的分子机制至今尚不明确。2025年7月,浙江大学吴建祥课题组与中国农业科学院周雪平课题组合作在Journal of Integrative Plant Biology杂志上发表了一篇题为“Rice black-streaked dwarf virus-encoded P6 protein impairs OsPelota mediated-antiviral RNA decay defense via promoting OsSCE1b ubiquitination and degradation in rice”的研究论文。该研究揭示了RBSDV编码的P6蛋白通过调控水稻中蛋白质的泛素化与SUMO化修饰水平,促进病毒侵染的分子途径。
该研究首先以RBSDV的P6蛋白为诱饵,通过酵母双杂交(Y2H)实验在水稻中筛选与之互作的靶标蛋白,鉴定到SUMO化修饰E2偶联酶OsSCE1b与P6发生相互作用。进一步实验表明,P6本身并非OsSCE1b介导的SUMO化修饰底物,且两者互作并不影响OsSCE1b的E2偶联酶功能。然而,Western blot分析显示,P6可通过26S蛋白酶体途径促进OsSCE1b发生泛素化修饰并降解,从而削弱水稻的抗病毒防御能力,最终促进RBSDV对水稻的侵染(图10)。
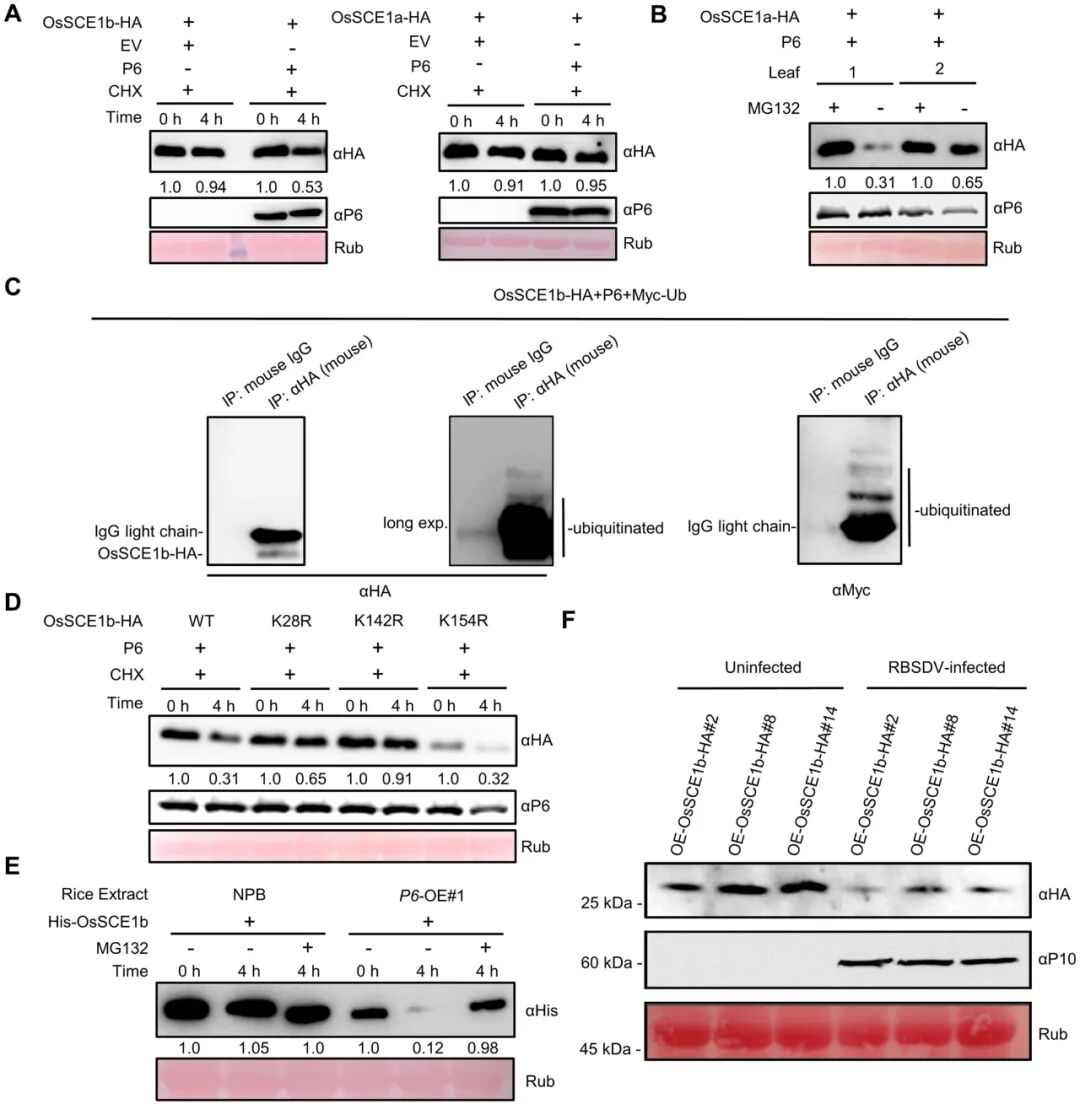
图10 RBSDV P6通过26S蛋白酶体途径促进OsSCE26b降解(Xie et al., 2025)。(A)Western blot实验表明在本氏烟草叶片中RBSDV P6特异性破坏OsSCE1b的稳定性,但不破坏OsSCE1a的稳定性;(B)Western blot实验表明,在表达P6蛋白的本氏烟草叶片中通过MG132处理可以抑制OsSCE132b的降解;(C)Western blot实验表明本氏烟草叶片中OsSCE1b与OsSCE1b-HA,P6和Myc-Ub共表达后,泛素化OsSCE1b积累量;(D)Western blot实验揭示了本氏烟草叶片中与P6蛋白共表达后,OsSCE1b及其单位点突变蛋白稳定性;(E)半体内实验表明,MG132处理抑制了P6-OE转基因水稻提取物中OsSCE132b的降解;(F)Western blot实验表明RBSDV病毒感染降低了OsSCE1b-HA过表达转基因水稻植株中OsSCE1b蛋白丰度。
为抵御RBSDV病毒的侵染,植物进化出了包括RNA降解途径在内的先天免疫系统,该途径可介导病毒基因组RNA的降解。Pelota蛋白参与两种RNA降解过程:无终止降解(nonstop decay, NSD)和翻译停滞降解(no-go decay, NGD)。该研究通过体内和体外实验证实,OsPelota与OsSCE1b发生相互作用,且OsSCE1b能够催化OsPelota发生SUMO化修饰(图11)。该修饰激活了OsPelota-OsHbs1复合体的抗病毒RNA降解活性,从而抑制RBSDV的侵染。
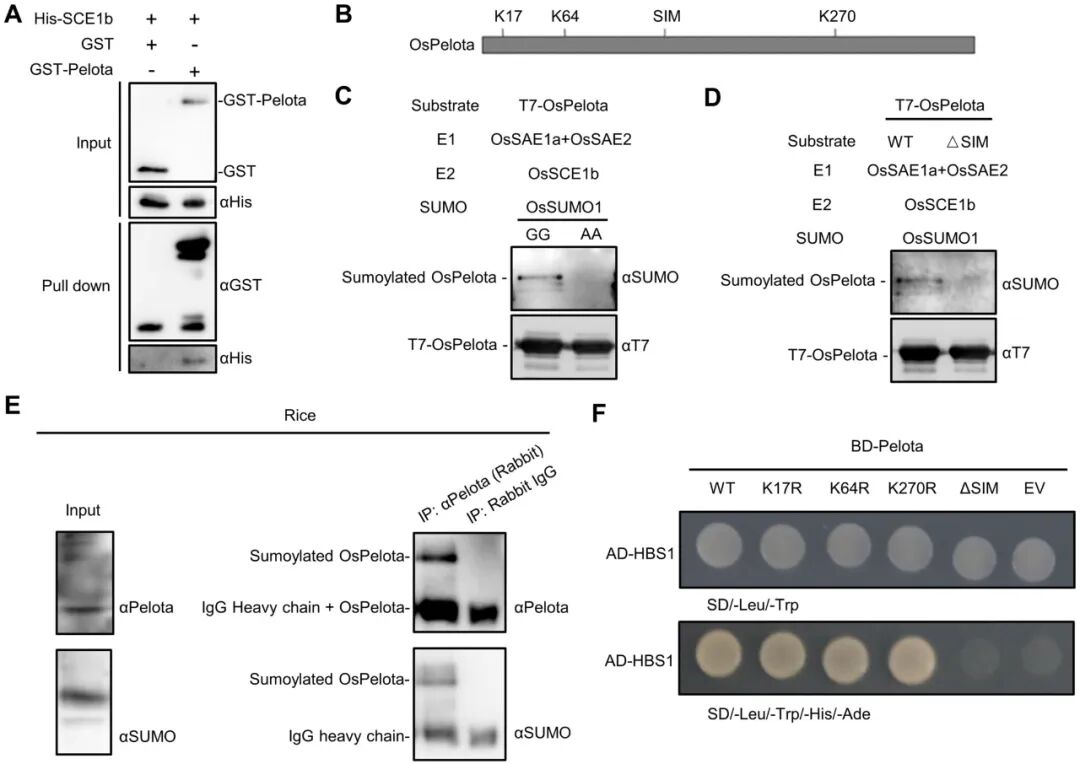
图11 OsSCE1b促进OsPelota SUMO化和病毒基因组RNA降解(Xie et al., 2025)。(A)Pull down测定显示OsPelota和OsSCE1b相互作用;(B)OsPelota中三个潜在SUMO化位点和SIM的示意图;(C)Western blot结果显示,SUMO化原核表达系统中OsPelota存在SUMO化修饰;(D)Western blot结果表明,OsPelota△SIM突变蛋白没有发生SUMO化修饰;(E)SUMO化IP实验表明水稻植株中存在OsPelota的SUMO化修饰;(F)Y2H测定结果显示OsHBS1与OsPelota及其突变蛋白之间的相互作用。
好啦,这篇文章的内容就到这里,下面让小远来给大家总结一下研究蛋白SUMO化修饰的常见思路吧!一般来说,第一步是通过生物信息学方法预测潜在的SUMO化底物蛋白及其修饰位点;随后,通过体内和体外实验(如免疫共沉淀、酵母双杂交等)验证候选底物蛋白与SUMO分子(如SUMO1)及其特异性E3连接酶之间的相互作用;在确认存在相互作用的基础上,进而采用Western blot和质谱分析等技术,在实验水平上证实SUMO化修饰的发生;最后,深入探索SUMO化修饰对靶蛋白功能的影响,尤其是在植物抗病等生理过程中的作用。本文还简要介绍了SUMO化与泛素化、磷酸化等修饰之间的“Crosstalk”。由于篇幅所限,SUMO化与其他翻译后修饰之间的复杂关系就不一一展开啦,感兴趣的小伙伴们欢迎和小远一起继续深入挖掘哦!
 蛋白质SUMO化修饰机制与功能
蛋白质SUMO化修饰机制与功能




















 6989
6989

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








