CRISPR基因编辑技术自问世以来,就展现出无可比拟的优势,并深刻改变了基因编辑领域乃至整个生命科学的研究模式。CRISPR/Cas9系统通过在基因组上诱导双链断裂损伤(Double Strand Break,DSB)来实现靶位点的编辑。细胞修复DSB的方式主要有两种:非同源末端连接(Non-Homologous End Joining,NHEJ)和同源重组(Homology Directed Repair,HDR)。细胞通过NHEJ修复DSB会随机产生碱基的插入或缺失,造成基因的移码突变,从而实现基因敲除。细胞通过HDR修复时需要DNA片段作为修复模板,此时可以提供人为设计的外源DNA模板,从而在基因组上引入包括点突变、插入、删除等在内的基因修饰。细胞倾向于利用NHEJ来修复DSB,造成HDR的效率偏低,因此CRISPR/Cas9系统无法高效地诱导点突变等编辑类型。
2019年,哈佛大学David Liu实验室在Nature上发表了题为“Search-and-replace genome editing without double-strand breaks or donor DNA”的论文。该文章介绍了一种全新的精准基因编辑工具——先导编辑(Prime Editors,PE),通过对靶位点的“搜索”和“替换”,无需额外的DNA模板便可以实现4种碱基之间的任意变换,而且还能有效实现多碱基的精准插入与删除(最多可插入44bp的碱基,可删除80bp的碱基),克服了CRISPR/Cas9系统介导的HDR效率低和碱基编辑系统不能实现碱基颠换的弊端,具有明显的优势,另外相比于传统的HDR,PE无需DNA双链断裂即可实现编辑,因此安全性也更高。这一全能性工具的出现将精准基因组编辑推到新的高度。
一、PE系统的简介
PE系统以CRISPR-Cas9系统为基础,包括pegRNA(Prime Editing Guide RNA)和融合蛋白两个核心部分,pegRNA是在sgRNA的基础上,在其3’末端增加了一段RNA序列,这段序列具有双重角色,一端作为逆转录引物结合位点(Primer Binding Site,PBS),另一端则是能与逆转录酶(RT)结合的逆转录模板(Reverse Transcriptase Templates,RTT),携带着认为设计的目标点突变或插入缺失突变;融合蛋白是将nCas9(H840A突变型,只切断含PAM的靶点DNA链)与逆转录酶融合获得的新型蛋白。
二、PE系统的原理
PE的基本原理如图1所示,首先是在pegRNA的引导下,Cas9 H840切口酶切断含PAM的靶点DNA链,断裂的靶DNA链与pegRNA的3’末端PBS序列互补并结合,之后逆转录酶发挥功能,沿RT模板序列开始逆转录反应。反应结束后DNA链的切口处会形成处在动态平衡中的5’-和3’-flap结构,其中3’flap结构的DNA链携带有目标突变,而5’flap结构的DNA链则无任何突变。细胞内5’flap结构易被结构特异性内切酶识别并切除,之后经DNA连接和修复后靶位点处便实现了精准的基因编辑。
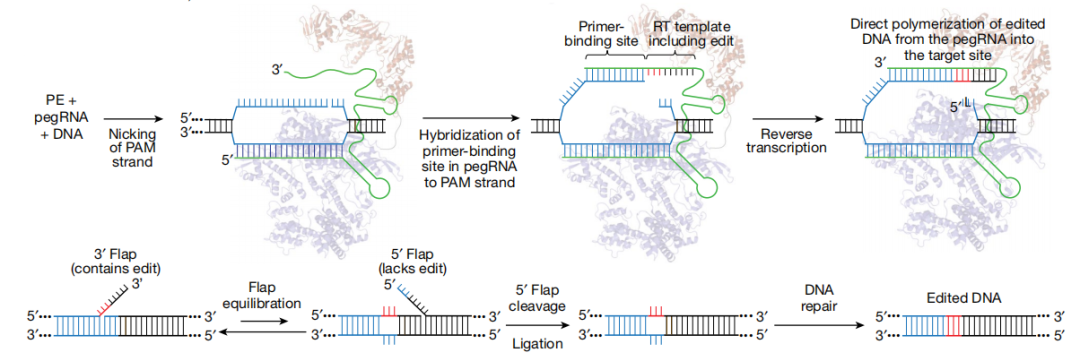
图1 PE的基本原理(Anzalone et al.,2019)
三、PE在医学上的应用
基因治疗是基因编辑工具的一项重要应用,使用基因编辑工具直接修复致病突变进行有望治愈人类遗传疾病。已知绝大多数致病遗传变异都是点突变及插入缺失突变,PE在临床基因治疗研究中具有极大的潜力。目前,PE系统已被广泛应用到农业、基因治疗、疾病模型构建等多个研究领域。
2023年4月17日发表在Nature Biomedical Engineering期刊上,论文标题为“Ex vivo prime editing of patient haematopoietic stem cells rescues sickle-cell disease phenotypes after engraftment in mice”的文章指出PE有望安全有效地治疗镰状细胞病。
镰状细胞病(SCD)是一种常染色体隐性遗传病,由β-珠蛋白基因(HBB)的A·T到T·A转位突变引起的β-珠蛋白上第六位的谷氨酸被缬氨酸替代,该突变将正常成人β-红蛋白(βA)转变为镰状β-红蛋白(βS),并用镰状血红蛋白(HbA,α2β2)替代正常成人血红蛋白(HbS,α2βS2),因此也叫做镰刀状细胞贫血症。
SCD的理想治疗方法是将突变的HBBS永久恢复到野生型等位基因HBBA。而PE技术无需依赖DNA模板便可有效实现所有12种单碱基的自由转换,还能有效实现多碱基的精准插入与删除,且不产生不需要的DNA双链断裂(DSB),因此可作为镰状细胞病的理想治疗方法。
该研究通过在体外对人类镰状细胞病患者的造血干细胞进行先导编辑后再通过尾静脉注射移植给小鼠,17周后收集小鼠骨髓,并进行分析。然后再测定移植17周后小鼠移植细胞中的克隆编辑结果。研究结果表明先导编辑后的造血干细胞保持了它们在骨髓中定植和重新扩增填充的全部能力,并能长期在造血干细胞群体中维持预测的编辑治疗水平,成功挽救了小鼠的镰状细胞病表型。通过全基因组分析,该治疗策略具有高编辑效率、低频indel副产物和最小的脱靶编辑水平,支持了先导编辑技术治疗SCD的可行性。
四、结语
总体而言,PE是精准基因编辑领域的重大突破,在单碱基随意转换和小片段多碱基的增删方面潜力巨大,这将极大推动生物医学的基础研究和临床医学的基因治疗研究。
但尽管先导编辑技术在基因治疗上展现出了明显的优势,如精准性高、PAM限制小、可以实现片段的插入删除等,其也存在编辑效率偏低、pegRNA设计复杂等缺点,并且需要先在各种实验条件下确定最有效的pegRNA,这将耗费大量的时间和资源。此外,其体积过大的特点也影响了它的递送效率,限制了其在基因治疗中的应用。因此,这也是未来研究者们共同努力的方向,不断优化PE系统,克服现有缺点,攻克人类遗传病。
参考文献
Anzalone, A. V., Randolph, P. B., Davis, J. R., et al. Search-and-replace genome editing without double-strand breaks or donor DNA.[J]. Nature,2019,576(7785).




















 769
769

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








