蛋白间相互作用是细胞各种基本功能的主要完成者,参与几乎所有的重要生命活动。因此,蛋白-蛋白相互作用研究以及解析相互作用的关系网络图,具有十分重要的意义。为了研究蛋白质间的相互作用,科学家们开发了多种实验技术,其中包括免疫共沉淀(Co-Immunoprecipitation,Co-IP)、GST pull-down、荧光共振能量转移(Fluorescence Resonance Energy Transfer,FRET)以及蛋白邻近连接技术(Proximity ligation assay,PLA)。本文将对这四种技术进行详细比较,帮助大家了解它们的优缺点及适用场景,选择合适的方法用于您的研究之中。
01 免疫共沉淀(Co-IP)
Co-IP是基于抗体-抗原特异性结合的特性来研究蛋白质相互作用的经典方法。利用特异性抗体精准捕获细胞裂解液中的目标蛋白,与目标蛋白直接或间接结合的互作蛋白则会被一同“吸”下来,最终通过洗涤、洗脱和分析等步骤,确定目标蛋白和其互作蛋白的身份和相互作用模式。
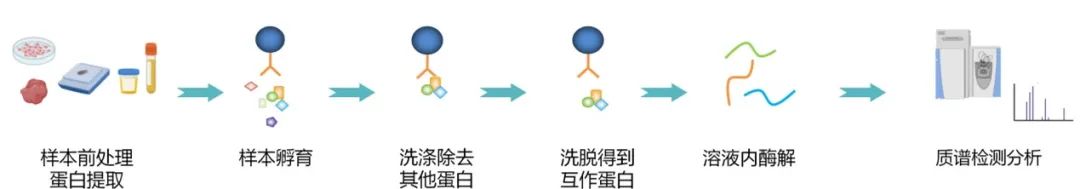
技术流程:
1、载体构建及转染(涉及互作位点或缺乏内源抗体时);
2、提取细胞或组织的总蛋白质;
3、使用特异性抗体对目标蛋白质进行免疫沉淀;
4、免疫沉淀的复合物洗涤,洗脱;
5、通过Western blotting验证或质谱筛选分析与诱饵蛋白结合的目的蛋白。
技术优势:
1、在非变性条件下进行,保留蛋白质天然构象,反映生理条件下互作复合物;
2、操作简单,成本较低、适用范围广;
3、下游可结合多种方法研究相互作用。
技术局限:
1、无法检测弱/瞬时表达相互作用,无法区分直接/间接互作;
2、高度依赖抗体质量,抗体质量决定实验成败;
3、背景噪音较高,灵敏度低,有假阳性干扰;
4、仅提供静态互作情况,无法实时监测互作动态 。
应用案例:
2024年9月复旦大学临床医学院葛均波课题组在《Theranostics》期刊发表题为“Knocking out USP7 attenuates cardiac fibrosis and endothelial-to-mesenchymal transition by destabilizing SMAD3 in mice with heart failure with preserved ejection fraction”的研究论文。该团队利用Co-IP实验证明,USP7直接与SMAD3结合。这种结合引导SMAD3去除K63位点泛素链实现去其泛素化来维持SMAD3的稳定性,并防止SMAD3被蛋白酶体降解,来促进内皮间充质转化和心脏纤维化。
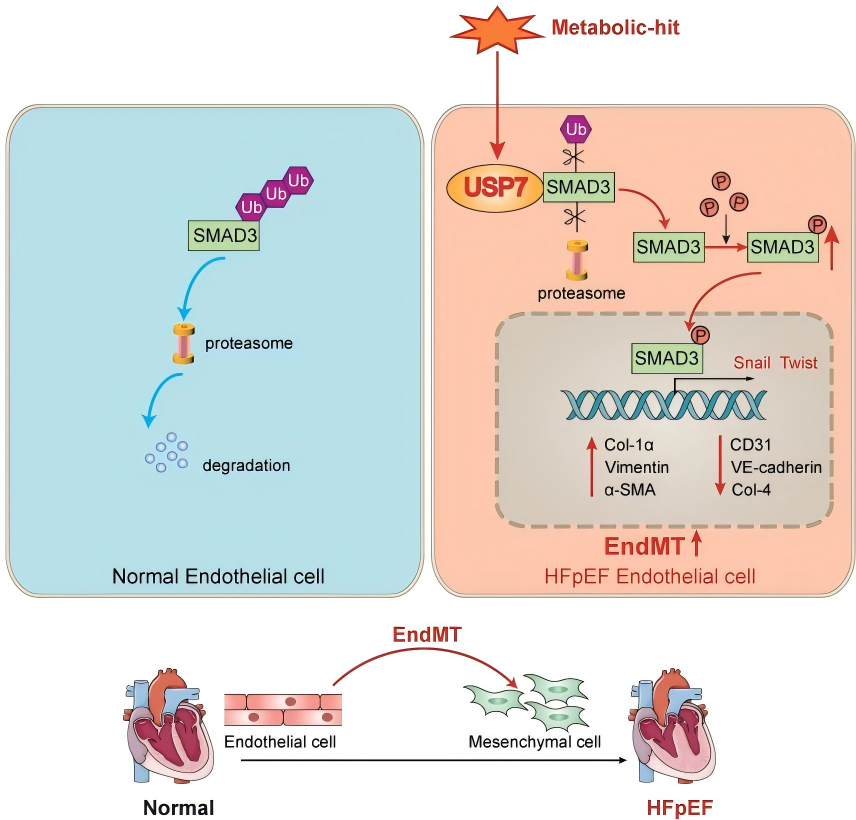
文献来源(Yuan et al., 2024)
02 GST pull-down
GST pull-down是一种通过亲和标签纯化进行体外检测蛋白质直接相互作用的实验工具。其基本原





 最低0.47元/天 解锁文章
最低0.47元/天 解锁文章

















 690
690

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








