人类基因组计划发现人类基因组大约由22000个蛋白质编码基因组成,这些基因可通过可变剪接(Alternative Splicing,AS)产生多个转录本。介于AS是真核基因调控中常见且保守的过程,因此,RNA分子AS过程是转录组多样性的关键因素。RNA剪接是一个高度调控的过程,需要剪接体、顺式作用元件和反式作用蛋白之间的协调,最终从pre-mRNA中去除内含子,合并蛋白质编码外显子,以形成成熟的mRNA(图1)。具体而言,pre-mRNA内含子上包含三个重要位点,5'剪接位点(5'SS)、分支点位点(BPS)和3'剪接位点(3'SS),它们是短保守序列,以及一些其他的重要顺式作用元件,如内含子剪接增强子(ISE)和沉默子(ISS)、外显子剪接增强子(ESE)和沉默子(ESS)等(图1A)。在剪接过程中,剪接体(一种大型多聚体核糖核蛋白(RNP)复合物)的产生发挥重要作用(图1B)。之后,pre-mRNA分子经历各种剪接事件生成不同类型的AS,如:外显子跳跃(ES)、3'或5'剪接位点替代(A3SS或A5SS)、互斥外显子(MXE)、内含子保留(IR)等(图1C)。因此,pre-mRNA的AS事件可显著扩大转录组的复杂性,从而扩大蛋白质组的多样性。
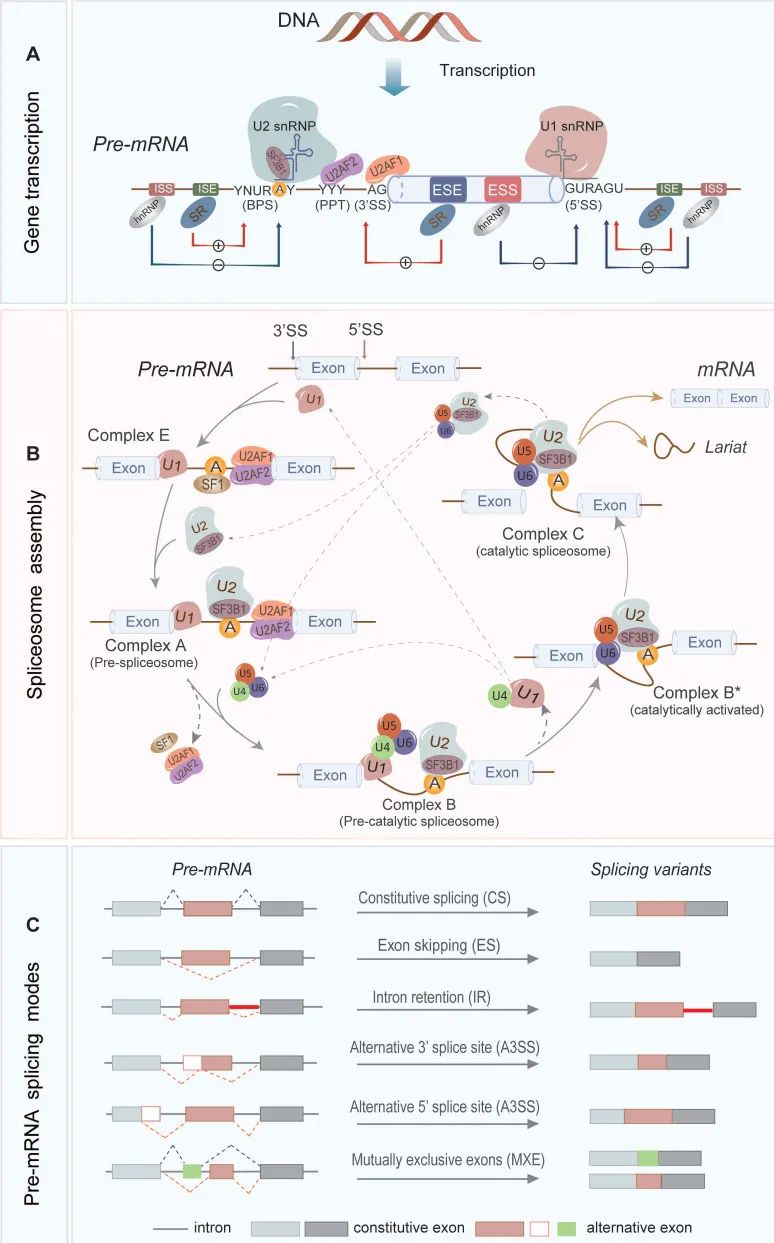
图1 RNA剪接的调控机制和模式(Liu et al., 2023)。
可变剪接与非编码RNA
科学家们将通过pre-mRNA的位点选择性剪接实现外显子选择性重组的过程称为选择性剪接(即可变剪接,AS),由剪接体(主要成分为富含U的小核RNA(snRNA)和小核核糖核蛋白颗粒(snRNP))调节,其中U1、U2、U4、U5和U6是代表性的snRNP(Choi et al., 2023)。而外显子和内含子是根据顺式调节序列和反式作用因子(例如RNA结合蛋白)的存在和相互作用来识别的,即顺式调节序列通过将反式作用因子募集至增强子或沉默子位点来激活或抑制附近剪接位点的占据,从而调节AS。
据报道,在人类中,约90%–95%的多外显子基因可通过AS产生不同的RNA转录本。因此,每个基因都有机会产生多种剪接变体。迄今为止,已鉴定出了七种基本类型的AS事件,其中,ES是高等真核生物中最常见的类型,其次是A3SS或A5SS;而IR是植物和低等后生动物中常见的AS结果(Choi et al., 2023)。
最近的研究发现,除了编码RNA之外,非编码RNA(ncRNA)也与AS有着千丝万缕的联系。pre-lncRNA或pre-mRNA的AS可产生多种不同类型的ncRNA。此外,ncRNA还可通过与顺式作用元件或反式作用因子相互作用来参与AS调节(Liu et al., 2023)。多项研究表明ncRNA的异常表达以及ncRNA相关的AS事件与各种恶性肿瘤的起始、进展以及耐药有关(图2)。
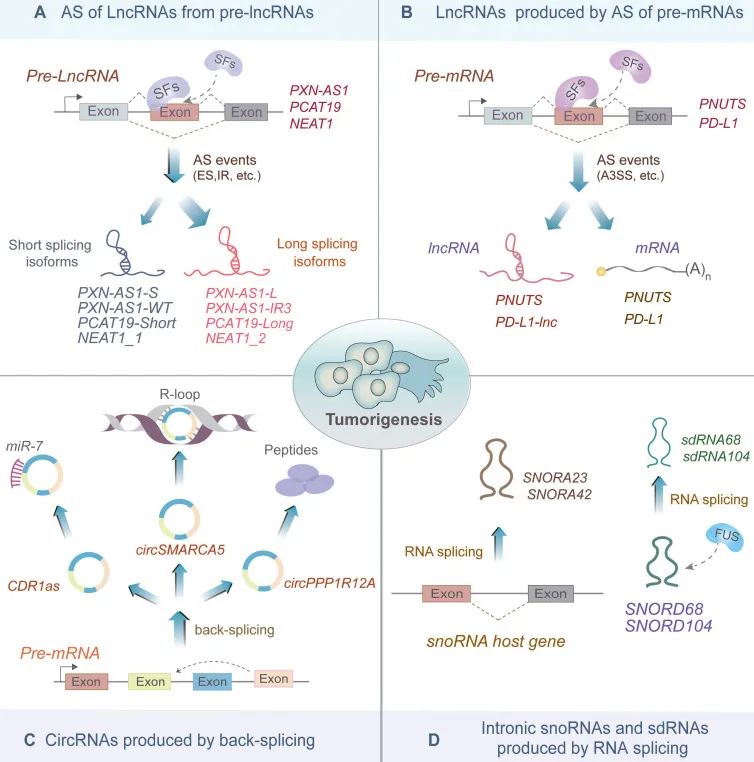
图2 由RNA剪接产生的非编码RNA(Liu et al., 2023)。
在本篇文章中,小医将重点介绍lncRNA与AS的关系及最新研究进展。
LncRNA简介
基因组中lncRNA基因的比例很大程度上取决于物种,如酿酒酵母中只有1%的基因是lncRNA基因,而在人类中,它们占所有已识别基因的82%(图3)。NONCODEv6是一个收集和注释17个不同物种lncRNA的公共数据库,已记录了涵盖355074个lncRNA基因的总共549813个转录本,包括来自文献和其他公共数据库(如Ensembl、RefSeq、lncRNAdb和GENCODE)中新鉴定的lncRNA(Khan et al., 2023)。
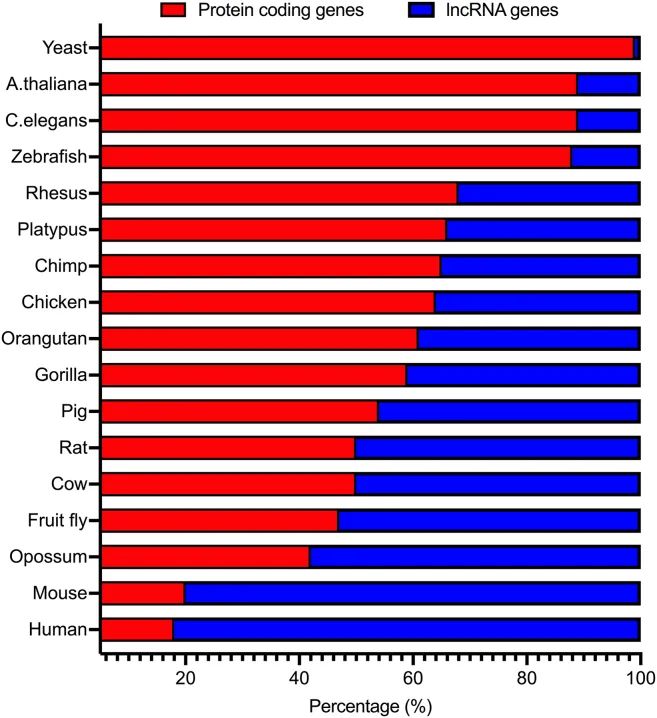
图3 跨物种蛋白质编码基因(PCG)和lncRNA的相对百分比(Khan et al., 2023)。
与PCG类似,lncRNA亦由内含子和外显子组成,可以产生多个剪接变体。虽然lncRNA的内含子和外显子通常比PCG的长,但每个lncRNA的平均外显子数量低于PCG,这也是为什么AS从lncRNA产生的平均转录本较低的原因。有研究人员从GENCODE数据库中检索了1062个人类lncRNA转录本的剪接信息,发现这些lncRNA转录本中AS类型事件的分布总体上与蛋白质编码转录本非常相似。但关于lncRNA AS事件的调控机制和生物学功能目前仍然知之甚少。
LncRNA中的AS事件
研究显示,AS调节涉及lncRNA的主要机制可分为三种方式:
(1)lncRNA与特定snRNP剪接因子(SF)相互作用。lncRNA在剪接中的作用的最初假设之一是通过对人类和小鼠细胞进行全基因组筛选,其中,lncRNA的一个子集可被SF识别,以两种方式影响它们的活性:①调节它们的翻译后修饰;②调节与其他SF和/或蛋白质编码的pre-mRNA相互作用(Romero-Barrios et al., 2018)。
(2)lncRNA与pre-mRNA分子形成RNA-RNA双链体。一类特殊的lncRNA由天然反义转录本(NAT)定义,NAT是从蛋白质编码基因的相反链转录的,并且可以或不可以与编码序列的部分重叠。有研究证明,重叠反义转录物的转录可以调节剪接位点的偏好,从而影响单个基因座的选择性剪接变体的群体。另有研究指出这些重叠反义转录物共同调节的典型案例暗示了具有双重作用的RNA的存在,即编码蛋白质和发挥RNA分子本身的作用,调节邻近基因的剪接(Romero-Barrios et al., 2018)。
(3)lncRNA影响染色质重塑,从而微调靶基因的剪接。一些lncRNA参与染色质结构确定和动态,可能会影响剪接输出,特别是通过以下三种方式:①lncRNA和形成异源双链体的DNA之间的直接相互作用;②将染色质修饰剂招募到特定位点;③塑造细胞核内染色质构象的3D组织(Romero-Barrios et al., 2018)。
下面,小医就通过相关实例一一展示吧。
最近,在恶性肿瘤中报道了一种与SF相互作用的lncRNA,即LINC01133,其显示出组织和器官特异性表达模式,并与不同的恶性肿瘤相关,直接被AS因子SRSF6识别,以SRSF6依赖性方式抑制肿瘤转移。该lncRNA作为AS的诱饵元件调节SRSF6活性,以塑造SRSF6 mRNA靶标的AS亚型群体(Kong et al., 2016)。
2023年7月18日,Cellular and Molecular Gastroenterology and Hepatology 杂志在线发表了题为“Alternative Splicing of lncRNAs From SNHG Family Alters snoRNA Expression and Induces Chemoresistance in Hepatoblastoma”的研究性论文,本文首次对肝母细胞瘤(HB)中的lncRNA AS事件进行了全面分析,阐明了一种涉及lncRNA SNHG家族和剪接调节因子PABPN1的新型转录后调节机制,该机制导致HB中snoRNA表达下调,为HB的分子发病机制提供了新的见解,并强调了AS作为这种儿童肝脏肿瘤治疗靶点的潜力(图4)。
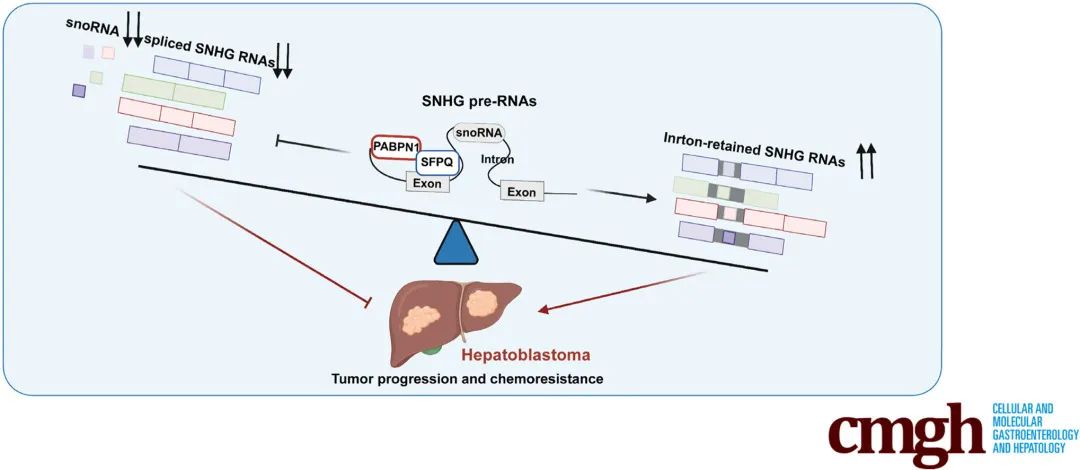
图4 内含子保留在HB中调节snoRNA表达作用机制示意图(Zhen et al., 2023)。
近年来的研究显示,lncRNA的差异AS事件可能会产生功能ORF,从而导致通过特定剪接变体产生小肽(图5)。如HOXB-AS3 lncRNA基因位点由5个外显子组成,可通过AS产生多种剪接变异体。其中两个已进行功能表征:NR_033201.2变体具有跨越外显子4和5的小ORF,编码53氨基酸长的微肽,这种微肽直接与hnRNPA1相互作用,调节PKM剪接。NR_033202.2剪接变体不编码这种微肽,但可通过增强核糖体RNA的转录来促进肿瘤细胞的增殖。
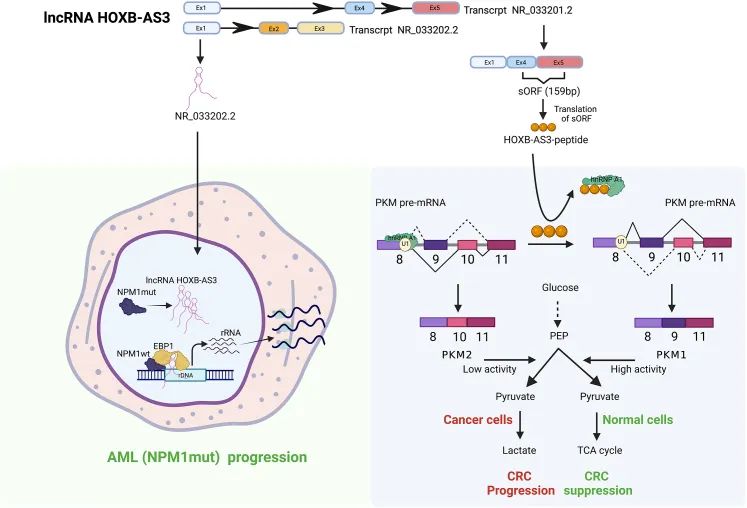
图5 通过lncRNA剪接变体生产微肽示意图(Khan et al., 2023)。
LncRNA剪接变体与疾病治疗
有学者指出,异常AS的出现可作为疾病诊断的生物标志物,并用作新型治疗解决方案的新目标。该领域的许多研究都集中在PCG上,但鉴于lncRNA的重要生物学功能,特定lncRNA剪接变体的异常表达最近受到越来越多的研究关注。据报道,由于致癌或基因毒性应激导致的lncRNA基因异常AS调节,在包括各种肿瘤在内的多种疾病中特异性表达(图6)。
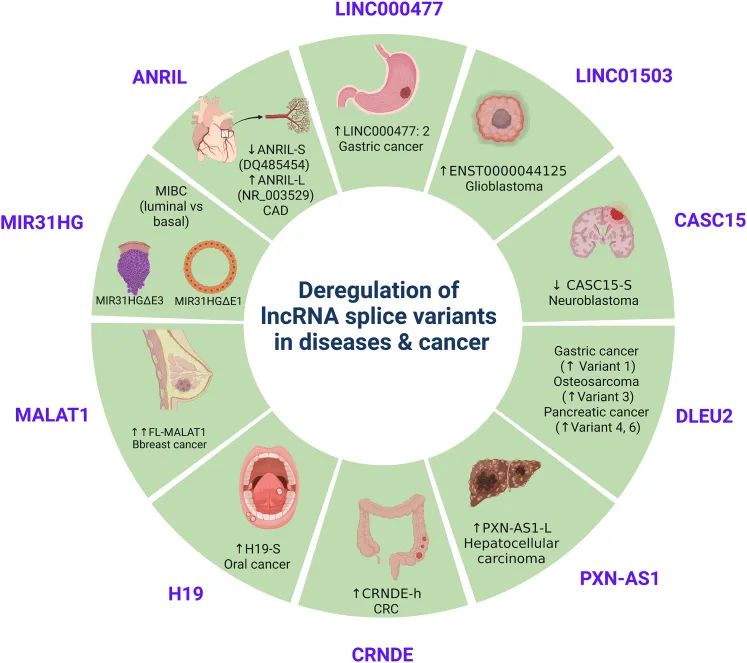
图6 LncRNA剪接变体在包括多种恶性肿瘤在内的多种疾病中失调的示例(Khan et al., 2023)。
为了鉴定可以调节疾病的AS靶点药物,研究者已进行了大量的临床前工作。然而,这些研究中只有一小部分关注了lncRNA剪接改变,并且已开发出的小分子药物不会诱导剪接过程的整体抑制,即存在脱靶效应。针对差异性AS,已开发出的方法还有RNAi、反义寡核苷酸(ASO)、CRISPR/Cas9基因编辑系统,但现有方法都存在局限性。因此,在进一步的临床研究之前,需要更充分了解lncRNA的AS机制。
参考文献
Choi S, Cho N, Kim KK. The implications of alternative pre-mRNA splicing in cell signal transduction. Exp Mol Med. 2023;55(4):755-766.
Liu M, Zhang S, Zhou H, et al. The interplay between non-coding RNAs and alternative splicing: from regulatory mechanism to therapeutic implications in cancer. Theranostics. 2023;13(8):2616-2631.
Khan MR, Avino M, Wellinger RJ, Laurent B. Distinct regulatory functions and biological roles of lncRNA splice variants. Mol Ther Nucleic Acids. 2023;32:127-143.
Kong J, Sun W, Li C, et al. Long non-coding RNA LINC01133 inhibits epithelial-mesenchymal transition and metastasis in colorectal cancer by interacting with SRSF6. Cancer Lett. 2016;380(2):476-484.
Romero-Barrios N, Legascue MF, Benhamed M, Ariel F, Crespi M. Splicing regulation by long noncoding RNAs. Nucleic Acids Res. 2018;46(5):2169-2184.
Zhen N, Zhu J, Mao S, et al. Alternative Splicing of lncRNAs From SNHG Family Alters snoRNA Expression and Induces Chemoresistance in Hepatoblastoma. Cell Mol Gastroenterol Hepatol. 2023;S2352-345X(23)00136-4.




















 1万+
1万+

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








