在生命科学领域,蛋白质是细胞功能的执行者,而它们的相互作用则构成了复杂的“社交网络”,调控着几乎所有生命活动。从基础研究到药物开发,精确解析蛋白质间的相互作用是揭示疾病机制和发现治疗靶点的关键。随着技术的迭代更新,科学家们拥有了多种工具来捕捉这些看不见的蛋白互作现象。
01 传统技术:经典但局限
(1)免疫共沉淀(Co-IP)
作为蛋白质互作研究的经典方法,Co-IP基于抗原-抗体特异性结合的原理。它利用针对目标蛋白(诱饵蛋白)的抗体将其“捕获”,同时将与其相互作用的伙伴蛋白也沉淀下来。
①技术优势:最大亮点在于在接近生理状态下进行,使用非变性细胞裂解液,保留了蛋白质相互作用的天然状态。它操作相对简单、成本较低,且适用于各种细胞和组织类型。
②局限性:Co-IP高度依赖高质量抗体,而抗体的选择往往决定实验成败。它对瞬时作用和低亲和力的蛋白质相互作用无能为力,且容易出现假阳性结果。当内源蛋白表达量低时(如某些组织特异性蛋白),实验难度显著增加。
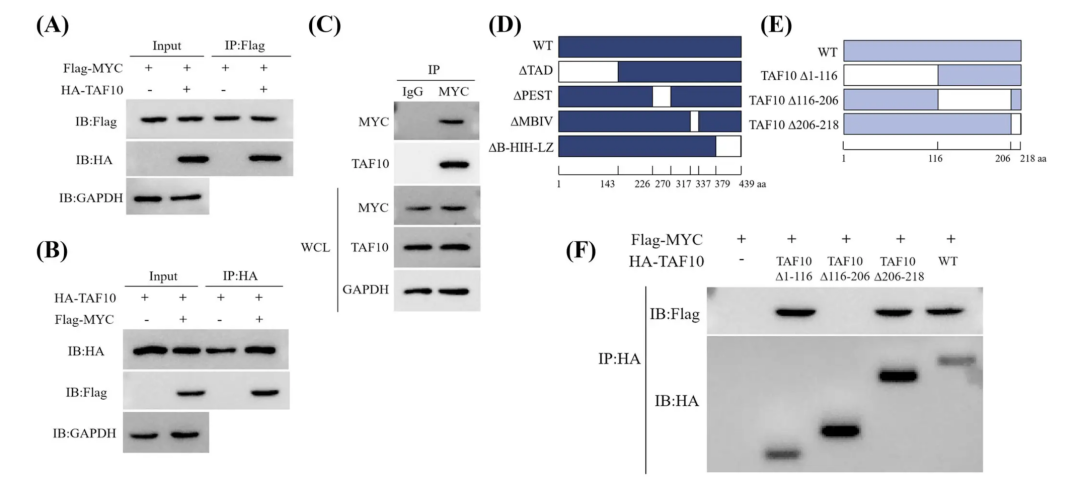
图1 Co-IP实验验证MYC与TAF10在MCF7细胞中的互作(Xiong et al., 2023)。
(2)GST Pull-Down
与Co-IP不同,GST Pull-Down主要在体外环境中验证蛋白间的直接相互作用。该技术将谷胱甘肽-S-转移酶(GST)标签融合到诱饵蛋白上,利用GST与谷胱甘肽磁珠的特异性结合能力“钓”出互作蛋白。
①技术优势:无需高质量抗体,可直接验证蛋白质间的直接相互作用。洗脱纯度高,结果明确。
②局限性:实验在非生理条件下进行,无法反映细胞内真实状态。GST标签可能改变蛋白质的天然折叠结构,影响实验结果。对于某些功能相关的蛋白质(如参与氧化还原反应的蛋白),GST本身的生理活性可能干扰实验结果。
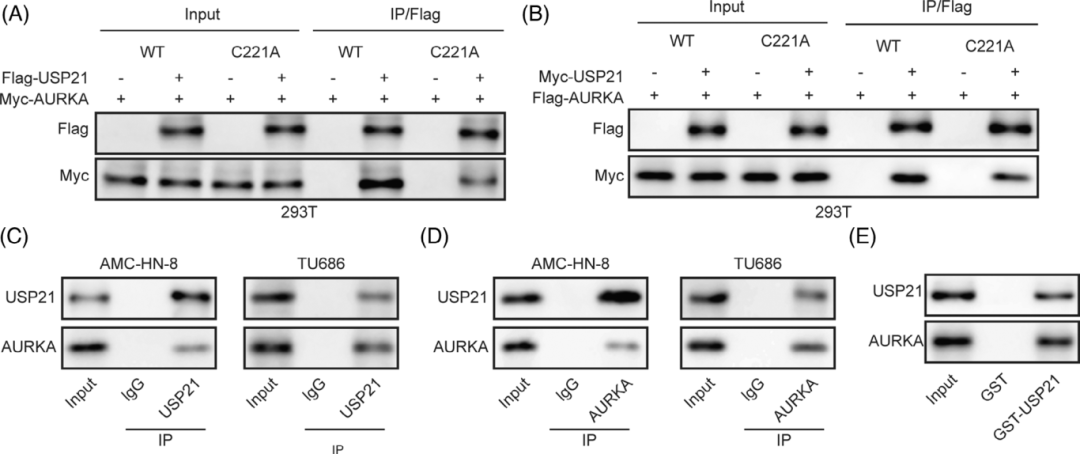
图2 Co-IP和GST Pull-down共同验证USP21和AURKA的互作(Wang et al., 2023)。
02 新兴技术:精准捕捉的新锐力量
(1)邻近标记技术(Proximity Labeling)
作为近年发展最快的互作研究技术,邻近标记利用工程化的生物素连接酶(如TurboID、APEX)与目标蛋白融合表达。当酶被激活时,会将生物素共价标记到邻近的蛋白质上(标记半径约10-20nm)。这些被标记的蛋白质随后可通过链霉亲和素磁珠富集,并通过质谱鉴定。
①技术优势:
1、在接近生理状态下捕获互作蛋白;
2、可捕捉瞬时或弱相互作用;
3、适用于低丰度蛋白和膜蛋白研究;
4、可分析亚细胞器定位的蛋白质组分。
②局限性:
存在一定程度的非特异性标记,依赖于细胞转染技术。无法对组织样本的蛋白互作情况进行分析。
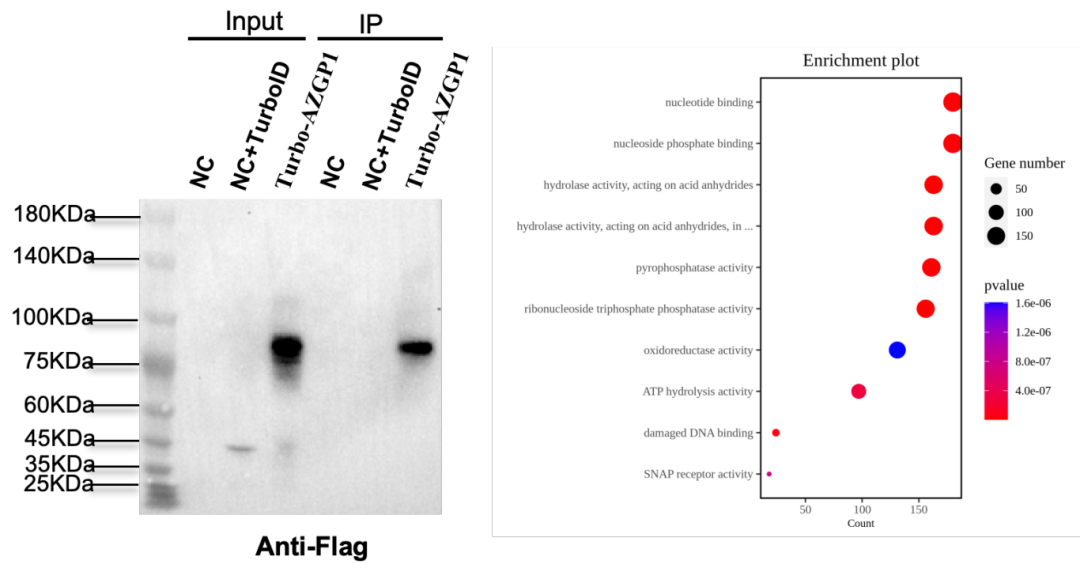
图3 我司案例:邻近标记技术筛选AZGP1的互作蛋白。
(2)邻近连接技术(PLA)
PLA巧妙地将免疫分析与核酸扩增技术结合。使用一对带有独特DNA序列的抗体识别目标蛋白或互作蛋白对。当两个抗体足够接近(<40nm)时,其携带的DNA序列可连接形成环状DNA模板,通过滚环扩增产生可检测信号。
①技术优势:
1、可检测稳定、瞬时和微弱的蛋白互作;
2、灵敏度极高(飞摩尔级别);
3、可进行单细胞水平定位分析
②局限性:探针设计复杂,成本较高。
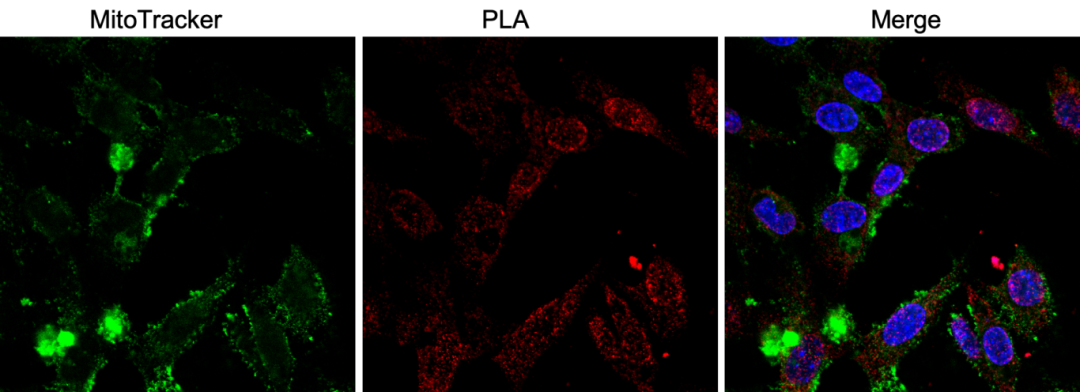
图4 我司案例:A蛋白和B蛋白互作定位于细胞核和线粒体。
(3)荧光共振能量转移(FRET)
FRET技术通过能量转移效率反映分子间距离,是研究活体生物大分子纳米级距离变化的强大工具。当供体荧光分子与受体荧光分子距离小于10nm,且光谱重叠时,供体激发能量可非辐射转移至受体,使其发光。
①技术优势:
1、纳米级空间分辨率(1-10nm);
2、适用于活细胞动态监测;
3、高时间分辨率(毫秒级)。
②局限性:需要特殊设备,数据分析及其复杂。
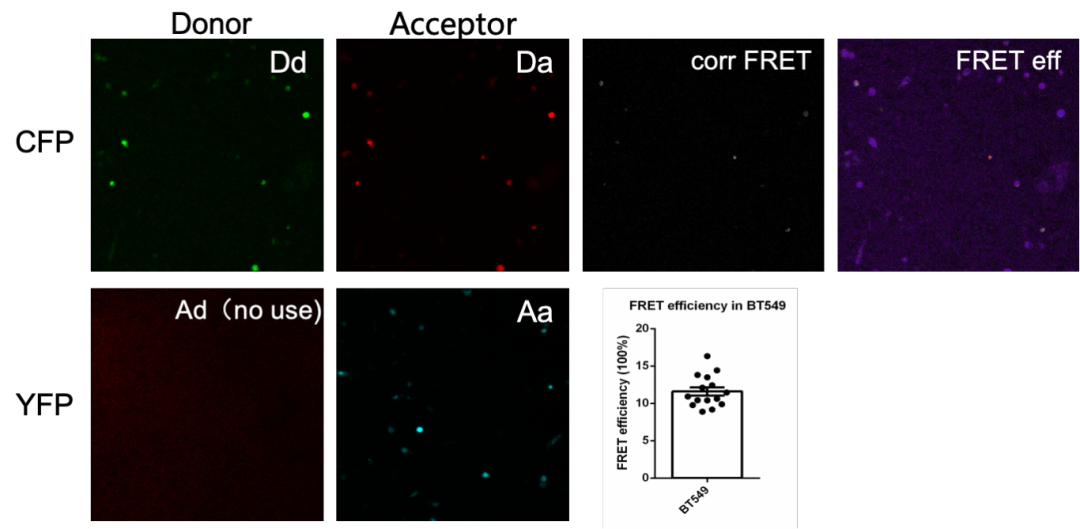
图5 我司案例:ERGIC3和EIF1AX在BT549细胞中FRET效率可视化图。
03 五大蛋白互作检测技术全景比较
五种主流蛋白互作检测技术特性对比表

1.信号通路初探与互作网络筛选:邻近标记技术凭借高通量特性成为首选。TurboID等技术能在活细胞环境中捕获包括瞬时作用在内的互作网络,为后续研究提供丰富线索。
2.直接互作验证:GST Pull-Down是验证两蛋白是否直接结合的“金标准”。它在体外环境中排除了细胞因素的干扰,提供直接证据。
3.体内互作确认:Co-IP在生理环境下验证蛋白质相互作用方面仍有不可替代的地位。结合Western blot,可明确目标蛋白在体内的结合伴侣。
4.临床样本分析与单细胞研究:PLA技术凭借其超高灵敏度和定位能力,在病理切片分析和微量样本检测中表现出色。
5.动态监测与药物开发:FRET技术以其高时空分辨率在活体动态分析中独占鳌头。在药物释放动力学研究和酶活性实时监测方面有独特优势。
在蛋白互作研究的舞台上,没有绝对的“赢家”,只有最合适的工具选择。从经典的Co-IP到前沿的邻近标记、PLA、FRET等技术,每种方法都像不同焦距的镜头,为我们揭示蛋白质世界不同层次的互动景观。
参考文献
Xiong Y,Wang L, Xu S, et al. Small molecule Z363 co- regulates TAF10 and MYC via the E3 ligaseTRIP12 to suppress tumour growth[J]. Clinical and Translational Medicine, 2023, 13(1): e1153.
Wang Q D, Shi T, Xu Y, et al. USP21 contributes to the aggressiveness of laryngeal cancer cells by deubiquitinating and stabilizing AURKA[J]. The Kaohsiung Journal of Medical Sciences, 2023, 39(4): 354-363.




















 701
701

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








