
一,摘要
sticker:(有图或文字的)粘贴标签,贴纸
spacer:隔离物/隔离片,间隔


二,引言






三,材料
其中每个残基、亚区域或结构域都可以被指定为:
sticker:生物分子中促进分子间吸引力相互作用的区域,这些相互作用决定了组装观察到的浓度没,产生可逆的物理交联,控制化学计量或非化学计量复合物的形成;
spacer:分散在sticker之间,影响聚合物的浓度,确定凝聚物内在的拓扑结构,并调节sticker介导的相互作用的协同性;
——》我感觉更像是功能区域domain和linker,或者说可以类比为gene-junk DNA(这里是简单类比,应该是从信息编码程度上,也就是说信息密度上,比如说可以使用香农熵或者是Gini指数),所以其实可以编码为有2个隐状态的HMM,再依据序列feature进行详细分析
(比如说可以先识别linker,再对非linker做一个无监督聚类,聚成几类看目的需求)
- stickers(粘性位点):在该模型中,stickers是指那些能够参与并形成较强分子间相互作用的特定位置或基团,它们对分子间的聚集等行为有重要影响。
- spacers(间隔位点):与stickers相对,spacers是那些主要起到间隔作用、对分子间相互作用贡献较小的位置或基团。

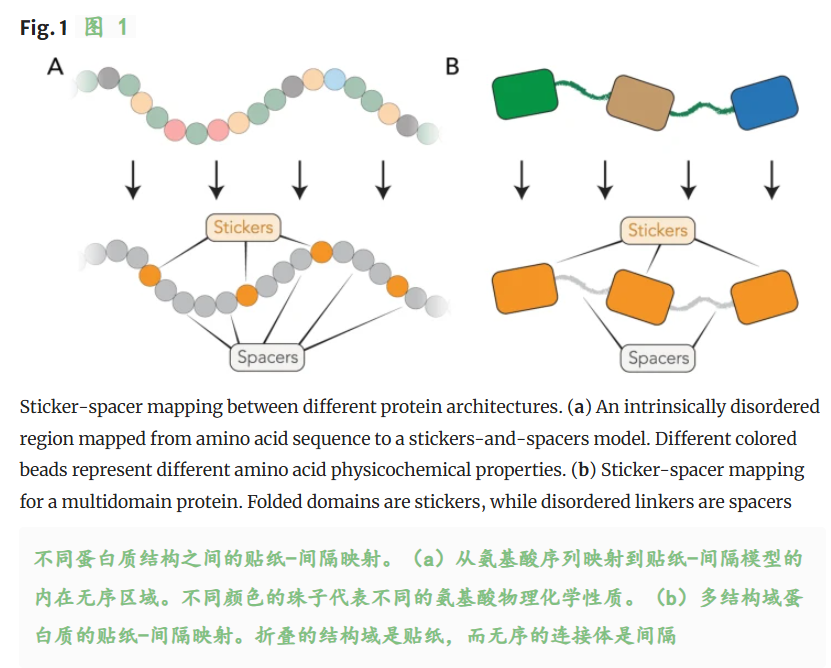
折叠的结构域是贴纸,而无序的连接体是间隔。



离散化的简化:多价相互作用的驱动因素是生物聚合物上的特定残基或区域


这里提到的饱和浓度,
1. 饱和浓度
饱和浓度是指在一定条件下,蛋白质或多肽溶液达到最大组装程度时的浓度。当溶液中的蛋白质浓度达到饱和浓度时,组装过程会趋于平衡,进一步增加浓度对组装的促进作用会减弱。换句话说,饱和浓度是组装驱动力的一个重要指标:
- 饱和浓度越高,意味着需要更高的蛋白质浓度才能达到组装的平衡状态,这表明组装驱动力相对较弱。
- 饱和浓度越低,则说明组装驱动力较强,蛋白质更容易在较低浓度下组装。
2. 组装驱动力减弱的程度
“组装驱动力减弱的程度”可以理解为饱和浓度的变化。如果饱和浓度增加,说明组装驱动力减弱了,因为需要更高的浓度才能达到组装的平衡状态。反之,如果饱和浓度降低,则组装驱动力增强。
对芳香族氨基酸的影响
在文中提到的“贴纸和间隔物”模型中,芳香族氨基酸(如苯丙氨酸、酪氨酸和色氨酸)被视为“贴纸”,它们通过疏水作用或π-π堆积作用促进蛋白质的组装。
- 芳香族氨基酸的移除对饱和浓度的影响:如果从蛋白质序列中移除芳香族氨基酸,会削弱蛋白质之间的相互作用,从而增加饱和浓度。这是因为芳香族氨基酸的移除减少了“贴纸”的数量或强度,使得蛋白质之间的吸引力减弱,需要更高的浓度才能达到组装的平衡状态。
- 饱和浓度对移除位置的不敏感性:文中提到,对于低复杂性结构域,饱和浓度的增加(即组装驱动力减弱的程度)相对不受芳香族氨基酸移除位置的影响。这表明在这些结构域中,芳香族氨基酸的分布可能较为均匀,或者它们对组装的贡献是整体性的,而不是依赖于特定位置的残基。
总结
- 饱和浓度是衡量蛋白质组装驱动力的一个指标,饱和浓度越高,组装驱动力越弱。
- 芳香族氨基酸作为“贴纸”,对蛋白质组装有重要影响。移除芳香族氨基酸会增加饱和浓度,表明组装驱动力减弱。
- 对于低复杂性结构域,饱和浓度对芳香族氨基酸移除位置的不敏感性,说明其组装特性可能更多地依赖于整体的残基分布,而不是特定位置的残基。
其实我的理解逻辑是:
关于饱和浓度与组装驱动力
- 饱和浓度的定义:饱和浓度是指蛋白质在溶液中达到某种平衡状态时的浓度,此时蛋白质的组装过程达到动态平衡。换句话说,只有当蛋白质的浓度达到饱和浓度时,组装过程才会显著发生。
- 饱和浓度与组装驱动力的关系:
- 如果饱和浓度很高,这意味着蛋白质需要达到一个很高的浓度才能开始组装。换句话说,组装的“门槛”很高。
- 由于这个“门槛”很高,平时的浓度很难达到饱和浓度,因此组装过程不容易发生。从这个角度看,组装的驱动力可以被认为是比较弱的因为,很难达到触发组装的条件。

——》这里的Csat的简单sticker数目倒数关系,个人理解逻辑如下:
- 从分子间相互作用角度:csat可以是一个衡量分子间相互作用强度的指标。当分子间的相互作用较强(如stickers较多)时,分子更容易聚集,饱和浓度(csat)会降低;反之,当相互作用较弱时,饱和浓度会升高。
- 饱和浓度是指蛋白质在溶液中达到某种平衡状态时的浓度,此时蛋白质的组装过程达到动态平衡
- Stickers的作用
Stickers是蛋白质上能够与其他蛋白质发生强相互作用的位点。它们是蛋白质复合物组装的关键区域。如果一个蛋白质上有更多的stickers,那么它与其他蛋白质的结合能力会更强,因为有更多的“粘性位点”可以参与相互作用。 - Stickers数量与csat的关系
- Stickers数量多:如果一个蛋白质上有较多的stickers,那么它更容易与其他蛋白质结合形成复合物。在这种情况下,为了达到复合物组装的平衡状态,所需的未结合状态的蛋白质浓度(即csat)会较低。因为蛋白质很容易结合,所以不需要很高的自由浓度就能达到平衡。
- Stickers数量少:相反,如果一个蛋白质上的stickers数量较少,那么它与其他蛋白质的结合能力会减弱。为了达到复合物组装的平衡状态,需要更高的未结合状态的蛋白质浓度(即csat更高),因为只有在较高浓度下,蛋白质才有足够的机会通过较少的stickers结合。
- 数学关系

举例说明
假设有一个蛋白质A:
- 如果蛋白质A上有5个stickers,它很容易与其他蛋白质结合,因此csat可能很低(比如0.1 mM)。
- 如果蛋白质A上只有1个sticker,它与其他蛋白质结合的难度增加,因此csat会更高(比如1.0 mM)。
物理意义
这个关系反映了蛋白质复合物组装的热力学平衡。蛋白质复合物的形成是一个动态平衡过程,平衡点取决于蛋白质之间的相互作用强度。Stickers数量越多,相互作用越强,平衡时所需的自由蛋白质浓度就越低;stickers数量越少,相互作用越弱,平衡时所需的自由蛋白质浓度就越高。
总结
- Stickers数量与csat成反比:更多的stickers意味着更强的结合能力,因此需要更低的自由蛋白质浓度(csat)来达到平衡。
- 生物学意义:这一关系可以帮助我们理解蛋白质复合物的组装机制,以及如何通过改变蛋白质上的stickers数量来调节复合物的稳定性。
 尽管从简单的角度来看,间隔序列对于饱和浓度(csat)的决定作用不如粘性残基重要,但间隔序列可以调节凝聚体的物质状态。考虑到这一点,间隔序列的主要贡献在于聚合物的溶解度和凝聚体的物质状态。这里的“饱和浓度(csat)”是指生物大分子相分离发生时的浓度阈值。凝聚体是相分离后形成的生物大分子聚集物,间隔序列通过调节聚合物的溶解度,使生物大分子能够在合适的浓度范围内进行相分离,并且影响凝聚体的物理性质,如硬度、流动性等。
尽管从简单的角度来看,间隔序列对于饱和浓度(csat)的决定作用不如粘性残基重要,但间隔序列可以调节凝聚体的物质状态。考虑到这一点,间隔序列的主要贡献在于聚合物的溶解度和凝聚体的物质状态。这里的“饱和浓度(csat)”是指生物大分子相分离发生时的浓度阈值。凝聚体是相分离后形成的生物大分子聚集物,间隔序列通过调节聚合物的溶解度,使生物大分子能够在合适的浓度范围内进行相分离,并且影响凝聚体的物理性质,如硬度、流动性等。

四,方法
“标签和间隔”模型提供了蛋白质的一般和简化表示,通过改变预期的“标签和间隔”结构的蛋白质变体,可以很容易地检验特定的假设。除了作为分子表示的方便工具之外,该框架还沉浸在长期的定量实现历史中,允许聚合物结构和溶液行为之间的严格映射。






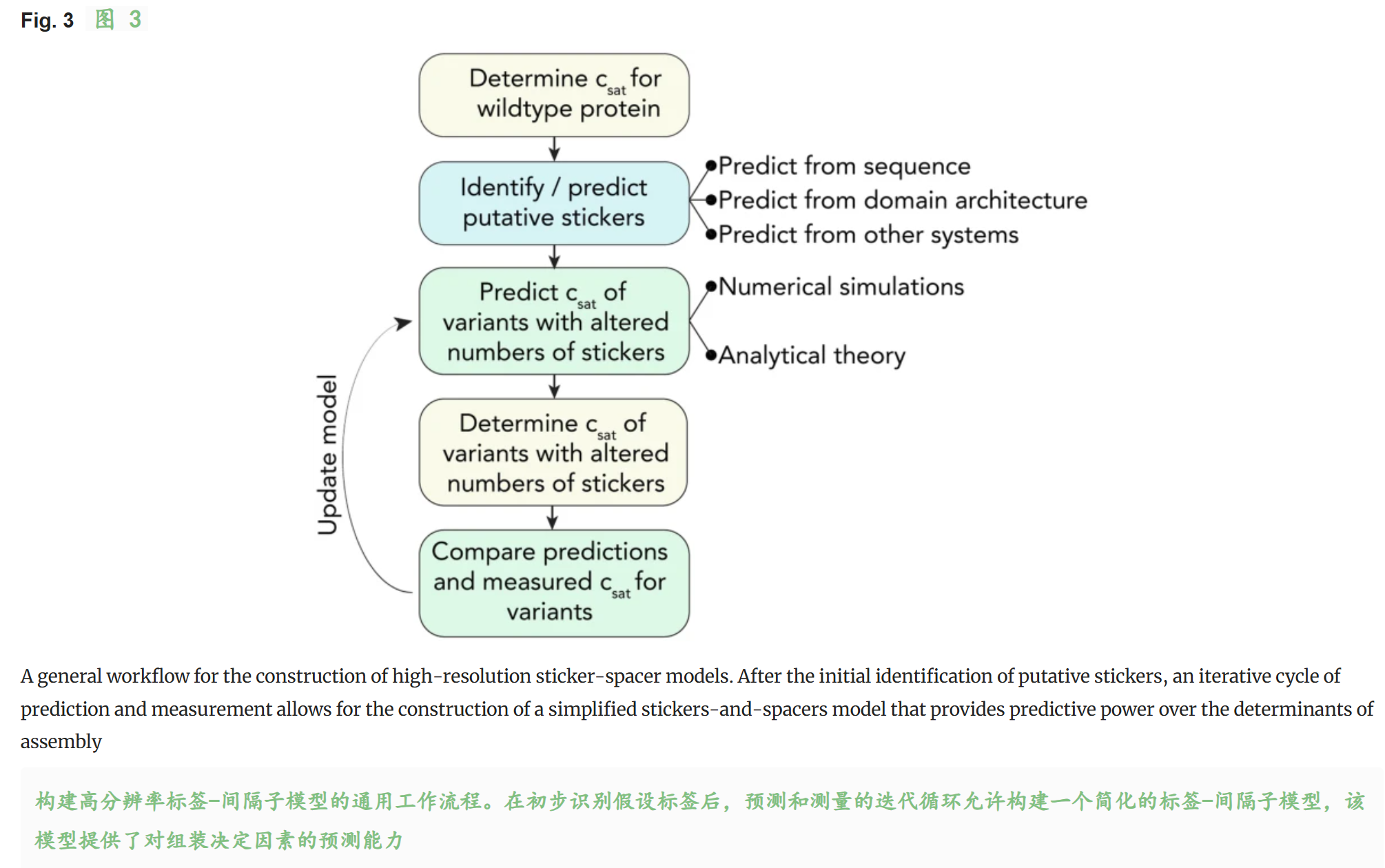
五,注释
1,Identification of Stickers in Intrinsically Disordered Regions
识别IDR区域中的sticker


- π - π相互作用是指芳香环之间的相互作用,例如两个苯环之间的相互作用。这种相互作用是由于芳香环的π电子云之间的弱静电吸引产生的。阳离子 - π相互作用是指带正电荷的离子(如赖氨酸和精氨酸的侧链)与芳香环之间的相互作用。

首先是带电性质:整体净电荷,及其分布模式:
- 整体净电荷和电荷分布模式的影响:蛋白质分子的整体净电荷(即正电荷和负电荷的总和)以及带电氨基酸残基在蛋白质序列中的分布模式(即电荷分布的规律性)都会影响蛋白质相变的驱动力。例如,如果蛋白质分子的整体净电荷为正,那么在一定条件下,它可能会更容易与其他带负电荷的分子发生相互作用,从而促进蛋白质的聚集。而电荷分布的不均匀性可能会导致蛋白质分子内部的静电相互作用更加复杂,进而影响蛋白质的构象和相变行为。
另外什么是静电效应,以及溶剂化效应:
静电与溶剂化效应的复杂相互作用
- 静电效应:带电氨基酸残基之间的静电相互作用是蛋白质相变的重要驱动力之一。当蛋白质分子中的带电残基相互靠近时,它们之间会产生静电吸引或排斥力。例如,正电荷残基与负电荷残基之间的静电吸引可以促进蛋白质分子之间的结合,而相同电荷残基之间的静电排斥则可能会阻碍蛋白质的聚集。
- 溶剂化效应:溶剂分子(如水分子)与蛋白质分子之间的相互作用也会影响蛋白质的相变。溶剂分子可以通过氢键、范德华力等与蛋白质分子发生作用,从而影响蛋白质的构象和稳定性。带电氨基酸残基的存在会改变蛋白质周围的溶剂化环境,进而影响蛋白质的相变行为。例如,带电残基可能会吸引更多的水分子,形成水合层,从而影响蛋白质分子之间的相互作用力。
详细解释就是:
1. 静电效应(Electrostatic Effect)
静电效应是指由于电荷的存在而产生的相互作用力。在分子水平上,静电效应主要涉及带电粒子(如离子或极性分子)之间的吸引力或排斥力。
基本原理
- 库仑定律:静电效应的核心是库仑定律,它描述了两个点电荷之间的相互作用力。根据库仑定律,两个点电荷之间的力 ( F ) 与它们的电荷量 ( q1 ) 和 ( q2 ) 的乘积成正比,与它们之间的距离 ( r ) 的平方成反比,其中,( k ) 是库仑常数,( q1 ) 和 ( q2 ) 是两个电荷的电荷量,( r ) 是它们之间的距离。
- 静电吸引与排斥:
- 静电吸引:当两个电荷符号相反(一个正电荷和一个负电荷)时,它们之间会产生静电吸引力。
- 静电排斥:当两个电荷符号相同(都是正电荷或都是负电荷)时,它们之间会产生静电排斥力。
在生物分子中的作用
- 蛋白质结构:蛋白质中的氨基酸残基(如赖氨酸、精氨酸、天冬氨酸、谷氨酸等)带有电荷。这些带电残基之间的静电相互作用可以影响蛋白质的折叠和稳定性。例如,静电吸引可以促进蛋白质的二级结构(如α-螺旋和β-折叠)的形成,而静电排斥则可能阻止某些构象的形成。
- 蛋白质-蛋白质相互作用:蛋白质之间的静电相互作用是细胞内许多生物过程的基础。例如,酶与底物的结合、信号转导蛋白之间的相互作用等都可能依赖于静电效应。
- pH敏感性:蛋白质的静电效应与溶液的pH值密切相关。pH值的变化会影响氨基酸残基的电荷状态,从而改变蛋白质的静电相互作用。例如,当pH值低于氨基酸的等电点时,蛋白质可能带有正电荷;当pH值高于等电点时,蛋白质可能带有负电荷。
2. 溶剂化效应(Solvent Effect)
溶剂化效应是指溶剂分子与溶质分子之间的相互作用对溶质分子性质的影响。溶剂化效应在化学反应、分子溶解性和生物分子稳定性中起着重要作用。
基本原理
- 溶剂化作用:当溶质分子溶解在溶剂中时,溶剂分子会围绕溶质分子形成一个溶剂化层。这个过程称为溶剂化作用。溶剂化作用可以通过多种相互作用实现,包括:
- 氢键:溶剂分子与溶质分子之间通过氢键相互作用。
- 范德华力:溶剂分子与溶质分子之间通过范德华力相互作用。
- 静电相互作用:溶剂分子与溶质分子之间的静电相互作用。
- 溶剂化能:溶剂化能是指溶剂分子与溶质分子结合时释放的能量。溶剂化能的大小取决于溶剂和溶质之间的相互作用强度。通常,极性溶剂(如水)对极性溶质(如离子或极性分子)的溶剂化能较高,而非极性溶剂(如苯)对非极性溶质(如烃类)的溶剂化能较高。
在生物分子中的作用
- 蛋白质的溶剂化:蛋白质在水溶液中溶解时,水分子会围绕蛋白质分子形成水合层。这个水合层可以稳定蛋白质的结构,防止蛋白质分子之间的聚集。例如,水分子可以通过氢键与蛋白质中的极性氨基酸残基相互作用,从而维持蛋白质的三维结构。
- 溶剂化对蛋白质相变的影响:溶剂化效应可以影响蛋白质的相变行为。例如,当溶剂的极性发生变化时(如从水变为有机溶剂),蛋白质的溶剂化环境也会改变,从而影响蛋白质的聚集和分离行为。
- 离子强度的影响:溶液中的离子强度(即离子浓度)也会影响溶剂化效应。高浓度的离子可以通过屏蔽蛋白质分子之间的静电相互作用,从而改变蛋白质的溶剂化状态。例如,在高离子强度的溶液中,蛋白质分子之间的静电相互作用可能会被削弱,从而影响蛋白质的聚集行为。
总结
- 静电效应:主要涉及带电粒子之间的静电相互作用,影响分子的结构和相互作用。
- 溶剂化效应:主要涉及溶剂分子与溶质分子之间的相互作用,影响溶质分子的溶解性和稳定性。
在生物分子(如蛋白质)中,静电效应和溶剂化效应常常同时存在,并且相互影响。例如,蛋白质分子中的带电残基之间的静电相互作用会受到溶剂化环境的影响,而溶剂化环境也会受到蛋白质分子中带电残基的静电分布的影响。这种复杂的相互作用是生物分子功能和行为的基础。



2,Stickers and Spacers Are Inherently Context-Dependent
上下文依赖性,可以使用语言模型,或者说是使用具有receptor field的

- 局部化学环境对残基或区域的相互作用能力有调节作用:残基或区域所处的局部化学环境会影响其参与相互作用的能力,这种影响是显著且重要的。
- 电荷分布对残基相互作用能力的影响:以带正电荷的残基为例,当它被两个中性残基包围时,可以进行有利的静电相互作用;但如果被带负电荷的残基包围,这种相互作用能力很可能会丧失。这说明电荷分布(即残基周围电荷的排列情况)对残基的相互作用能力有关键性影响。

在体外实验中,如果缺少关键的结合伙伴,那么潜在的“sticker”就会表现得像“spacer”(间隔物)。因为体外实验无法完全模拟体内复杂的生物环境,很多在体内有特定功能的区域或残基,在体外可能无法表现出其应有的“粘性”特性。
这说明,其他生物分子所构成的环境对一个残基、区域或结构域是否作为“sticker”或“spacer”起着重要作用。生物体内存在着众多的生物分子,它们相互作用、相互影响,共同构成了一个复杂的系统。在这个系统中,一个区域或残基的功能表现并非孤立存在,而是受到周围分子环境的制约。
从理论上讲如果,能找到合适的互补结合伙伴,任何区域或结构域都有可能被定义为“sticker”。


3,The Role of Spacers



同一个蛋白质中可以同时存在多种不同的正交(即相互独立、不干扰)的sticker区域,这里的sticker可以理解为蛋白质上能够与其他分子相互作用的区域或结构。






1. Spacers的作用
- 概述:虽然前面的内容主要关注了“stickers”(粘贴区)的作用,但“spacers”在决定生物大分子的拓扑结构、动力学和相行为方面也起着关键作用。
- 相变中的作用:理论上,spacers对驱动相变的吸引相互作用贡献最小。因此,它们在决定凝聚体(condensates)动力学方面可能更有影响力,但不应显著改变饱和浓度(csat),尽管这种划分过于简化。
- 实验例子:
- FUS蛋白:在体外形成的FUS蛋白凝聚体会随着时间的推移失去内部动力学,变得像固体一样。将FUS低复杂性区域(FUS-LCD)中的谷氨酰胺残基替换为甘氨酸,不会显著改变FUS的饱和浓度,但凝聚体变得“永生”,在24小时内没有明显的动力学损失。
- 谷氨酰胺和丝氨酸的替换:如果单独研究FUS-LCD,将谷氨酰胺替换为丝氨酸(或反之)会导致csat的显著变化(约2倍),这表明spacers残基不应被视为惰性。
2. Spacers的分子生物物理特性
- 零阶近似:spacers的氨基酸组成可以调节凝聚体的动力学。
- 相分离与凝胶化:spacers残基可以影响相分离的驱动力,以及相分离辅助的渗透与无相分离的渗透之间的相互作用。根据关联聚合物理论,spacers残基是聚合物溶解度的主要决定因素。它们调节了粘贴残基参与分子间协同相互作用(导致相分离辅助的渗透)或非协同相互作用(导致无相分离的渗透,即系统跨越的凝胶化)的程度。
- 溶剂化状态:spacers的溶剂化状态可以定义贴纸-间隔区聚合物的全局尺寸。spacers的有效溶剂化体积可以决定贴纸-间隔区聚合物是否发生相分离(密度转变和密集相内的相关渗透转变)或仅仅凝胶化(系统跨越的渗透转变而无密度转变)。因此,虽然组装的驱动力可能不会显著改变,但组装模式可以通过间隔区的序列完全调节。
- 其他特性:
- 间隔区长度:间隔区长度提供了调节凝聚体网孔大小的可调参数,原则上,柔韧性可以调节流变学特性。
- 蛋白质间的混溶性:间隔区的组成和化学性质可以影响具有相似粘贴区的蛋白质之间的混溶性。例如,通过调节间隔区的溶剂化状态和粘贴区的强度,可以调节多相滴液的组织。
- 单价结合位点:间隔区还可以容纳额外的单价结合位点,有效地提供一个支架,通过它可以招募配体(我们定义为单价结合伙伴),而不与粘贴区相互作用竞争。通过重置底层分配函数,配体结合可以影响凝聚体组装,无论它是否与粘贴区相互作用竞争。
- 相互作用强度:粘贴区-间隔区、间隔区-间隔区和粘贴区-粘贴区的相对相互作用强度可以调节间隔区在凝聚体内部组织和csat方面的作用。
3. 对模型的看法
- 模型的局限性:虽然“stickers-and-spacers”模型可能被看作是忽略物理化学的复杂性和细微差别的一种手段,但作者认为恰恰相反。该模型提供了一个简单的零模型,定义了化学均质关联聚合物的极限期望。实际上,蛋白质不是简单的聚合物,因此简单模型所做的预测最终将无法捕捉由于化学和结构异质性而出现的特定特征。
- 模型的作用:对于在体外发生相分离的无序蛋白质,几乎所有残基都会以某种方式做出贡献。在这种情况下,粘贴区和间隔区的划分仅仅是粘贴区是那些不成比例地贡献吸引相互作用的残基或区域。如果在生理相关条件下,由“stickers-and-spacers”模型所做的预测失败,那么这是一个完美的工具,用于识别可能影响或调节生物分子组装的新且可能意想不到的特征。因此,“stickers-and-spacers”模型应该被视为我们如何将生物分子化学与更高阶组装联系起来的起点,而不是终点。






















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








