纳米颗粒在医疗保健和生物医学应用中的性能分析
T. Ruba、R. Tamilselvi、M. Parisa Beham 和 K. Muthukumaran
摘要
纳米颗粒在医疗保健中的应用最近已成为最具发展前景的研究平台之一,因为纳米材料展现出比传统材料更新颖且优异的性能,使得新的医学应用成为可能。纳米颗粒领域探索了广泛的生物医学应用,这些材料主要是纯有机或无机材料。受纳米颗粒独特特性、新颖性及其广泛应用的启发,本文对纳米材料在生物医学应用中的性能分析进行了全面综述。文中详细描述了纳米材料在生物医学领域中的新成果、新技术和新特性。
关键词 生物医学应用 · Health护理 · Nanomaterials·纳米颗粒 · Nanostructures· Nanosensitizers· Nanoprotectors
1 引言
纳米科学和纳米技术的进步在当前背景下极大地吸引了现代研究人员的关注。在最近一段时间,针对纳米材料在生物医学应用中的研究已广泛开展,涉及 100纳米到1纳米尺度范围内的材料的幻觉、利用与制造。纳米级颗粒正逐渐对人类健康产生重大影响,因此它们被广泛应用于诊断和治疗领域。纳米材料在生物医学领域的应用为抗击各种癌症、肿瘤和心脏疾病检测、骨髓生成以及其他疾病带来了众多机遇。通常,纳米材料根据维度分为三种类型:(i)量子点,即零维材料,其形状和直径具有多样性;(ii)纳米棒和纳米线属于一维材料;(iii)纳米带、纳米盘和纳米片则属于二维材料。
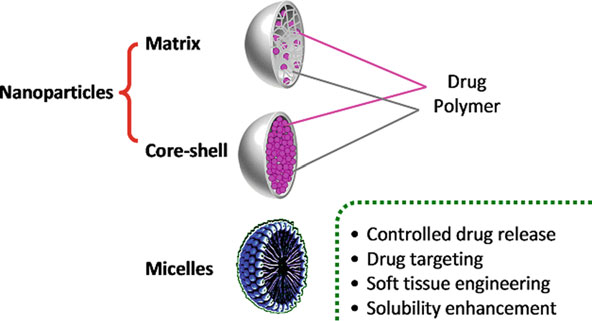
本文重点讨论用于不同生物医学应用的先进的纳米颗粒(NP)。与其他用于生物医学的现有材料相比,其成功率也非常高[1]。纳米颗粒(NPs)具有超小尺寸(见图1)、可调谐光学发射、增强的机械性能、极高的比表面积以及超顺磁行为等特性,使其在生物医学应用中广受欢迎。多功能纳米颗粒也广泛应用于诊断和治疗领域。目前存在大量特别适用于临床应用的纳米材料。其中,具有可控尺寸和形状的高质量纳米材料将实现可调节的响应。应根据纳米材料的特性选择适合特定应用场景的材料。生物医学应用所需的纳米材料常见特性包括极小尺寸、合适的颗粒表面、可控的形状、易于化学修饰以及良好的生物相容性。尽管多种纳米颗粒已面临生物医学应用的问题,但该领域仍处于发展之中,具体取决于应用场景和生物医学问题。这一快速发展的领域需要对当前可用的纳米颗粒和材料进行综述,以帮助研究人员进行选择。
本文的结构如下:第2节描述了纳米颗粒的分析与合成。第3节解释了纳米颗粒在MRI成像中的应用。第4节详细阐述了纳米颗粒作为放射增敏剂和放射保护剂用于放射治疗。第5节通过相关综述进行了详细推断,完成了本项工作。
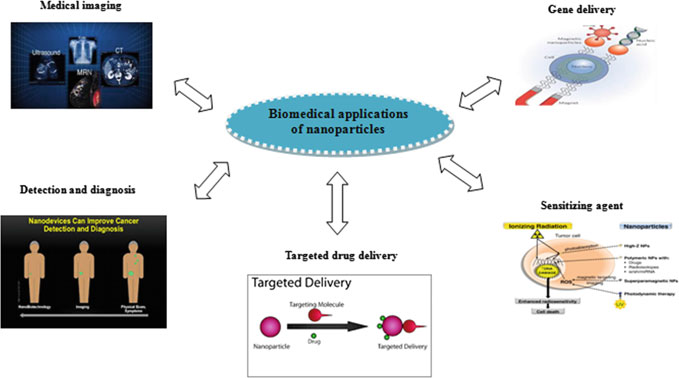
2 纳米颗粒的分析与合成
近十年来,越来越多的纳米颗粒被研究人员发现、实验和分析,特别是在生物医学应用领域。纳米材料在生物医学和医疗保健研究中的应用如图2所示。
迈尔‐豪夫等人[2]将纳米颗粒用于热疗并进行了分析。梁等人[1]提出了纳米金壳,其通过吸收近红外光后释放热量来破坏目标肿瘤细胞。在[3],采用磁控溅射法在玻璃载片上制备了银和铜纳米颗粒。在磁控溅射过程中,通过调节溅射时间和等离子体功率,可轻松控制纳米颗粒的尺寸和浓度。此外,合成银纳米颗粒需要更高的等离子体功率,且其成核时间比铜纳米颗粒更早。
赞佩里尼等人[4]合成并表征了纯羟基磷灰石(HA)和银修饰的羟基磷灰石(HA@Ag)纳米颗粒,以分析其抗真菌效果。胡等人[5]描述了一种新型荧光碳纳米颗粒——(C‐dots)碳点,其典型尺寸为<10 nm。这些碳点的所有物理和化学特性都非常优异。化疗药物的全身释放导致癌组织检测成为癌症治疗中的一个主要问题。为解决这一问题,布兰恩等人[6]提出了一种近红外响应的寡核苷酸包覆(AS1411、发夹结构或两者)金纳米片,负载阿霉素(DOX)。该体系在无触发释放时无毒。经过5分钟激光照射后,这些颗粒会变得对细胞具有强烈毒性,从而激活阿霉素释放。他们还证明,在无激光照射的情况下,未触发的载阿霉素缀合物仅引起轻微或无毒性,适用于
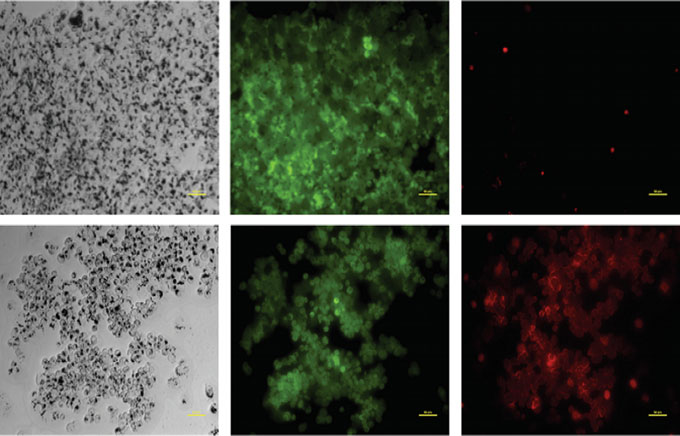
细胞,而激光触发的阿霉素释放则会导致显著的细胞死亡,如图3所示。
近年来,结肠靶向给药系统被广泛用于治疗结肠癌。Dicer底物小干扰RNA(DsiRNA)因其在靶向目的基因方面的优势而被用于癌症治疗,但其应用受到细胞摄取效率低和快速降解的限制。为解决这一问题,Katas等人[7]采用壳聚糖‐氧化石墨烯(CSGO)纳米复合材料以有效递送DsiRNA进入细胞。此外,使用果胶作为相容剂,以实现结肠的特异性释放,并保护纳米复合材料免受胃和小肠中严苛环境的影响。
此外,越来越多的研究致力于提高治疗效率,将光疗与其他现有治疗方法创造性地结合,可能在维持理想的肿瘤抑制效果的同时,减少对正常组织的难以忍受的毒性。
3 纳米颗粒用于MRI成像
有多种传统成像技术可用于诊断癌症。其中,磁共振成像(MRI)比其他技术提供更高的分辨率,并且具有非侵入性或至少是微创的。此外,其使用对比剂(CA)在MRI中的应用进一步减轻了其对比度问题并提高了灵敏度。为了增强和改善MRI图像的质量,使用了性能更优的纳米颗粒作为对比剂。这种成像技术称为纳米磁共振成像(nano‐MRI)。如今,氧化铁纳米颗粒在提高医学成像对比度方面发挥着重要作用。
Lawaczeck 等人[8]指出,小尺寸和超小尺寸超顺磁性氧化铁纳米颗粒(SPION 和 USPION)是用于MRI对比度增强的首选材料。SPIONs通常为单晶结构,由磁铁矿(Fe3O4)或 maghemite(‐Fe2O4)组成。
Parkes 等人[9]提出,金(Au@Fe)、钴(Co)和铂(Pt@Fe)的饱和磁化强度远高于铁,对质子弛豫具有更强的延长效应(r1 7.4 mM−1s−1, r 88 mM−1 s−1,在1.5 T条件下,共聚物的核心直径为3.9 nm,颗粒直径为28 nm),相比同等浓度的氧化铁,可提供更优的对比效果,并允许使用更小的颗粒而不影响MRI的灵敏度。
Kim 等人[10]采用具有高磁化值的超顺磁性金属氧化物纳米颗粒来提高T2(阈值加权)图像的对比度。Zhou 等人[11]认为,MRI是一种有效的临床成像技术,可用于病变软组织的功能成像以及实体瘤的成像。Li 等人[12]构建了均匀、单分散且具有核壳结构的纳米球,其由介孔二氧化硅包覆的单个上转换发光/磁性纳米颗粒组成。该纳米球可用于MRI双模成像及抗癌药物递送。
Rosa 等人[13]探讨了分子成像和纳米磁共振成像(nano‐MRI)技术中存在的问题。文中指出,通过细胞和分子可视化实现生物过程监测和生物化学的早期识别是分子成像(MI)的两大应用。在MI时代之后,医学诊断极大地依赖于成像技术的发展,例如能够体内可视化组织结构以及被称为功能磁共振成像(fMRI)的大脑活动的MRI技术。尽管这一功能足以成像组织结构,却难以直接可视化需要纳米尺度分辨率的分子。近年来,纳米磁共振成像能够前瞻性地观察到分子成像无法企及的结构[14]。因此,作者得出结论:纳米磁共振成像技术的灵敏度远高于传统MRI技术。这正是纳米磁共振成像正在兴起的领域,它结合多种技术手段,助力分子生物学实现单分子分辨率。
4 纳米颗粒作为放射增敏剂和放射防护剂用于放射治疗
任何成像方式中对癌细胞的准确检测都将为癌症患者带来成功的治疗。放射治疗在诊断癌症中起着重要作用。成功放射治疗的目标是提高癌细胞的敏感性,同时尽量降低正常细胞的敏感性。这可能得以实现通过增强剂量的定位,或对健康细胞使用放射防护剂和/或对癌细胞使用放射增敏剂来实现。放射防护剂旨在最小化辐射过程中对健康组织的损伤,而放射增敏剂则用于提高癌细胞在辐射过程中的灵敏度。目前已有若干传统化学试剂被用作放射防护剂和放射增敏剂,例如阿米福汀、碳合氧、烟酰胺和桦木酸。尽管这些试剂已潜在地用于有效治疗,但在尺寸、生物相容性和化学修饰方面仍存在一些局限性。
近年来,由于纳米技术的发展以及纳米颗粒的优异特性,新型纳米颗粒已被用作放射防护剂和放射增敏剂。Chandra 等人[15]描述了合成金纳米颗粒(AuNPs)的方法,并介绍了这些颗粒在利用电化学检测方法检测各种疾病中的应用。在[16],中,他们采用水热反应法合成了超顺磁性锌铁氧体尖晶石(ZnFe2O4)纳米颗粒。所合成的材料随后被用作癌症治疗中的放射增敏剂。该研究结果表明,这些ZnFe2O4纳米颗粒提高了放疗效果,并且在放疗后可通过外部磁场轻松地从细胞环境中分离出来。Werner 等人[17]证明Genexol‐PM作为放射增敏剂优于紫杉醇,在临床应用方面具有巨大潜力。
Popov 等人[18]指出,给予CeO2纳米颗粒可延长小鼠在X射线辐射下的耐受时间。Feliciano 等人[19]构建了与氮氧自由基结合的纳米颗粒(氧化还原纳米颗粒,RNPN),能有效清除辐射诱导的活性氧(ROS),其效果优于传统的低分子量(LMW)抗氧化剂。所有这些放射防护剂和放射增敏剂均显示出在成功治疗中的潜力。不同生物医学应用中各种纳米颗粒的性能如表1所示。
5 结论
在当前情况下,先进纳米材料在医学成像中发挥着至关重要的作用,例如作为诊断中的增敏剂、靶向药物递送和基因递送。纳米材料的使用不仅限于生物医学领域的这些问题,还可能扩展到健康与安全、环境和工业应用以及社会影响等多个研究领域。这证明了由于纳米技术具有更小尺寸、更高的储能能力、降低的功耗等优异性能,未来几乎所有技术都将归属于纳米技术。总而言之,各种纳米颗粒已得到高效开发,且仍有更多纳米颗粒有待开发,它们在医疗应用的所有治疗中都具有巨大潜力。
| S. No. | Author | Year | Used nanoparticles | Agent | Application | Remarks |
|---|---|---|---|---|---|---|
| 1 | Katas et al.[7] | 2017 | Chitosan–graphene oxide(CSGO) nanocomposite | As therapeutic agent | Colon cancer | CSGO-DsiRNA nanocomposites with pectin coating particularly destroy the cancer cells. It is a promising therapeutic agent for cancer treatment |
| 2 | Popov et al.[18] | 2016 | CeO2 nanoparticles(200 nM) | As therapeutic agent | Mice tumor | Cerium oxide nanoparticles reduce the toxicity |
| 3 | Brann et al.[6] | 2016 | Oligonucleotide-coated gold nanoplate with doxorubicin loading | As chemotherapeutic agents | Cancerous tissue detection | Nontoxic to cells. |
| 4 | Meidanchi et al.[16] | 2015 | Synthesized a superparamagnetic zinc ferrite spinel(ZnFe2O4) nanoparticles | As radiosensitizing agent | Cancer therapy | This will increase the effectiveness of the radiotherapy treatment |
| 5 | Li et al.[12] | 2013 | Uniform, monodisperse, and core–shell structured nanospheres composed of mesoporous silica-coated individual upconversion luminescence/magnetic nanoparticle | As contrast agent and drug delivery agent | MRI dual modal imaging and for anticancer drug delivery | Magnetic nanoparticle having high magnetization value |
| 6 | Werner et al.[17] | 2013 | Genexol-PM | As radiosensitizing agent | Cancer therapy | Genexol-PM provides better results when compared to others |
| 7 | Kim et al.[10] | 2011 | Super-paramagnetic metal oxide nanoparticles | As contrast agent | MRI image enhancement | Super-paramagnetic metal oxide nanoparticles have high magnetization values for improving the contrast of T2 images |
| 8 | Parkes et al.[9] | 2008 | Cobalt(Co), gold(Au@Fe), and platinum(Pt@Fe) nanoparticle | As contrast agent | MRI image enhancement | Gold(Au@Fe), cobalt(Co), and platinum(Pt@Fe) have much greater saturation magnetization value than the iron |





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








