通过集成增材制造和电液动力学进行生物制造
4.1 引言
由于人们对旨在再生人体组织和器官的新型生物医学策略的兴趣日益增长,过去30年来,关于可生物降解植入物多孔结构定制的材料加工技术的研究显著增加。从最初致力于通过不同技术(如纤维粘合、冷冻干燥和溶剂浇铸[1])开发具有高度多孔结构的组织工程支架的开创性工作开始,大量研究报道了利用多种可生物降解聚合物和复合材料加工出具有不同结构和功能特征的组织工程支架的新技术,以构建如扁平组织(例如皮肤)、复杂实体器官和组织(例如肝脏和骨骼)以及管状结构(例如尿道和血管)等组织[2–4]。各种支架及制造工艺的要求推动了制造技术的研发,包括具备尺寸适合组织再生和血管化的高度相互连通的孔隙网络的合适支架多孔结构、不损害材料生物相容性和理化性质的加工条件、支架结构的高可重复性、支架解剖形状、影响细胞行为的支架微/纳米结构特征以及植入物生物活性行为。过去十年来的前沿进展主要集中在应用增材制造(AM)技术,以提高支架制造过程在不同尺度水平上的可重复性、自动化程度和设计自由度。电液动力学(EFD)技术,包括静电纺丝(ES)、电动力喷雾或电动力雾化,已广泛用于通过对粘弹性聚合物溶液施加高压电场力来制备微/纳米结构颗粒或纤维的二维(2D)或三维(3D)组装体[5]。这两种研究趋势常常重叠,并最终在特定集成水平上融合为不同制造技术的结合,这将在后文详细讨论。
本章旨在提供有关增材制造(AM)与电液动力学方法结合的最新文献综述,以提供一种通用的方法来开发定制化支架,并对复杂的微米、纳米或多尺度结构元件的组装进行精确且便捷的控制,从而模拟细胞在天然细胞外基质(ECM)中所经历的环境。
4.2 增材制造在生物医学科学中的应用
根据美国材料与试验协会(ASTM)的定义,增材制造(AM)是指“通过将材料逐层累积的方式,依据三维模型数据制造物体的过程,与减材制造方法相反”[6]。在ASTM提出标准术语之前,诸如三维打印、增材制造、增材工艺、增材技术、增材分层制造、分层制造、快速成型和实体自由成形制造等术语被混用以指代增材制造。ASTM和国际标准化组织正在持续制定增材制造相关的国际标准子集,以明确统一术语,评估材料和生产过程的性能,确保最终产品的质量,并规定设备校准的程序[7]。增材制造技术涉及一种计算机控制的分层制造过程,基于能量和/或材料的顺序施加,将多种材料(如金属、聚合物、陶瓷和复合材料)加工成几何形状和尺寸与数字模型相似的最终产品。物体的三维计算机实体模型被转换为包含其表面几何信息的标准三角网格语言(STL)文件,然后表示为一系列具有预定义厚度的横截面层,生成切片文件,再以数字方式载入驱动制造部件运动的机器中。该制造过程从底部开始逐层构建,每一新形成的层均粘附于前一层之上。
增材制造被视为一种具有巨大潜力的新兴技术,将对全球消费市场以及航空航天和医疗器械行业等专业工业领域产生重大影响。增材制造在医疗保健行业的应用已推动了手术器械、医疗器械、假体和植入物的发展。此外,人们已投入大量努力将增材制造技术应用于组织工程,以开发针对不同应用定制的先进聚合物支架[8,9]。采用不同的增材制造技术,如立体光刻(SLA)和熔融沉积成型(FDM),能够在不同尺寸尺度(从宏观到微米尺度)上精确控制组织工程支架结构的外部形状和多孔结构[9]。先进的计算机辅助设计与制造方法使得临床尺寸、解剖形状支架的制备实现了高度自动化、良好精度和可重复性,其多孔结构具有完全互连的孔隙网络,并具备定制的尺寸和形状。生物医学聚合物增材制造的进步正显著影响组织工程的临床方法,以及支架制造所用材料科学与技术工具,有望彻底改变人体组织功能衰竭治疗方式。通过熔融沉积成型制备的定制化聚合物支架在颅面外科和牙科应用中的人体植入后已取得成功效果[10]对生物医学立体光刻的进一步研究
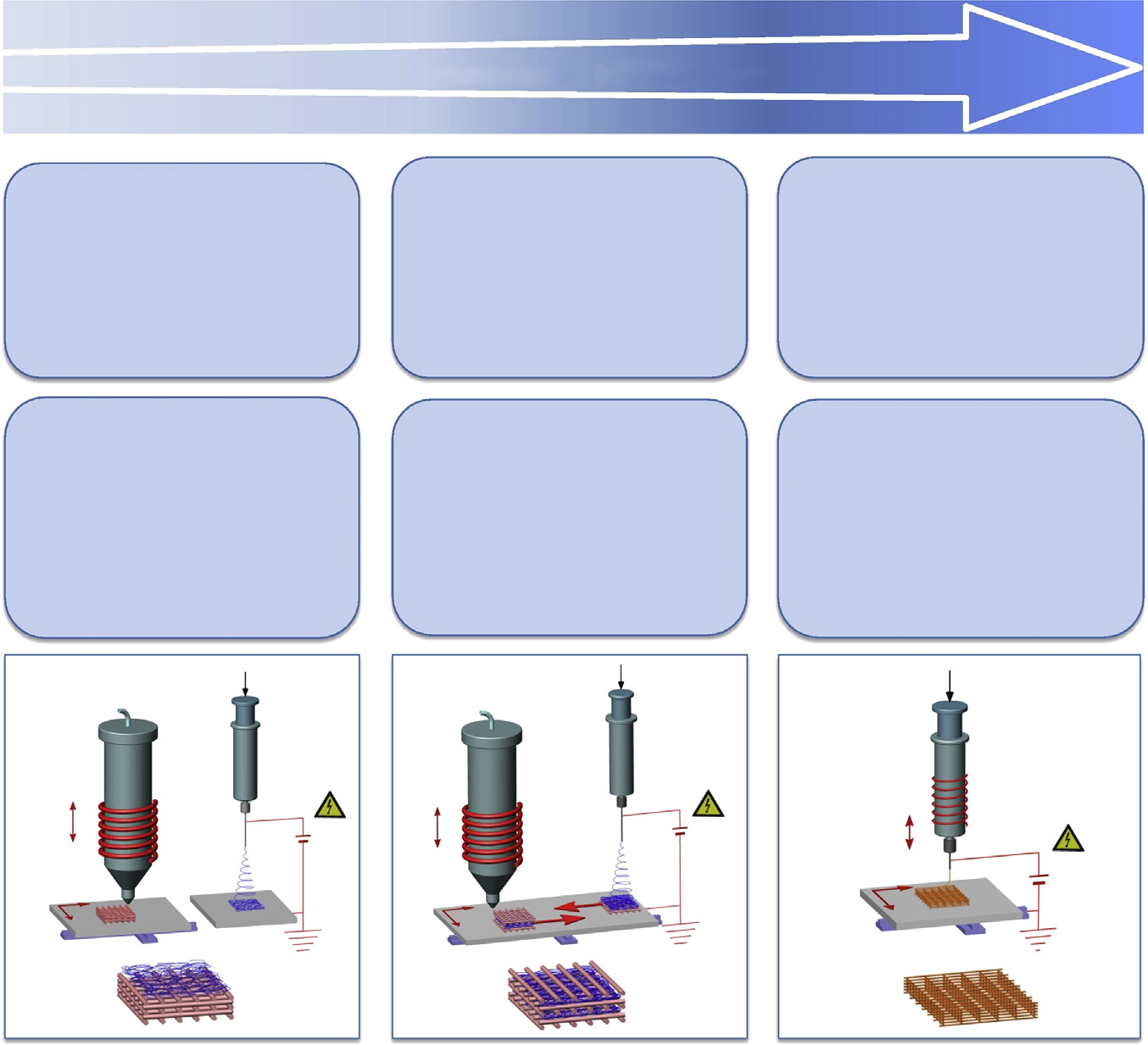
4.3 生物制造
生物制造(BF)是一个不断发展的研究领域,在组织工程和再生医学领域受到了广泛关注。根据其最新的重新定义[16], ,BF旨在利用自动化过程(通常基于增材制造技术),开发细胞‐生物材料构建体,这些构建体通过其内部和外部的空间排列,可成熟为功能性组织类似物。为了构建具有仿生分层结构的组织工程构建物,可采用两种不同的策略,即生物打印和生物组装。生物打印基于对单个细胞、生物活性分子、聚合物和/或细胞聚集体的加工,以制造组织工程构建物,其被定义为“利用计算机辅助转移工艺,将活体与非活体材料按照预定的二维或三维结构进行图案化和组装,从而生成用于再生医学、药代动力学和基础细胞生物学研究的生物工程结构”[17]。已采用多种策略,包括基于激光、液滴和挤出的生物材料(如细胞、生长因子和水凝胶)打印,以优化构建体的分辨率、机械强度以及打印后细胞的活力和功能性[18]。生物组装可被定义为“通过自动装配由细胞驱动自组织形成的预先形成的含细胞制造单元,或通过制备杂化细胞‐材料构建模块,来制造具有预定二维或三维结构的分层构建体”[16]。生物组装涵盖多种方法,这些方法通过增材制造或其他制造技术(如纺织制造和细胞片技术),将构建模块(例如细胞聚集体、细胞纤维、细胞片、类器官和微组织)组装成功能性的组织工程构建物[19]。
正如该领域权威专家最近指出的那样[16],支架的增材制造若具备可诱导或调节细胞响应的结构特征,在细胞接种后或植入后,若后续成熟过程能够产生生物功能性构建体,则符合生物打印策略。在此背景下,增材制造与其他支架制造方法(例如静电纺丝)在不同集成水平上的结合,形成具有互补结构特征和增强的生物刺激的混合结构,可被视为完全符合这一概念。同样,增材制造与电液动力技术在技术层面的集成,用于制造具有细胞指导性拓扑纳米特征的二维或三维图案化聚合物结构,也属于生物打印的范畴。
4.4 集成增材制造和电液动力学
正如以下章节详细讨论的那样,已开发出不同的技术方案来集成增材制造与电液动力技术,这些方案要么为大孔支架赋予纳米级特征,要么将纳米结构(即纳米纤维或纳米颗粒)图案化到三维层状多孔结构中。
4.4.1 多尺度结构
结合不同的制造技术可能是一种多功能的方法,用于开发具有复杂多尺度结构要素组装的定制化分级支架,更好地模拟细胞在天然ECM中所经历的环境[20]。
通过AM制备的支架通常由大孔互连网络组成,其孔径可调,以优化组织再生和整合过程,通常在数百微米范围内,结构单元(例如杆状结构和纤维)的尺寸在数十至数百微米范围内。尽管已有大量研究表明,此类多孔结构能很好地支持体外细胞粘附、增殖以及在整个支架中的渗透,但细胞与微米级结构结合时通常会变平并铺展,如同在平坦表面培养一样[21]。天然ECM的纳米尺度结构由自组装纳米纤维构成的动态纤维网组成,强烈影响细胞形态变化,进而影响细胞分化及其他活动[22,23]。许多文献报道了生物材料的纳米微米形貌特征(如孔隙、脊、沟槽、纤维和节点)对细胞黏附、形态、增殖、内吞活性、运动性及基因表达的影响,强调在三维纳米纤维基质环境中,细胞能够维持其表型形态并建立自然的行为模式[21,24,25]。此外,考虑到通过AM制备的聚合物结构中的大孔由于尺寸较大,难以被生长的组织定植和填充,因此许多研究致力于设计不仅在宏观层面匹配待再生组织特性,而且在纳米/微观层面创造局部细胞环境以模拟真实器官中环境的支架[14,26]。此外,尽管与其他纳米纤维制备技术相比,ES具有设计纳米纤维组装结构和组成的简单性和多功能性等固有优势,但其在某些生物医学应用中的应用可能受到限制,因为难以控制支架的外部形状,通常仅限于小厚度的简单几何形状(通常不超过几毫米),且纤维间孔径较小,通常处于亚微米范围,不利于深层细胞渗透[27]。因此,将AM与ES相结合是一种有效手段,可克服上述两种技术的缺点,并通过赋予三维支架预定义形状和大孔互连网络的同时引入纳米尺度结构,重现天然组织中存在的分层有序结构,该纳米尺度结构具有更大的蛋白质吸附表面积,并提供更多细胞膜受体的结合位点,[21]。大量研究表明,该方法结合了AM制备的微结构支架的三维形状和机械稳定性与静电纺丝纳米结构增强的材料/细胞相互作用(图4.2)。
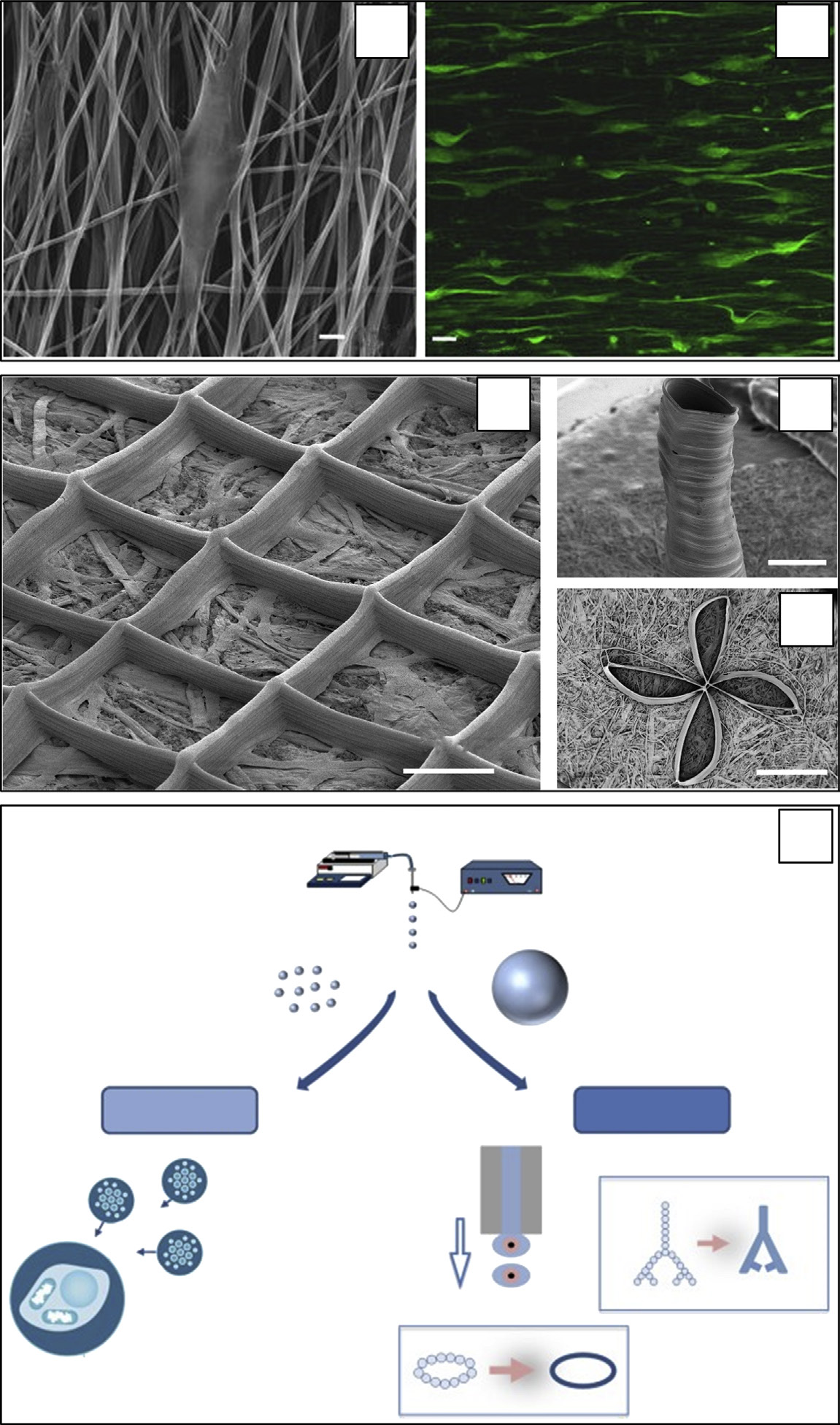
Tuzlakoglu等人[28]首次通过两步制备方法开发出双尺度纤维支架,该方法结合了随机取向的基于淀粉的纳米和微米纤维,首先进行微米纤维结合,然后进行纳米纤维静电纺丝。研究表明,纳米纤维结构影响了人成骨样细胞和大鼠骨髓基质细胞的形态、细胞骨架组织、活力以及碱性磷酸酶的产生。由聚(ε‐己内酯)PCL微纤维和纳米纤维组成的双层结构,均通过静电纺丝制备,成功用于证明纳米结构的存在增强了大鼠骨髓基质细胞的铺展[29]。在这些开创性研究之后,2008年多篇文献报道了涉及通过基于熔融挤出的增材制造交替沉积微丝层和通过静电纺丝沉积纳米纤维层的连续制造工艺的发展。Park等人[30]报道了由交替排列的PCL微丝和PCL/胶原蛋白纳米纤维组成的双尺度支架的制备(图4.2(a)和(b))。另一篇文章报道了一种类似的分层支架结构,由PCL微丝和PCL纳米纤维组成[31]。Moroni等人[32]的一项研究表明,这种混合制造方法适用于开发多尺度支架,整合了由聚[对苯二甲酸乙二醇酯‐co‐对苯二甲酸丁二醇酯]共聚物制成的微丝和纳米纤维。这三项研究均表明,纳米纤维结构显著影响了软骨细胞的体外黏附、增殖和形态。随后,相同的混合制造方法被应用于开发新型分级支架,通过淀粉/PCL共混微结构层与PCL纳米纤维层的组合获得(图4.2(c)和(d))[33]。本研究中进行的体外生物表征显示,除了促进人成骨样细胞的增殖和活性外,纳米纤维图案还增强了细胞在支架内部的滞留。另一项关于双尺度纤维支架的研究,采用熔融挤出增材制造制备有序PCL微纤维结构,并在其上静电纺丝聚(乳酸‐co‐羟基乙酸)网状结构,明显显示出静电纺丝纤维对小鼠前成骨细胞形态和行为的影响,同时在微丝间隙中形成了结构桥接以促进细胞定植(图4.2(e)和(f))[34]。在随后的几年中,越来越多的文章报道了这类多尺度结构支架的发展,采用了不同的微米和纳米结构元件组合,例如PCL微丝与PCL/小肠黏膜下层或PCL/丝素蛋白静电纺丝纤维的集成[35],微米级胶原蛋白丝与纳米级胶原纤维[36],明胶/海藻酸钠微丝与静电纺PCL[37]。
通过对由增材制造制备的PCL微丝与纳米纤维胶原层交替组成的混合支架进行压缩性能表征,李等人[38]首次证明了纳米纤维结构组分能够增强支架的机械性能。随后发现,由微梁胶原层和静电纺PCL/β‐磷酸三钙(TCP)纳米纤维组成的分级支架的拉伸模量比纯胶原蛋白高出七倍

支架[39]。多尺度结构方法还被提出以赋予三维支架药物释放特性。例如,采用熔融挤出增材制造制备的PCL微丝结构与由负载罗丹明B的核壳聚环氧乙烷纤维制成的电纺亲水网格交替排列,并夹在两层电纺PCL网格之间[40]。通过改变聚己内酯疏水层的厚度,可调节罗丹明释放动力学和初始突释效应。另一篇文章报道了通过增材制造制备的三维磷酸三钙/藻酸支架,并通过负载两种不同抗菌剂(即银纳米颗粒和水杨酸)的电纺网格涂层赋予其抗菌性能[41]。最近,开发了由聚己内酯微丝层与静电纺PCL及负载类成骨细胞的海藻酸盐支柱交替组成的分级支架,以实现支架横截面上均匀的细胞增殖[42]。Centola等人研究了一种获得用于血管组织工程的解剖型支架形状的替代方法[43]他们在外层采用熔融沉积成型技术在管状聚l‐乳酸(PLLA)支架上添加单圈聚己内酯,以改善其机械性能。
4.4.2 图案化纳米结构
增材制造与电液动力技术在技术水平上的结合因其能够融合图案化结构与纳米结构架构的优势而备受关注。电液动力学系统因其简单性、成本效益以及制造参数与形貌特征之间关系的多样性而广受欢迎[44]。迄今为止,静电纺丝是最常用的超细聚合物纤维制备技术,可获得直径从微米到纳米尺度的纤维[14]。
电纺纤维网格具有极高的比表面积,为细胞膜受体提供了大量结合位点,有利于细胞粘附和迁移。因此,其已被广泛应用于多种组织工程领域,如血管[45,46], 、骨骼[47–49], 、软骨[50,51], 、神经[52–54], 、肌肉[55,56], 、心肌[57,58],和皮肤[59–61]。此外,静电纺丝在材料选择、加工条件和载药方法(如直接共混、物理吸附和同轴静电纺丝)方面的灵活性已被用于开发多种负载不同生物活性因子的超细纤维系统,例如抗生素[62], 、抗炎剂[63], 、生长因子[64],和细胞分化剂[65]。然而,正如前文所述,通常发现较小的孔径和较高的纤维堆积密度会阻碍细胞在电纺支架中的渗透及其均匀定植[66–68]。将增材制造原理应用于溶液与熔体静电纺丝技术已被研究作为增大网格孔径以及更好地控制网格外形的方法。由此产生的由取向纤维组成的高度有序结构已被证明可为细胞提供纳米结构引导信号。例如,最近研究表明,完全取向的电纺 PCL/明胶共混纤维的形貌特征能够有效促进人源间充质干细胞(hMSCs)和 PC‐12 嗜铬细胞瘤神经细胞形成神经突并促进其延伸(图4.3(a)和(b))[69]。
该方法结合其他可能性通过将细胞悬浮液直接电纺丝至聚合物壳层射流的核心中[70],可为开发具有结构和生物学固有刺激的先进纳米纤维支架提供有力工具。将静电纺丝与增材制造的逐层堆叠原理完全结合,将加速其向可行的微/纳米级3D打印策略的转化[71]。通过采用包含相对较粗加工喷嘴、高精度注射泵、以相对较高速度(数百毫米/秒)移动的导电平台以及短工作距离(<10毫米)的电液动力学打印(EFDP)系统,已实现对高分辨率聚合物纳米图案的增强控制。[72]该方法使黄等人[73]能够直写分辨率为200纳米的二维聚环氧乙烷(PEO)纤维组装体。
通过优化工艺条件(如绘图速度、进料速率和接收距离),近期开发出纤维直径约为2 μ微米、并能良好支持细胞增殖的三维PLLA超细纤维支架[74]。利用类似的近场静电纺丝方法,直接书写了不同类型的三维聚偏氟乙烯纤维结构,例如网格、墙状结构、中空圆柱体以及其他三维标志(图4.3(c)–(e))[75]。其他关于EFDP技术的研究已产生一系列纳米结构材料,例如由PEO纳米纤维组成的自支撑墙[76]。已开发出多种EFDP技术变体,以提高三维图案化超细纤维垫的分辨率和/或厚度。例如,使用尖针接地电极和圆柱侧壁电极,可制造由30层随机取向纳米纤维微丝组成的图案化垫[77]。EFDP还被用于载有盐酸四环素(选为抗生素模型)的聚乙烯吡咯烷酮/PEO共混纳米纤维的二维图案化[78]。
目前正在进行研究,探索颗粒形成型电液动力系统在含细胞构建物微加工中的应用,策略包括控制包封细胞的水凝胶颗粒的沉积,或将细胞接种到组装颗粒表面(图4.3(f))[5]。
4.5 结论与未来展望
将增材制造引入生物医学领域,推动了创新方法的发展,用于制造高度复杂且功能化的聚合物构建物,符合组织工程构建物开发中的BF方法。电液动力学系统由于能够以微米/纳米尺度分辨率制备聚合物纤维和颗粒,在生物医学领域受到日益关注。在不同集成水平上结合增材制造与电液动力技术的广泛兴趣,源于将这两种制造方法的优势相结合的可能性,从而开发出具有定制形状和多孔结构并具备纳米/微米级特征的三维分层结构。
通过在制造层面结合增材制造和静电纺丝技术,已针对组织工程应用优化了集成不同尺寸尺度结构单元的先进三维聚合物结构。所得到的多尺度支架除了提供增强的生物学性能(包括提高细胞滞留和结构内部区域的定植)外,还可作为一种强大工具,用于根据孔隙率以及结构单元的尺度来定制其他关键支架特性(例如生物降解速率、机械性能以及负载生物活性剂的释放动力学)。例如,考虑到结构要素尺度对与药物释放相关的传质现象的影响,该方法为开发提供结构和治疗刺激的生物活性支架开辟了新的可能性,其中后者可通过多种生物分子组合的时空可控递送实现。
在技术层面,通过将增材制造原理应用于电液动力学系统,实现了三维纳米结构支架的构建,其表面积最大化,并且外部形状和孔径经过优化以适应组织生长过程。基于大量关于静电纺丝随机取向纳米纤维支架的研究,生物制造策略已集中于新型技术工具的开发,以逐层方式组装具有定向排列的聚合物纳米纤维。当前前沿研究致力于以可控方式应用该方法制备用户特异性纳米/微粒图案。未来的发展方向可能包括高效制造临床尺寸、解剖形状的纳米图案化支架的研究,以及将增材制造方法应用于细胞静电纺丝和基于电液动力学颗粒的细胞封装,从而直接制造适用于组织再生和体外组织模型的复杂三维功能性活体结构。




















 45
45

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








