Healthcare 2015, 3, 296–309;doi:10.3390/healthcare3020296
综述
2型糖尿病患者补充辅酶Q10
沈秋华 * 和 珍妮特·D·皮尔斯
* 通讯作者,电子邮件:qshen@kumc.edu;电话:+1‐913‐588‐1855;传真:+1‐913‐588‐1660。
学术编辑:萨米尔·萨曼和伊恩·达顿‐希尔
收到日期:2015年3月3日 / 接受日期:2015年5月14日 / 发表日期:2015年5月21日
摘要
2型糖尿病(T2DM)是美国及全球范围内发病率和死亡率不断上升的主要原因。越来越多的证据表明,由氧化应激引起的线粒体功能障碍在2型糖尿病的发病机制中起着关键作用。辅酶Q10是一种重要的微量营养素,作用于线粒体的电子传递链,具有两个主要功能:(1)合成三磷酸腺苷(ATP);(2)作为强效抗氧化剂。辅酶Q10缺乏在2型糖尿病患者中较为常见。目前尚不清楚补充辅酶Q10是否有助于减轻氧化应激、保护线粒体功能,从而改善2型糖尿病患者的血糖控制。本文综述了氧化应激、线粒体功能障碍与2型糖尿病之间的关系,并探讨了将辅酶Q10作为2型糖尿病治疗补充剂的潜在证据。
关键词 :2型糖尿病;辅酶Q10;线粒体功能障碍;氧化应激;抗氧化剂;三磷酸腺苷
1. 引言
糖尿病是影响美国人口超过2910万(即9%以上)的主要公共卫生问题,其中90%–95%的病例为2型糖尿病[1]。2010年,糖尿病是美国第七大死因。在美国糖尿病患者中,有27.8%(即810万人)未被诊断。根据国际糖尿病联合会糖尿病地图集,全球有3.87亿人患有糖尿病,预计到2035年这一数字将增加至5.92亿。2型糖尿病患者因失控的高血糖而面临发生严重大血管和微血管并发症的高风险,这些并发症包括心脏病、中风、高血压、视网膜病变、肾病和神经病变。2012年,美国糖尿病的总成本估计为2450亿美元,其中直接医疗成本为1760亿美元,与残疾、工作能力丧失和过早死亡相关的间接成本为690亿美元[1]。目前针对2型糖尿病管理的临床指南包括健康饮食、体重控制、增加体力活动、降糖药物以及多因素风险降低[3]。
2型糖尿病(T2DM)是一种复杂且慢性的疾病,由于胰岛素刺激的葡萄糖摄取减弱,在胰岛素水平正常的情况下,机体无法对升高的葡萄糖水平作出适当反应(即胰岛素抵抗),和/或胰腺β细胞的胰岛素分泌受损[3]。T2DM的病理生理学机制复杂,涉及多种因素。胰岛素抵抗是T2DM发生发展的基本机制。胰岛素由胰腺β细胞分泌,在多种代谢过程中发挥重要作用,包括葡萄糖摄取调节、促进离子跨膜转运以支持蛋白质合成,以及调控基因转录和细胞增殖[4]。
胰岛素信号通路涉及多个复杂分子之间的相互作用,这些过程易受各种干扰因素影响,包括遗传异常、胎儿营养不良、内脏肥胖导致的游离脂肪酸升高以及身体活动不足。当胰岛素作用受损时,若胰腺β细胞功能尚充足,则会引发代偿性胰岛素分泌增加,导致高胰岛素血症。相应地,高胰岛素血症参与了代谢综合征的发病机制,而代谢综合征与T2DM密切相关。当胰腺β细胞无法应对胰岛素抵抗时,胰岛素分泌受损,葡萄糖摄取受到影响。持续性高血糖会诱导线粒体内电子传递链产生过量的活性氧(ROS)。尽管ROS是线粒体氧化磷酸化的副产物,但当内源性抗氧化剂的防御机制下降时,ROS过度生成可引起氧化应激,导致脱氧核糖核酸(DNA)、蛋白质和脂质的氧化损伤。特别是线粒体由于靠近ROS产生部位,容易受到氧化应激的影响,从而引发线粒体功能异常或线粒体功能障碍。越来越多的证据表明,继发于氧化应激的线粒体功能障碍参与了2型糖尿病的发病机制及其相关并发症的发生[5]。
辅酶Q10(CoQ10)是一种内源性合成的脂溶性微量营养素,存在于体内大多数活细胞中。它是线粒体电子传递链中的关键组分,作为电子载体,在三磷酸腺苷(ATP)合成过程中将电子从烟酰胺腺嘌呤二核苷酸(NADH)、琥珀酸和甘油‐3‐磷酸通过复合物I和II传递至复合物III。此外,辅酶Q10是一种强效抗氧化剂,可清除自由基,保护细胞免受氧化损伤。研究发现,2型糖尿病患者通常存在辅酶Q10缺乏,其血浆CoQ10水平显著低于正常健康个体[6–8]。由于其抗氧化特性,辅酶Q10缺乏可能损害机体对2型糖尿病中高血糖诱导的氧化应激的防御机制[9,10]。有研究表明,外源性补充CoQ10可能减轻由氧化应激引起的线粒体功能障碍,从而改善2型糖尿病患者的血糖控制[11]。
2. 线粒体功能与辅酶Q10
2.1. 线粒体功能
线粒体是存在于机体每个细胞中的重要细胞器,在细胞生存和增殖所必需的能量代谢中发挥重要作用。通常,线粒体被称为“细胞的动力工厂”[5]。这是因为细胞能量的主要来源ATP大部分是在线粒体中通过氧化磷酸化产生的。关键的线粒体功能发生于内膜上的电子传递链,该内膜具有许多折叠结构形成嵴,显著增加了内膜的表面积,从而增强了细胞呼吸的效率。
电子传递链由五个复合物组成,包括复合物I、II、III、IV和V。复合物I,也称为泛醌NADH脱氢酶,负责NADH的氧化,并将电子传递给泛醌(辅酶Q10的氧化形式)。复合物II,即琥珀酸脱氢酶,将琥珀酸氧化为苹果酸,并将电子传递给泛醌。在复合物I和II处,泛醌接受电子并被还原为泛醇,后者携带电子至复合物III(泛醇‐细胞色素c还原酶)。在此过程中产生两个质子。复合物IV,即细胞色素c氧化酶,负责将电子从细胞色素c传递给氧气,生成水并再产生两个质子。当质子被泵出基质进入膜间隙时,形成电化学梯度。在复合物V(ATP合酶)处,由质子梯度建立的跨膜电位被用于促进ADP磷酸化合成ATP[12]。
2.2. 活性氧
活性氧(ROS)是含有氧气和未成对电子的高度反应性分子。在正常情况下,活性氧是线粒体中氧化磷酸化的自然副产物。超氧化物和羟自由基是活性氧的例子。在电子传递过程中,当电子被添加到氧气时会产生超氧化物。它可以通过超氧化物歧化酶转化为过氧化氢。过氧化氢可进一步还原为羟自由基[12]。由于其高度反应性,活性氧可对脱氧核糖核酸、脂质和蛋白质造成氧化损伤。体内存在抗氧化剂等内源性防御机制,以抵消氧化磷酸化过程中自然产生的活性氧。然而,当在各种病理生理疾病过程中活性氧过度产生和/或抗氧化防御机制显著受损时,就会发生氧化应激。已知氧化应激会增加线粒体DNA突变的速率,导致线粒体功能障碍[13]。
2.3. 辅酶Q10
辅酶Q10是一种在体内内源性合成的脂溶性微量营养素。它是线粒体中电子传递链的关键组成部分。辅酶Q10的两个主要功能是:(1)促进三磷酸腺苷的合成;以及(2)作为强效抗氧化剂。在其第一项功能中,辅酶Q10通过在复合物I、II和III之间沿电子传递链传递电子,促进氧化磷酸化过程。在第二项功能中,辅酶Q10是最活跃的活性氧清除剂之一,可保护线粒体膜蛋白、脂质和脱氧核糖核酸免受氧化损伤。辅酶Q10有两种形式:泛醌是辅酶Q10的完全氧化状态,泛醇是辅酶Q10的完全还原形式。泛醇是辅酶Q10的活性形式,作为一种强效抗氧化剂,因其电子结合较松,可轻易释放一个或两个电子以中和活性氧。辅酶Q10还可帮助再生其他抗氧化剂,例如维生素E[14]。
近期研究发现了辅酶Q10在线粒体中的其他作用。例如,辅酶Q10不仅有助于三磷酸腺苷生成过程中的电子传递,还参与稳定线粒体通透性转换孔,并对抗细胞凋亡和自噬[15]。Yubero‐Serrano等人的一项研究[16]报告称,在地中海饮食中补充辅酶Q10可有效调节与内质网应激相关的基因表达。此外,辅酶Q10的合成与线粒体融合蛋白‐2密切相关,后者是一种参与线粒体融合的关键线粒体膜蛋白[17]。Noh等人的一项研究[18]指出,辅酶Q10通过维持线粒体嵴结构,增加线粒体的数量和体积密度,从而保护线粒体质量。
2.4. 线粒体在胰腺β细胞中的作用
维持血糖水平稳定和胰岛素分泌对于保持最佳血糖水平至关重要。这在很大程度上依赖于线粒体在β细胞中通过葡萄糖代谢产生的三磷酸腺苷(ATP)。简而言之,β细胞的胰岛素分泌包括以下步骤[5]。首先,葡萄糖通过葡萄糖转运蛋白‐1被转运至β细胞内,并通过糖酵解转化为丙酮酸。其次,丙酮酸进入线粒体,并通过三羧酸循环分解。当电子通过电子传递链传递并形成质子梯度时,生成三磷酸腺苷(ATP)。第三,随着ATP生成增多,ATP/ADP比值升高,导致ATP敏感型K+通道关闭以及电压敏感型Ca2+通道去极化。第四,Ca2+内流触发胰岛素分泌囊泡的胞吐作用[5]。
3. 线粒体功能障碍、氧化应激与糖尿病
线粒体功能障碍被发现与肥胖和2型糖尿病密切相关。在肥胖状态下,由于游离脂肪酸水平升高,导致大量营养底物进入线粒体。这会显著增加活性氧的产生以及细胞内脂肪积聚。这两者均可通过损害脂肪氧化能力而导致线粒体功能障碍,干扰胰岛素信号通路,从而加重胰岛素抵抗状态[19,20]。这最终促进了2型糖尿病的发病机制。另一个导致2型糖尿病中氧化应激和线粒体功能障碍增加的主要原因是高血糖。与高血糖诱导的氧化应激相关的四个关键机制包括:多元醇通路激活导致烟酰胺腺嘌呤二核苷酸磷酸过度消耗、葡萄糖氧化、晚期糖基化终末产物形成,以及氧化磷酸化和内皮型一氧化氮合酶的解偶联[21]。
氧化磷酸化解偶联存在两个不利影响。首先,当复合物III处因NADH和甘油‐3‐磷酸增加而抑制电子传递时,三磷酸腺苷的生成将受到严重损害,导致生物能量学缺陷。第二,来自NADH和甘油‐3‐磷酸的电子增加,随后转移至氧气,导致大量超氧化物生成。
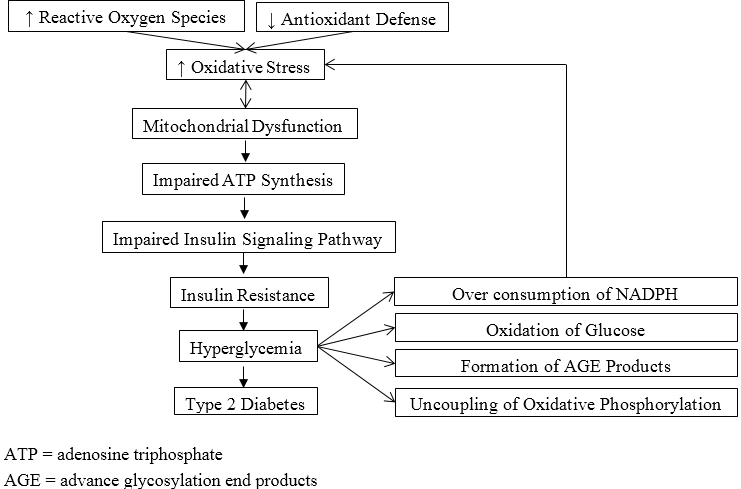 展示了氧化应激在2型糖尿病发病机制中的作用。线粒体功能障碍还在与内皮功能异常相关的糖尿病微血管和大血管并发症的发病机制中起作用。在氧化应激条件下,内皮细胞一氧化氮生成受损,导致平滑肌细胞松弛功能失效。线粒体功能改变伴随活性氧产生增加以及抗氧化剂过度消耗,被认为是T2DM并发症的重要因素,尤其是肾病[9]。这一观点得到了研究的支持,这些研究表明线粒体超氧化物和过氧化氢的生成增加与糖尿病肾病的发生和发展相关[22–24]。
展示了氧化应激在2型糖尿病发病机制中的作用。线粒体功能障碍还在与内皮功能异常相关的糖尿病微血管和大血管并发症的发病机制中起作用。在氧化应激条件下,内皮细胞一氧化氮生成受损,导致平滑肌细胞松弛功能失效。线粒体功能改变伴随活性氧产生增加以及抗氧化剂过度消耗,被认为是T2DM并发症的重要因素,尤其是肾病[9]。这一观点得到了研究的支持,这些研究表明线粒体超氧化物和过氧化氢的生成增加与糖尿病肾病的发生和发展相关[22–24]。
有令人信服的证据表明,由氧化应激引起的线粒体功能障碍在2型糖尿病的发病机制及其并发症中起着重要作用[25,26]。这促使人们越来越关注将辅酶Q10作为一种补充剂,结合抗氧化特性及抗糖尿病治疗用于2型糖尿病患者。
4. 2型糖尿病中的辅酶Q10缺乏
2型糖尿病患者中常观察到辅酶Q10缺乏,尤其是泛醇(辅酶Q10的还原形式)。泛醇/泛醌比值被用作检测氧化应激的指标[27]。泛醌(氧化形式)水平升高伴随泛醇(还原形式)水平降低,表明泛醌与泛醇之间的转化效率低下,以及对抗自由基的能力下降。研究发现,许多疾病中泛醌向泛醇的转化常常受损[28]。例如,Ates及其同事[6]发现,伴有视网膜病变的2型糖尿病患者的泛醇/泛醌比值明显低于正常健康受试者(分别为0.26 ± 0.16 vs. 1.41 ± 0.68)。相应地,血浆中丙二醛的水平(MDA)是脂质过氧化的标志物[29],在2型糖尿病患者中显著升高。泛醇/泛醌比值与血浆丙二醛水平之间存在显著负相关[6]。
El‐ghoroury 等人[7]报道了非常相似的结果,即2型糖尿病患者的辅酶Q10水平显著低于正常健康个体,而MDA水平则显著升高。此外,还发现辅酶Q10与糖化血红蛋白之间存在显著负相关。进一步研究显示,在2型糖尿病患者中,早餐后及全天的泛醌/泛醇比值均持续高于健康个体,提示餐后高血糖导致氧化应激增加[8]。当按空腹血糖状态分层时,泛醌/泛醇比值从正常糖耐量(NGT)、空腹血糖受损(IFG)到2型糖尿病呈现出逐步显著升高的趋势[26]。更具体而言,在NGT个体中,总辅酶Q10的90%为还原形式泛醇;而在2型糖尿病患者中这一比例仅为24%。
有研究提出,辅酶Q10在2型糖尿病的发病机制中发挥重要作用[30]。此外,Sourris 等人[9]首次提出,辅酶Q10缺乏(尤其是泛醌)是糖尿病肾病的一个诱发因素。该观点基于以下证据:易发生糖尿病肾病的db/db小鼠其肾皮质和线粒体中的泛醌水平显著降低。2型糖尿病中辅酶Q10的缺乏很可能是由于应对过度氧化应激所致的消耗。值得注意的是,上述所有临床研究均采用血浆辅酶Q10水平作为组织辅酶Q10的替代指标。尽管有必要建立血浆与组织辅酶Q10水平之间的关系,但在这些临床研究中获取组织样本困难是主要问题[31]。此外,许多研究并未明确讨论在从血浆样本提取辅酶Q10时防止泛醇氧化所采用的方法。因此,在解释这些结果时需谨慎对待。
5. 2型糖尿病中辅酶Q10的补充使用
线粒体FAD依赖性甘油‐3‐磷酸脱氢酶(G3PD)是位于线粒体内膜的限速酶,其在催化电子从甘油‐3‐磷酸转移至辅酶Q10的过程中发挥重要作用。G3PD的活性对β细胞功能具有生理影响。在2型糖尿病啮齿动物模型或来自2型糖尿病患者的尸体供体人胰岛中,G3PD的活性均受到损害[32–35]。有推测认为,线粒体内膜中辅酶Q10浓度的增加可能优化胰岛中受损的G3PD活性[36]。这一推测基于以下观察结果:对2型糖尿病患者补充外源性辅酶Q10后,琥珀酸脱氢酶的活性提高了超过31%[37]。线粒体琥珀酸脱氢酶也是一种位于线粒体内膜的黄素蛋白,可将电子传递给辅酶Q10。进一步推测认为,适量的辅酶Q10也可能有利于三羧酸循环的活性,因为该循环依赖于NADH脱氢酶和琥珀酸脱氢酶[36]。
表1总结了研究辅酶Q10补充剂对2型糖尿病患者血糖控制影响的各项研究。该领域最初在两项研究[38,39]中进行了探讨。志贺田等人[38]的研究显示,在39名糖尿病患者中,补充120 mg辅酶Q7使67%的患者的血糖水平降低了≥20%。根据韦尔巴赫[40]的研究,每日向15名糖尿病患者给予60 mg辅酶Q10可增加胰岛素合成和分泌,并改善血糖控制[39]。尽管有研究报道了辅酶Q10对血糖控制以及胰腺β细胞的胰岛素合成和分泌具有积极作用,但这些研究均未包含安慰剂对照组。
| 作者和年份 | 出版年份 | 研究设计和受试者 | 形式和剂量辅酶Q10 | 结果 |
|---|---|---|---|---|
| 重田等人 1966 [38] | 1966 | 39名糖尿病患者 | CoQ7 120毫克用于2–18周 | 血糖水平显著下降(≥20%)在67%的患者中 |
| 志村等人 1981 [39] | 1981 | 15名糖尿病患者 | 辅酶Q10 每日60 mg,持续12周 | 显著增加胰岛素合成和分泌。血糖控制得到改善 |
| 孔赫特等人 1996 [41] | 1996 | 大鼠胰岛 | 2、4和8微摩尔辅酶Q10 | 没有显著增加胰岛素的释放。当使用较高浓度(8 μM)时,观察到胰岛素分泌增加了25% |
| 埃里克森等人 1999[30] | 1999 | 双盲 安慰剂对照 研究 23 患者 T2DM | 辅酶Q10 100毫克,每日两次,持续6个月 | 无明显改善血糖和HbA1c水平 |
| 亨里克森等人 1999[42] | 1999 | 随机的, 双盲安慰剂对照研究 34名1型糖尿病患者 | 每日100毫克辅酶Q10用于12周 | 没有显著降低 HbA1c和血糖水平 |
| 辛格等人1999年 [43] | 1999 | 患者伴有高血压和冠状动脉疾病 | 辅酶Q10 60毫克每日两次,持续8周 | 血压显著下降。空腹及2小时血浆葡萄糖和胰岛素水平显著降低。其他抗氧化剂如维生素A、E和C以及β‐胡萝卜素有显著增加。氧化应激标志物(TBARS、丙二醛和共轭二烯浓度)也显著减少。 |
| Hodgson et al. 2002[44] | 2002 | 74名患者伴有无并发症的2型糖尿病和血脂异常 | 辅酶Q10 200毫克/天,持续12周 | HbA1c水平显著降低。空腹血糖和胰岛素无明显改善。氧化应激状态无明显变化(通过F2‐异前列腺素测定)。 |
| Lim等,2008年 [45] | 2008 | 80名2型糖尿病患者 | 辅酶Q10 200毫克/天,持续12周 | 血浆总辅酶Q10水平显著升高,但泛醇水平无明显改善。HbA1c 水平无明显改善。微循环内皮功能无明显改善。 |
| Sena等,2008 [46] | 2008 | 2型糖尿病GK大鼠模型 | 辅酶Q10 20毫克/千克体重和/或α‐生育酚 持续8周 | HbA1c 水平显著降低。空腹和2小时血糖水平无明显改善。 |
| 梅泽等人 2012 [10] | 2012 | 9名2型糖尿病患者 5名健康志愿者 | 每日200毫克泛醇 12周(2型糖尿病) 患者 泛醇 200 mg 每日 4周 | 有显著改善 HbA1c (从7.1 ± 0.4到6.8% ± 0.4%) 在2型糖尿病患者中。存在胰岛素生成指数显著升高 (0.65 ± 0.29 到 1.23 ± 0.56) 以及前胰岛素与胰岛素比值降低 (3.4 ± 1.8 到 2.1 ± 0.6),在健康志愿者中,表明胰岛素分泌增加。 |
| Sourris等人,2012年 [9] | 2012 | 糖尿病肾病啮齿动物模型 | 辅酶Q10 10毫克/千克/天 持续10周 | 显著降低 24小时尿白蛋白排泄 白蛋白/肌酐比值,以及肾小管间质胶原沉积 |
| 科拉杜兹 莫哈马迪等人 2013[47] | 2013 | 随机双盲 安慰剂对照试验 64名2型糖尿病患者 | 辅酶Q10 200毫克 每日服用 12周 | HbA1c显著降低 在辅酶Q10组中 |
近年来,研究人员在对照干预研究中探讨了辅酶Q10对2型糖尿病患者血糖控制的影响。霍奇森及其同事[44]报告称,在74名无并发症的2型糖尿病和血脂异常患者中,每日补充辅酶Q10(200毫克/天)持续12周,显著降低了HbA1c水平。然而,该研究中空腹血糖或胰岛素水平未见明显改善。此外,通过F2‐异前列腺素测定的氧化应激状态也无明显变化。尽管如此,作者指出,不能排除辅酶Q10对氧化应激的影响,因为F2‐异前列腺素以更系统的方式评估氧化应激,而辅酶Q10可能在细胞或亚细胞水平发挥作用。森纳等人[46]的一项研究也报告了类似发现,该研究检测了辅酶Q10(20毫克/千克体重)和α‐生育酚在糖尿病GK大鼠模型中的作用。
相比之下,辛格及其同事[43]发现,高血压和冠状动脉疾病患者每日两次使用辅酶Q10(每次60毫克)持续8周,可有效降低血压以及空腹和餐后2小时的血浆胰岛素和葡萄糖水平。此外,观察到抗氧化维生素如维生素A、E和C以及β‐胡萝卜素水平显著升高。辅酶Q10组中,硫代巴比妥酸反应物、丙二醛和共轭二烯等氧化应激标志物水平显著降低。作者提出,辅酶Q10可能通过其抗氧化特性以及下调胰岛素受体来增强胰岛素作用,从而保护β细胞。除了在改善血糖控制和胰岛素分泌方面的有效性外,研究还发现辅酶Q10在糖尿病肾病情况下对肾脏具有保护作用[9]。研究表明,在糖尿病肾病小鼠模型中,辅酶Q10(10毫克/千克/天,持续10周)显著减轻了24小时尿白蛋白排泄、白蛋白/肌酐比值以及肾小管间质胶原沉积。通过啮齿动物模型,横山等人[48]证明,经辅酶Q10预处理的大鼠在心肌缺血再灌注后,缓激肽诱导的冠状动脉血管舒张功能提高了12%。辅酶Q10对2型糖尿病患者血糖控制的积极作用在最近梅泽等人[10]和科拉杜兹莫哈马迪等人[47]的研究中进一步得到证实。
相比之下,也有几项研究报告了相互矛盾的结果。例如,Conget 及同事 [41]研究了不同浓度(0、2、4 和 8 μM)的辅酶Q10对体外培养的大鼠胰岛β细胞功能的影响,发现辅酶Q10并未显著增加胰岛素的释放。然而,当使用较高浓度(8 μM)时,观察到胰岛素分泌增加了25%。Eriksson 等人[30]进行的一项双盲安慰剂对照研究中,23名2型糖尿病患者被随机分配接受口服辅酶Q10(每日两次,每次100毫克)或安慰剂治疗6个月。与对照组相比,辅酶Q10组在血糖控制(即血糖水平、HbA1c)方面无明显改善。该结果与Henriksen 等人[42]报告的结果相似,后者测试了1型糖尿病患者每日服用辅酶Q10(100毫克,持续12周)的效果。Eriksson 等人[30]的研究样本量较小,可能存在统计效能不足的问题。Lim 及同事[45]最近的一项研究也显示,在80名2型糖尿病患者中每日服用200毫克辅酶Q10持续12周后,HbA1c水平无明显变化。
大多数这些研究是在20世纪90年代进行的,当时辅酶Q10的还原形式泛醇尚未作为补充剂在市场上供应,因此使用的是辅酶Q10的氧化形式泛醌。许多2型糖尿病患者通常大于40岁,而人体将泛醌转化为泛醇的能力在衰老过程中开始下降。此外,在如2型糖尿病等疾病进展晚期,这种转化效率显著受损[28]。Lim等人[45]的研究进一步支持了这一点,该研究表明,口服辅酶Q10补充剂(泛醌,每日200毫克,持续12周)使总辅酶Q10水平提高了三倍,但未能提高泛醇的比例。与泛醌不同,泛醇是抵抗活性氧的关键,起到抗氧化剂的作用。因此,在2型糖尿病患者中补充泛醌对血糖控制或胰岛素分泌无明显改善的结果,可能归因于泛醌向泛醇转化的障碍。辅酶Q10补充剂的剂量可能是导致先前研究报告结果不一致的另一个因素。低剂量的辅酶Q10(即每日100毫克)很可能无法达到最佳治疗水平,特别是当存在辅酶Q10缺乏时。有必要进一步研究泛醇在2型糖尿病中的有效性。
除了辅酶Q10外,研究人员还研究了其他抗氧化剂(例如花青素、维生素C和E以及白藜芦醇等)在治疗2型糖尿病中的作用。结果也不一致。例如,李及其同事[49]发现,在58名2型糖尿病患者中每日补充纯化花青素24周可有效降低空腹血浆葡萄糖和胰岛素抵抗,并减少血脂异常(低密度脂蛋白胆固醇、甘油三酯、载脂蛋白B和载脂蛋白C)。在一项针对2型糖尿病患者的随机双盲研究中,补充维生素C和E 3个月显著降低了空腹血糖水平和糖化血红蛋白1c,相较于安慰剂组[50]。巴特及其同事[51]报告称,在一项随机对照临床试验中,2型糖尿病患者补充白藜芦醇3个月显著改善了糖化血红蛋白水平。莫瓦赫德等人[52]的研究也观察到了类似结果。此外,在2型糖尿病小鼠模型[53]中发现抗氧化剂能够恢复内质网功能并保护β细胞功能。然而,也有研究报道抗氧化剂作为2型糖尿病辅助治疗仅具有轻微或无明显临床益处[54–57]。同样,这些研究的设计、样本量和剂量等因素可能影响了研究结果的解释。
6. 结论
显然,由氧化应激引起的线粒体功能障碍参与了2型糖尿病的发病机制。由于各种原因,2型糖尿病患者常存在辅酶Q10缺乏。作为一种强效抗氧化剂,辅酶Q10被认为可以清除过量活性氧,保护细胞特别是线粒体免受氧化损伤。因此,通过补充外源性辅酶Q10来恢复2型糖尿病患者的辅酶Q10水平,可能有助于减轻氧化应激、保护线粒体功能,并最终改善血糖控制。这一假设已得到若干研究的部分支持[9,10,38,39,43,44,46–48]。然而,也有研究报道在2型糖尿病中无显著改善[30,41,42,45]。因此,基于目前可获得的证据,仍不清楚或无法对补充辅酶Q10是否能为2型糖尿病患者带来有益效果做出明确结论。需要开展大规模随机临床试验,进一步研究使用更高剂量的泛醇(辅酶Q10的还原形式)对2型糖尿病的影响。




















 1549
1549

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








