医疗器械的评估和非临床影响
摘要
医疗器械(MDs)涵盖多种产品,伴随着技术创新与医疗实践的变革而发展。医疗器械领域的创新不仅可以改善卫生技术的使用条件,还可能在患者诊断或治疗效益之外影响医疗服务组织方式。然而,尽管已开发出考虑医疗系统中各利益相关者的多维模型用于卫生技术评估,但在国家层面的报销决策或医院处方集列入过程中,这些非纯临床标准却很少被记录或纳入医疗器械评估的考量。本文在总结法国卫生技术评估背景的基础上,提出医疗器械评估中非临床标准的定义,并描述了医疗器械评估决策树。最后提出了未来的研究方向。
关键词 : 医疗器械;评估; 卫生技术评估 (HTA)
1. 引言
医疗器械(MD)在《公共卫生法典》(第L5211‐1条)中定义如下:“所谓医疗器械,是指单独或组合使用于人类的任何仪器、装置、设备、材料、产品(除人体来源的产品外)或其他物品,包括其功能涉及的附件和软件,由制造商预期用于人类的医疗目的,且其主要预期作用不是通过药理学、免疫学或代谢手段实现,但其功能可由此类手段辅助。制造商预期专门用于诊断或治疗目的的软件亦属于医疗器械。” 《公共卫生法典》还定义了有源植入式医疗器械和体外诊断医疗器械,这些均属于下文讨论的范围。
因此,医疗器械涵盖多种多样的产品,范围从耗材到昂贵的影像设备,包括可植入假体、残疾人辅助器具、绷带、夹板、某些软件等。通常将医疗器械分为三大类:
1. 一次性使用的耗材或可植入材料;
2. 可重复使用材料;
3. 设备
医疗器械因其多种特定特征而区别于其他产品,其中包括以下两点将更详细讨论的特征:
– 生命周期可能非常短:该领域的技术发展迅速,特定产品的创新周期约为2‐5年。事实上,往往是渐进的技术发展在诊断护理、治疗或残疾补偿方面带来了改进;
– 一种称为操作者依赖性的特征:医疗器械 intended to be used by 卫生专业人员 (医师, 外科医生, 护士等), 患者, 或其家庭成员。由于这一特殊性,医疗器械在不同程度上具有操作者依赖性,因此产生了超出对患者严格意义上的治疗(或诊断)益处之外的获益概念。
因此,医疗器械的技术进步伴随着医疗实践的变化,并可能在医疗服务组织方面(患者自主性、减轻护理负担、医疗服务可及性、对住院时间的影响、手术等)或医疗安全方面(医务人员工作场所安全、改善的人体工程学等)发挥重要作用。
然而,这些并非纯粹的医疗器械临床标准似乎很少在评估中被记录或考虑,无论是在国家层面针对报销资格的评估(国家医疗器械与卫生技术评估委员会[Commission Nationale d’Eva-luation des Dispositf s Médicaux et des Technologies de Santé,CNEDiMTS], 经济评估与公共卫生委员会[Commission d’Evaluation Economique de Santé Publique,CEESP])中,还是在医院等地方决定是否采用新技术时。
鉴于仅通过临床评估往往无法全面反映医疗器械的全部影响,因此对单纯的临床评估及其对决策的影响提出了质疑。
本次专题讨论会的目的如下:
1. 分析非临床标准在当前国家和地方评估中被纳入或未被纳入的程度;
2. 探讨将这些标准纳入评估是否合理且必要,如果有必要,应如何实施?
3. 在评估中纳入这些标准是否可能对决策产生影响。
2. 定义
医疗器械的目的不仅限于治疗,还可以用于诊断或补偿残疾。在残疾补偿领域,医疗器械旨在提高患者的自主性和生活质量。此外,许多医疗器械被间接用于患者管理。这些设备面向卫生专业人员而非患者,可提高卫生干预或医疗操作的安全性,即使其对患者健康没有直接或易于衡量的影响。
例如:
- 改善的人体工程学对用户(医务人员、患者和护理人员)产生影响;
- 在医疗操作期间提供保护(预防血液暴露事故或与电离辐射和化学品相关的风险);
- 缩短学习曲线并提高手术可重复性;
- 侵入性手术对身体造成的损伤更小;
- 缩短手术持续时间和/或住院时间;
- 发展针对患者的家庭护理;
- 为新治疗方法实现越来越早的诊断。
有许多例子:骨科手术中的切割导向器、机器人手术、远程监测、用于止血的机械缝合装置或控制麻醉深度的设备等。
在信息技术领域,医疗器械可以帮助改善医疗系统的功能。对其评估必须整合过程标准(时间、成本、易用性等)。鉴于上述情况,评估医疗器械的标准可能因其使用背景的不同而存在很大差异。
因此,所有圆桌会议参与者建议保留以下临床标准的定义:“临床标准是指发病率和死亡率标准。对发病率和死亡率具有直接或间接影响的中间标准或其他标准也被视为临床标准”。通常情况下,临床标准对应于治疗的治疗目标(降低发病率和死亡率),而中间标准则反映治疗的作用机制(生物学或生理学参数)。根据圆桌会议参与者所接受的术语含义,间接标准是指那些并不反映治疗作用机制但会影响结果的指标,例如:患者的依从性和持续性。据此,圆桌会议参与者逻辑上提出了非临床标准的如下定义:“非临床标准涵盖所有其他标准,可能产生个人或集体影响,涉及患者、其家庭成员、医务人员、医疗机构以及整个社会。” 该定义强调,非临床标准不仅限于患者相关结局(PRO)。这一定义意味着医疗器械评估(或许还包括任何其他卫生技术,包括药品)必须努力考虑卫生系统中所有利益相关者的意见。
3. 背景
很明显,目前医疗保健主管部门所考虑的标准要严格得多。
因此,国家医疗器械与卫生技术评估委员会在其2013年度报告中指出:“[3]评估标准必须与所声称的治疗效果、诊断、残疾补偿及其治疗用途相一致。所采用的终点指标为临床标准(死亡率、发病率、残疾补偿、生活质量、减少副作用),或具有患者临床获益的易用性对患者的临床获益”(作者特别强调)。
对于国家医疗器械与卫生技术评估委员会而言,临床标准包括死亡率、发病率、残疾补偿、生活质量以及减少副作用。易用性标准本身并无独立价值。然而,根据社会保障法典(R165‐2条)中的定义,国家医疗器械与卫生技术评估委员会评估的实际效益(service rendu,SR)应基于两个标准:一方面为产品在治疗效果、诊断、残疾补偿及其治疗用途方面的获益,另一方面为公共健康利益(intérêt de Santé Publique,ISP)。然而,在其监管定义中,ISP包括对人群健康的影响,涉及死亡率、发病率和生活质量,满足未被覆盖的治疗、诊断或残疾补偿需求的能力(考虑到病情或残疾的严重程度),对医疗系统的影响,以及对公共卫生政策和项目的影响。
国家医疗器械与卫生技术评估委员会目前仅考虑患者的观点。相比之下,欧洲卫生技术评估网络(EUnetHTA)[4]卫生技术评估核心模型采用了更广泛的视角,纳入了医疗系统中所有利益相关者的观点(包括患者、医疗专业人员以及整个社区)。除了常规的有效性和安全性标准外,EUnetHTA 核心模型还考虑了许多其他方面,例如:医疗专业人员的健康(对工作场所安全的影响)、技术的使用条件(对技能、培训需求和学习过程的影响)、可持续发展(环境影响)、患者及公众对技术的期望(可接受性、对患者社会参与和健康方面的社会不平等的影响)、医疗组织(对结构和流程的影响、对管理程序的影响)。因此,EUnetHTA 核心模型为医疗器械的多维度评估提供了一个有用的参考,即使它尚未明确如何整合所有这些维度以形成一致的评估结论。多准则决策支持模型可能有助于实现这一目标。[5]
卫生技术评估(HTA)模型的知识已逐步传播到医院。[6,7]此类评估 increasingly 被应用于药品和无菌医疗器械委员会(Commission des Médicaments et des Dispositifs Médicaux Stériles,COMEDIMS)对卫生技术的列名和评估框架中。[8]在此领域,巴黎公立医院援助机构(Comité d’Evaluation et de Diffusion des Innovations Technologiques,CEDIT)于 Assistance Publique–Hôpitaux de Paris(AP‐HP)的先前经验值得强调。最近,其他机构也实施了相同类型的卫生技术评估流程。然而,尽管目前已有推动这些程序标准化的举措,各机构之间的方法仍存在广泛差异。在其中一些程序的处方集决策过程中,对医疗组织影响的评估自然发挥着重要作用,因为医院直接承担与引入新型卫生技术相关的成本和效益。
最近在医疗技术社区获取资金的程序中引入医药经济标准,也可能进一步扩大评估范围。2012年10月2日颁布的2012‐1116号法令对法国国家卫生局(Haute Autorité de Santé,HAS)的医疗经济任务作出规定,明确指出评估必须不仅考虑疗效/质量/安全性三要素、成本和患者生活质量,还应考虑医疗服务组织、专业实践以及生活条件患者、改善医疗服务可及性的公平性以及对伦理规范的遵守。
因此,该文本规定,除CNEDiMTS在其年度报告中定义的标准外,还可纳入其他标准。从社会角度进行的医药经济评估(依据法国卫生局的方法学指南),在衡量成本时(考虑技术引入带来的组织影响、生产率损失等)和确定效益时(考虑对患者及其家属生活质量的影响,引入公平性标准),均纳入医疗系统中所有利益相关者的观点。然而,在实践中,评估范围可能因测量问题而受限(例如,当需要考虑疾病对近亲属生活质量的影响或间接成本的测定)。最后,根据现行安排,医药经济评估与技术医学评估并行开展,并不参与实际效益(SR)和实际效益改进(ASR)的评定。此外,目前很少有医疗器械达到由CEESP进行评估所需的营业额标准(两年内含税2000万欧元),迄今为止,在CEESP已发布或正在评估的近三十项疗效意见中,仅有一项涉及医疗器械。
根据上述讨论,所有圆桌会议参与者都认识到将非临床标准纳入医疗器械评估的重要性。
4. 如何将非临床标准整合到医疗器械的评估中?
专题讨论会参与者在确认将非临床维度纳入医疗器械评估具有价值后,达成一致意见:从方法论角度来看,非临床维度不应凌驾于临床维度之上。然而,在某些特定情况下,评估背景中唯一相关的维度是非临床维度。在这种情况下,且仅在此情况下,非临床维度应优先于临床评估标准。
这里可以提及几个例子:
- 避孕药具(药品或医疗器械),其目标并非临床目的(怀孕不是一种疾病),而是社会目标,应据此进行评估;
- “定制套装”,包含外科手术所需的所有一次性医疗器械,可能包含也可能不包含一次性仪器,而替代方案则是在手术过程中临时准备每件医疗器械;此处并无直接的临床治疗目标,而是需要评估的组织和经济目标;
- 远程医疗,结合了临床和非临床获益。
此外,在我们的讨论中反复提到,对非临床维度的评估决不能偏离与医疗器械临床评估过程中所遵循的方法学严谨性相比。因此,非临床维度是:
- 要么是唯一需要以与临床维度相同严格程度进行评估的相关维度,即方法学上良好研究的主要终点;
- 或作为临床维度之外的附加维度,从而能够提供新的视角,并始终成为真正评估的对象。在这种情况下,非临床标准可以是研究中的次要标准,而该研究的主要终点为临床标准(优效性或非劣效性研究)。
这些考虑因素促使我们绘制了医疗器械评估决策树,该决策树将在评估中包含对非临床维度的评估(图1)。
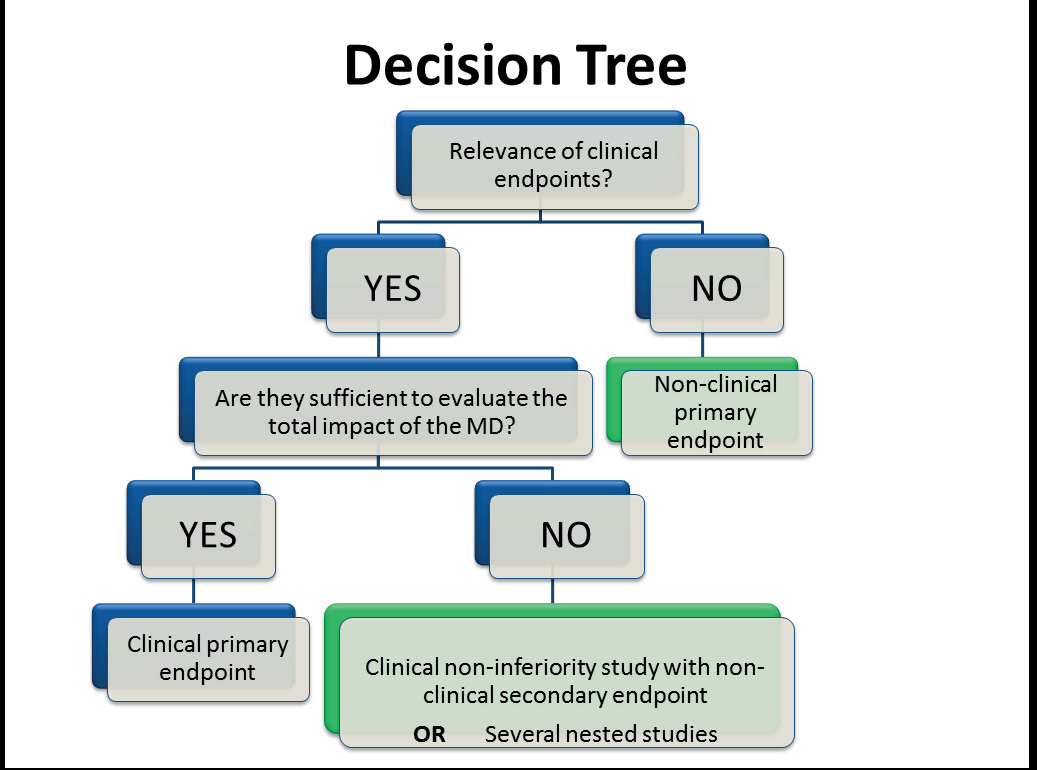
在法国将非临床维度整合到医疗器械评估中的积极之处在于,所有相关工具都已具备,如前一节所述:例如欧洲卫生技术评估网络、证据与价值:对决策的影响 (EVIDEM)[9]以及远程医疗评估模型 (MAST) 均包含了组织、伦理和文化方面的要素。应特别关注这些工具在法国的文化和语言转译问题,且根据所追求目标的不同(国家层面的报销资格或医院的本地列名),其应用也可能存在差异。
同样,即使规定所采用的研究方法学必须与临床目标所用的方法学一样严谨,该小组也意识到,非临床标准直接与环境相关,因此通常必须在研究环境中直接测量。因此,结果从一个国家到另一个国家、甚至从一个机构到另一个机构的情境可转移性问题,比临床标准更为突出。这使得在组织、文化、伦理等方面开展研究变得更加复杂和昂贵。
在可能的情况下,并根据财务和物流限制,研究设计应考虑所有这些情境因素,以最好地回答所提出的问题。
所有这些关于方法学和结果可转移性的问题可能会在将来的会议中专门进行探讨,因为圆桌会议参与者在研讨会上没有足够的时间对这些问题进行充分讨论。
5. 非临床标准的整合以促进对医疗器械和健康产品的更好评估
专题讨论会的参与者普遍达成共识,认为有必要在医疗器械的评估中整合非临床标准,以改进国家和地方层面的评估和决策。
此外,如上所述,一些评估工具已经存在,并且在国家层面已有将非临床维度纳入在内的用于评估的法规文本。
用于医疗器械评估的终点指标(临床或非临床)选择的决策树可能为进一步的工作以及这些工具的有效实施提供基础。然而,目前仍有许多问题尚未解决,值得深入研究。
上一节已提出研究结果的可转移性问题。关于研究设计,可根据治疗领域(植入式医疗器械、慢性疾病、残疾等)详细讨论相关非临床终点指标的选择,以便为企业提供根据医疗器械类型选择相关终点指标的“指南”。
在研究了非临床评估的相关性和可行性之后,其在决策过程中的整合问题仍然存在。在国家层面,法规已规定通过国家医疗器械与卫生技术评估委员会(CNEDiMTS)对公共卫生效益(ISP)的评估,或通过经济评估与公共卫生委员会(CEESP)开展的卫生经济学评估,将这些标准纳入评估之中(参见第2节)。
目前很明显,ISP 很少甚至从未被评估过,这引发了人们对国家医疗器械与卫生技术评估委员会对其评估的合法性问题,并建议应对其进行彻底审查,以纳入额外标准,并在适当时将其纳入医药经济评估中。
制定评估的实际安排非常重要,因为这些安排将直接影响决策。必须提出并讨论的问题包括:由谁负责评估非临床标准?相对于临床终点和公共卫生目标,非临床标准的权重如何?监管机构是否愿意接受以非临床维度的改善来“补偿”临床获益的减少?如果可以,程度如何,需考虑哪些因素?支付方又如何?我们是否应考虑除国家医疗保险计划之外的其他支付方介入,例如补充健康保险、地方政府、法国国家自主团结基金(Caisse Nationale de Solidarité pour l’Autonomie,CNSA)等?
医疗器械在医疗服务组织中具有结构性作用,特别是当整体考虑患者的诊疗路径时(如远程医疗、用于微创手术的骨科植入物,影响住院时长以及康复管理等)。然而,在预算额度不可互换的体系中,要准确评估从医院转向私立医疗等组织变革的价值十分困难。如今,监管者和支付方是否已准备好认可非临床创新的价值?
这当然是决定制造商是否有能力对非临床标准开展研究的因素之一,尤其是因为这些变量很可能无法在不同国家之间进行转移。因此,开展这些研究所需的投资可能非常巨大,参加专题讨论会的制造商提出了关于政府是否可能为这些研究提供财政支持的问题。
最后,总结而言,人们注意到本次专题讨论会期间讨论的许多方面也适用于其他健康产品,其中一些产品可能在医疗保健组织架构中也具有重要作用。将关于非临床评估的讨论范围扩展到所有健康产品将十分有意义。
 医疗器械评估中的非临床标准整合
医疗器械评估中的非临床标准整合




















 39
39

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








