一种新型杂环化合物在放射臂迷宫中改善斯普拉格‐道利大鼠的工作记忆并调节额叶皮层中的多巴胺受体D1R
亮点
- CE‐125 是一种非神经毒性的化合物,可特异性抑制多巴胺转运体(DAT),从而增加突触间隙中的多巴胺水平。
- CE‐125 可改善放射臂迷宫中的空间记忆表现,并提高工作记忆指数(WMI)。
- CE‐125 调节多巴胺受体D1R。
摘要
一系列化合物已显示出可通过多巴胺能系统增强认知功能,事实上,寻找活性更强且毒性更低的化合物的研究仍在继续。因此,本研究旨在合成并测试一种新型杂环化合物在工作记忆范式中对认知增强的效果。特异且有效的多巴胺再摄取抑制作用(DAT(IC50= 4.1 ± 0.8 μM)促使我们在此化合物在放射臂迷宫(RAM)中对大鼠进行测试。
CE‐125(4‐((二苯甲基亚砜基)甲基)‐2‐环丙基噻唑)在已建立的系统中测试了其对多巴胺(DAT)、血清素和去甲肾上腺素再摄取抑制的作用。通过腹腔注射给予雄性斯普拉格‐道利大鼠CE‐125(1或10毫克/千克体重),评估其工作记忆指数(WMI)。为了评估基本神经毒性,进行了敞箱实验、高架十字迷宫、转棒实验和强迫游泳实验。在放射臂迷宫测试的最后一天取额叶皮层组织,测定多巴胺受体D1R和D2R、多巴胺转运体以及磷酸化多巴胺转运体的蛋白质水平。在第10天,两个剂量组的WMI均较溶剂处理组有所提高。在训练组和给药组中,D1R水平显著降低,而D2R水平无变化。各组之间的多巴胺转运体水平相当,而在接受1毫克/千克体重剂量处理的训练组中,磷酸化多巴胺转运体水平升高。CE‐125作为一种可能无神经毒性的化合物和特异性再摄取抑制剂,被证明可提高性能(WMI),并提出其作用机制可能涉及对多巴胺能系统的调节。
关键词 :多巴胺再摄取抑制;环丙基噻唑‐2‐((二苯甲基亚砜基)甲基)‐4;放射臂迷宫;斯普拉格‐道利大鼠;工作记忆
1. 引言
多巴胺能系统在学习和记忆中起着关键作用[1]并且一系列出版物报道了通过多巴胺能系统(包括D1受体激动剂、多巴或多巴胺能药物)增强学习和记忆[2, 3, 4, 5, 6]。多巴胺再摄取抑制通过多巴胺转运体再摄取抑制剂实现,是一种有效的药理学原理,已研究了一系列非可卡因、非甲基苯丙胺类的多巴胺转运体再摄取抑制剂,例如莫达非尼等化合物。事实上,莫达非尼作为合成莫达非尼类似物的先导化合物,已在啮齿动物甚至人类中得到充分研究。
特纳及其同事[7]已证明莫达非尼在健康志愿者中具有认知增强作用,而穆勒等人[8]报告了其对人类工作记忆的轻微影响。明曾贝格和卡特[9]综述了莫达非尼在啮齿动物、健康成人以及多种精神疾病中的神经化学作用及其对认知的影响,这些作用被认为有利于认知过程。
拉塞蒂及其同事[10]提出,莫达非尼可提高前额皮层认知信息处理的效率,同时降低杏仁核对威胁性刺激的反应性。给予莫达非尼可改善甲基苯丙胺依赖个体的工作记忆[11],并可靠地提升多种计划和工作记忆认知测试中的任务愉悦度和表现[12]。此外,莫达非尼治疗结合认知训练与健康志愿者学习能力的提升相关[13]。在啮齿动物中,莫达非尼可恢复睡眠剥夺小鼠的记忆表现[14],而舒曼及其同事[15]已在小鼠中证明其对恐惧记忆的剂量和时间依赖性改善作用。在大鼠中,莫达非尼被证明可增强海马依赖性而非额叶皮层依赖性的空间记忆任务——甚至阻断了额叶皮层中的长时程增强[16]。墨菲及其同事使用莫里斯水迷宫任务报告了莫达非尼对大鼠工作记忆的积极效应[17]。沙努加桑达姆等人[18]展示了莫达非尼在厌恶学习范式中对记忆的任务依赖性影响,而卡拉巴卡克等人[19]揭示了莫达非尼介导的放射臂迷宫中的认知增强作用。最后,贝祖及其同事已表明,莫达非尼以及左旋多巴均表现出药物无关的精确时间调控的空间工作记忆调节作用[20]。
鉴于莫达非尼及其类似物可能对包括工作记忆在内的某些认知功能具有增强潜力,本研究旨在合成莫达非尼用于评估其在工作记忆和参考记忆范式中药理学特性的高特异性且无神经毒性的类似物在工作记忆和参考记忆范式中的药理学特性。
2. 材料与方法
2.1. 化合物CE‐125的合成
2.1.1 [(二苯基甲基)硫基]甲脒胺的合成
将二苯甲醇(26 g,0.14 mol)和硫脲(13.0 g,0.17 mol)加入1 L双口圆底烧瓶中,加入65 mL水。将混合物加热至95°C(形成乳液),然后在30分钟内缓慢加入52 g 48%的 HBr(0.644 mol,4.6当量)。将混合物在回流条件下加热(106 – 107 °C)30分钟,然后冷却至80–85 °C。再用冰冷却,析出晶体沉淀。经过滤并用水洗涤后,得到无色结晶物质。产物经真空干燥,得到19.24 g白色结晶固体(产率:74%)。
2.1.2 4‐(氯甲基)‐2‐环丙基噻唑的合成
在圆底烧瓶中,将2 g(20 mmol)环丙烷硫代甲酰胺溶解于60 mL干燥丙酮中,然后加入2.4 g(20 mmol)1,3‐二氯丙烷‐2‐酮。反应混合物随后在回流条件下搅拌6小时,并在室温下过夜冷却。然后将产物真空浓缩并在高真空下干燥一小时。通过该方法得到1.7克黄色固体产物,直接用于后续合成步骤(产率:49%)。
2.1.3. 4‐((二苯甲基硫代)甲基)‐2‐环丙基噻唑的合成
在圆底烧瓶中,将3.23克(10毫摩尔)[(二苯甲基)硫代]甲脒胺溶于100毫升甲醇中。随后,向混合物中加入1.7克(9.8毫摩尔)4‐(氯甲基)‐2‐环丙基噻唑和6.9克(5当量,50毫摩尔)碳酸钾。将混合物在室温下搅拌2天。
甲醇在减压下除去,加入150毫升水。然后用100毫升乙酸乙酯萃取(3次)反应产物。收集有机相,合并,用Na₂SO₄干燥,过滤,并将产物真空浓缩。
粗产品通过硅胶快速柱层析进行纯化,流动相为二氯甲烷中的5%甲醇。分离后的产物经旋转真空泵浓缩,并在冰箱中冷却过夜。通过该方法得到2.45克半固体产物(产率:72.6%)。
2.1.4. 4‐((二苯甲基亚砜基)甲基)‐2‐环丙基噻唑(CE‐125)的合成
在圆底烧瓶中,将2.45克(7.26毫摩尔)4‐((二苯甲基硫)甲基)‐2‐环丙基噻唑溶于20毫升冰醋酸中。将0.75毫升(7.26毫摩尔)30% H₂O₂滴加到溶液中,并搅拌12小时。
用冰浴中的5%碳酸氢钠中和酸性。反应产物用100毫升乙酸乙酯萃取(3次)。收集有机相,合并,用Na₂SO₄干燥,过滤,并在旋转蒸发仪上浓缩乙酸乙酯。
通过硅胶快速柱层析纯化得到半固体棕色产物。使用含5%甲醇的二氯甲烷作为流动相。获得结晶产物,随后在高真空中干燥。通过该方法得到1.27 g白色固体材料(产率:49.69%)。
采用基于C18分析柱的高效液相色谱法在反相条件下测定,该化合物的总纯度为99.63%(补充图1)。
[M+H⁺]= 354.0981, [M+Na⁺]= 376.0800(补充图2)。
¹H核磁共振 (500兆赫, 氘代氯仿, 23摄氏度): δ= 7.50 (CH‐2,6, 苯基), 7.49 (CH‐2,6, 苯基), 7.39 (2x CH‐3,5, 苯基), 7.33 (2x CH‐4, 苯基), 7.01 (s, 1H, CH, 噻唑‐5), 5.13 (s, 1H, CH), δ=3.97, 3.75 (AB, 2H, CH₂), 2.32 (m, 1H, CH, 环丙基), 1.17 (d, 2H, CH₂环丙基), 1.09 (d, 2H, CH₂,环丙基) (补充图3)。
¹³C{¹H}核磁共振 (125.75兆赫, 氘代氯仿, 23摄氏度): δ= 173.98 (C‐2, 噻唑), 144.28 (C‐4, 噻唑), 116.90 (C‐5, 噻唑), 136.09 (Cq‐1, 苯基), 134.15 (Cq‐1, 苯基), 129.85 (C‐2,6, 苯基), 129.07 (C‐2,6, 苯基), 128.94 (C‐3,5, 苯基), 128.60 (C‐3,5, 苯基), 128.25 (C‐4, 苯基), 128.17 (C‐4, 苯基), 69.67 (CH), 51.33 (CH₂), 14.54 (CH, 环丙基), 11.32 (CH₂,环丙基), 11.29 (CH₂,环丙基) (补充图4)。
2.1.5. 分析表征(核磁共振、质谱、高效液相色谱)
核磁共振谱在配备5毫米可切换探头(PA BBO 500SB BBF‐H‐D‐05‐Z,¹H,BB = 19F 和 ³¹P ‐ ¹⁵N)以及z轴梯度和自动调谐和匹配附件(布鲁克BioSpin)的布鲁克Avance 500核磁共振波谱仪(UltraShield)上记录。¹H核磁共振的共振频率为500.13 MHz,¹³C核磁共振为125.75兆赫。所有测量均在完全氘代的氯仿或甲醇溶液中于298开尔文下进行。采用制造商提供的标准一维和梯度增强二维实验,如双量子过滤COSY、NOESY、HSQC和HMBC。化学位移以内标法校准,以氯仿¹H的残余非氘代溶剂信号(δ 7.26 ppm)或甲醇¹H(δ 3.31 ppm)为参考,¹³C则以氯仿碳信号(δ 77.00 ppm)或甲醇碳信号(δ 49.00 ppm)为参考。
高分辨电喷雾离子化质谱数据在布鲁克·达通尼克(德国不来梅)的maXis HD 电喷雾‐四极杆‐飞行时间质谱仪上获得。样品用甲醇溶解至20 μg/mL,并直接进样以3 μL/min的流速通过注射泵进入ESI源。ESI离子源工作条件如下:毛细管电压:0.9至4.0 kV(各自优化),雾化器:0.4 bar(N₂),干燥气体流量:4 L/min(N₂),干燥温度:200 °C。质谱在正离子模式下m/z 50–1550范围内采集。使用Bruker CompassDataAnalysis 4.2根据质量精度(Δm/z ≤ 2 ppm)和同位素模式匹配(SmartFormula算法)确定分子式。
采用LC‐2010A HT液相色谱仪(岛津公司,日本东京)获取高效液相色谱图。将 CE‐125溶于甲醇,配制成1毫克/毫升的浓度。取10 μL样品在AcclaimTM 120 C18柱(2.1×150 mm,赛默飞世尔科技,美国马萨诸塞州)上进行分析,色谱条件为反相条件(水‐乙腈10‐90%梯度洗脱)。
2.2. CE125的再摄取抑制实验
Dulbecco改良型Eagle培养基(DMEM)、胰蛋白酶和胎牛血清购自Sigma‐Aldrich Handels GmbH(奥地利)。[³H]5‐HT(羟基色胺肌酸硫酸盐;5‐[1,2‐³H[N]];27.8 Ci/mmol)、[³H]DA(二羟基苯乙胺;3,4‐[环‐2,5,6‐³[H]]‐多巴胺;36.6 Ci/mmol)和[³H]MPP⁺ (甲基‐4‐苯基吡啶碘化物;1‐[甲基‐³H];80 Ci/mmol)购自珀金埃尔默(Perkin Elmer),波士顿,马萨诸塞州。
使用稳定表达人源多巴胺转运体(DAT)、去甲肾上腺素转运体(NET)和血清素转运体(SERT)的HEK293细胞进行再摄取抑制实验。所有细胞系在实验前24小时接种于预先涂有聚‐D‐赖氨酸(PDL)的96孔板中(5×10⁴个细胞/孔)。每孔用100 μL Krebs‐HEPES缓冲液(KHB;10 mM HEPES,120 mM NaCl,3 mM KCl,2 mM CaCl₂·2H₂O,2 mM MgCl₂·6H₂O,5 mM D‐(+)‐葡萄糖一水合物,pH 7.3)洗涤。细胞先在含有CE 125不同稀释浓度(0.1 μM、1 μM、10 μM、0.1 mM和1 mM)的KHB中预孵育5分钟。CE 125首先溶于99.9%二甲基亚砜(DMSO),然后用KHB稀释。随后,细胞在含有相同稀释浓度CE 125的KHB中孵育,并分别加入0.2 μM [³H]‐多巴胺(用于HEK‐DAT)、0.05 μM [³H]MPP⁺ (用于HEK‐NET)和0.4 μM [³H]5‐HT(用于HEK‐SERT)。HEK‐DAT和 HEK‐SERT的孵育时间为1分钟,HEK‐NET为3分钟。为测定HEK‐DAT和HEK‐NET中的非特异性摄取,使用10 μM的mazindol,HEK‐SERT则使用10 μM的paroxetine。在室温孵育后,反应被通过加入100 μL冰冻KHB终止,最后用300 μL 1% SDS裂解细胞,并通过液体闪烁计数器测量释放的放射性。
(Tri‐carb‐2300TR, 珀金埃尔默)[21, 22, 23]
2.3. 动物
60只12至14周龄的雄性斯普拉格‐道利大鼠用于所有实验。这些大鼠由维也纳医科大学生物医学研究中心核心单元、实验动物科学与遗传学部饲养和维持,笼具为聚碳酸酯材质,垫料为经高压灭菌的木屑。食物和瓶装水均自由获取。房间内人工照明强度约为200勒克斯(距地面2米处),每日从早上5点持续至下午7点。实验在上午8点至下午2点之间进行。所有操作均遵循1986年11月24日(86/609/EEC)欧洲共同体理事会指令以及维也纳医科大学伦理委员会的指导原则,并获得奥地利联邦教育、科学和文化部批准(BMWFW‐66.009/0114‐WF/II/3b/2014)。所有努力均旨在尽量减少动物痛苦并减少使用动物数量。
2.4. 行为学研究
为了研究CE‐125治疗的行为学效应,进行了多项实验,对大鼠(每组10只)给予腹腔剂量CE‐125 10毫克/千克体重,连续给药十天,并在每次测试当天继续给药。所使用的测试顺序如下:敞箱实验、高架十字迷宫、转棒、神经行为观察量表和强迫游泳实验。同时,以 DMSO处理的10只大鼠作为溶剂对照组进行平行研究。
2.4.1. 敞箱实验 (OF)
大鼠在实验箱(100 cm × 100 cm,墙高40 cm)中由视频监控系统进行观察,该系统由摄像机与计算机追踪系统连接组成,观察时长为10分钟。每只大鼠被放置于中心位置,测量以下参数:a) 移动路径长度,b) 静止时间,c) 局部活动百分比,d) 大幅活动百分比,e) 速度,f) 穿越中心次数,以及 g) 转身次数 [24]。
2.4.2. 高架十字迷宫 (EPM)
大鼠的焦虑样行为被观察。高架十字迷宫由黑色聚氯乙烯制成,包含4个臂(每个臂长50厘米,宽10厘米),排列成加号形状,并离地70厘米高。其中两个相对的臂为开放臂,另外两个臂有40厘米高的壁。所有臂通过一个10厘米×10厘米的中央区域相互连接。使用摄像机连接计算机追踪系统在实验箱内观察大鼠。将大鼠放置于中央区域。记录以下参数:a)在封闭臂和开放臂中的停留时间;b)进入封闭臂和开放臂的进入次数;c)在封闭臂和开放臂中的移动路径长度。当大鼠四只腿全部进入臂内时定义为一次进入 [24]。
2.4.3. 转棒
转棒(Rota Rod “Economex”,哥伦布仪器公司,俄亥俄州 美国)用于测试平衡与协调,由一个在5分钟内从4转/分加速至40转/分的旋转鼓组成。记录每只大鼠从鼓上掉落的时间。每只大鼠先进行三次预训练试验。随后,每只大鼠再完成三次连续试验,分析时采用其在鼓上的最长持续时间 [25]。
2.4.4. 神经行为观察量表
该程序遵循欧文 [26] 建立的方法。通过一系列测试揭示步态或姿势缺陷、肌张力变化、握力、视觉敏锐度和体温异常。为完成评估,对重要的反射进行评分。此外,在操作过程中记录异常行为、恐惧、易激惹、攻击性、兴奋性、流涎、流泪等情况 [25]。
2.4.5. 强迫游泳实验 (FST)
该实验按先前所述方法进行[27]。实验包括两个阶段:前测阶段和测试阶段,使用相同的装置和条件(直径18 cm,高度40 cm,装有23 cm深、保持在25 °C的水)。在前测阶段,大鼠被强迫游泳15分钟;24小时后,大鼠被放入同一装置中5分钟,此为测试阶段。记录5分钟内的不动时间。
2.5. 放射臂迷宫(RAM)
2.5.1. 仪器
迷宫由黑色塑料制成,放置在距地面80厘米高的位置,房间内有大量视觉线索。中央平台直径为50厘米,向外呈放射状延伸出12条臂(12厘米×60厘米)。训练开始前,使用一个塑料圆筒限制大鼠在中心区域的活动。该圆筒通过房间远端的滑轮系统进行升降控制。
2.5.2. 程序
放射状臂迷宫训练按照Levin等[28]和Timofeeva等[29]所述方法进行了一些修改。简而言之,大鼠在5天内接受处理以适应环境(每只大鼠每天30分钟),同时将体重减少至85%。训练期间水自由获取。食物(德国ssniff Spezialdiäten有限公司)的供给量维持在训练期间大鼠瘦而健康的体重,约为自由进食体重的85%。在12条臂中,训练期间有8条臂放置食物,4条臂未放置食物。在训练开始前,大鼠接受两次适应性训练,期间将食物放置在整个迷宫中,允许大鼠探索迷宫并在其中进食五分钟。在训练阶段,每次试验开始时,对每只大鼠均使用相同的8条有诱饵的臂,以评估工作记忆,而其余4条臂始终不放置食物,用于测试参考记忆。
每只大鼠的有诱饵和无诱饵臂的分布模式在整个测试过程中保持一致,但在不同大鼠之间有所不同。每次试验通过将大鼠放置在中央平台上开始,10秒后缓慢提起圆筒,允许大鼠进入任意臂。每次试验持续八分钟,或直到所有8条放置食物的臂均被进入为止,以先发生者为准。
工作记忆指数(WMI)通过将首次进入有诱饵的臂的次数除以进入有诱饵的臂的总次数来计算。
大鼠接受了10次训练,每天一次试验。配对组大鼠经历了与训练组大鼠相似的操作、适应和食物限制,但在试验期间没有提供食物,因此不会形成任何记忆。训练阶段使用计算机化追踪摄像机进行记录:1/3 SSAM HR EX VIEW HAD [23]第十次训练结束六小时后,动物用二氧化碳深度麻醉,并通过颈椎脱位处死。
脑组织被迅速取出,并在设定为4–6°C 的冷板上快速解剖额叶皮层,随后储存在 –80 °C 环境中以备进一步的生化分析。
2.6. 突触体的制备
突触体的制备步骤均在冰上进行,所有缓冲液均含有蛋白酶抑制剂(Sigma Aldrich 货号# 11836145001)和磷酸酶抑制剂(Sigma‐Aldrich 货号#4906837001)。
大鼠额叶皮层使用Syn‐PER™ 突触蛋白提取试剂进行匀浆。(Thermo Scientific 货号# 87793)。
匀浆在 1200 x g 下离心 10 分钟。所得上清液随后在 15000 x g 下离心 25 分钟。离心后,沉淀保存于 –80°C 直至使用。突触体沉淀用提取缓冲液(150mM NaCl,50mM Tris, pH 8.0)重悬,其中含终浓度为 1.5%(w/v) 的 SDS。样品在室温下溶解 30 分钟,每 10 分钟涡旋一次。随后使用 BCA 蛋白检测试剂盒(Pierce. 产品编号#23225)测定蛋白含量。然后将样品分装并储存在 –20°C 用于免疫印迹。
2.7. 蛋白质印迹
蛋白样品与上样缓冲液(Loading Sample Buffer,伯乐,货号#161‐0747)混合后,在37 °C下孵育20分钟。根据分子量将不同量的蛋白质上样至SDS‐PAGE凝胶(D1和D2为5 μg,磷酸化DAT为 10 μg,DAT为 20 μg)。使用Peqlab电泳系统进行SDS‐聚丙烯酰胺凝胶电泳,采用4 %浓缩胶和8 %或10%分离胶。电泳缓冲液包含25mM Tris、192mM 甘氨酸 和0.1% SDS(w/v)。电压设置为50V运行30分钟,100V运行30分钟,最后150V运行1小时。
突触体蛋白从SDS‐PAGE凝胶转移至PVDF膜,随后在含5 %(w/v)脱脂奶粉的TBS [12,95 mM Tris(pH 7.5),154 mM NaCl]中封闭1小时。然后将膜与稀释的兔抗大鼠一抗在 4°C孵育过夜,所用抗体包括DRD1(GenScript,1:5000)、DRD2(GenScript,1:5000)[30], DAT(GenScript,1:5000)和pDAT(艾博抗,1:4000,ab183486)。随后检测使用HRP标记的抗兔Ig G(艾博抗,1:20000,ab6721)。膜用ClarityTM WesternECL底物(伯乐,货号# 170‐5061)显影。使用Image J软件(美国国立卫生研究院)测量免疫反应条带的光密度。为标准化测得的密度值,采用考马斯亮蓝R‐350染色的膜作为上样对照[31, 32]。
2.8. 统计学
在再摄取实验中,为评估半数抑制浓度(IC50)值,进行了非线性回归分析。对于放射臂迷宫实验,采用方差分析检验(ANOVA test),而对于其他行为学测试以及CE‐125处理组与对照组的蛋白质印迹结果比较,则应用非参数t检验。显著性水平设定为P<0.05。所有计算均使用Windows版GraphPad Prism 6.00版本(GraphPad软件2,美国加利福尼亚州圣地亚哥)完成。
3. 结果
3.1. 多巴胺转运体再摄取抑制
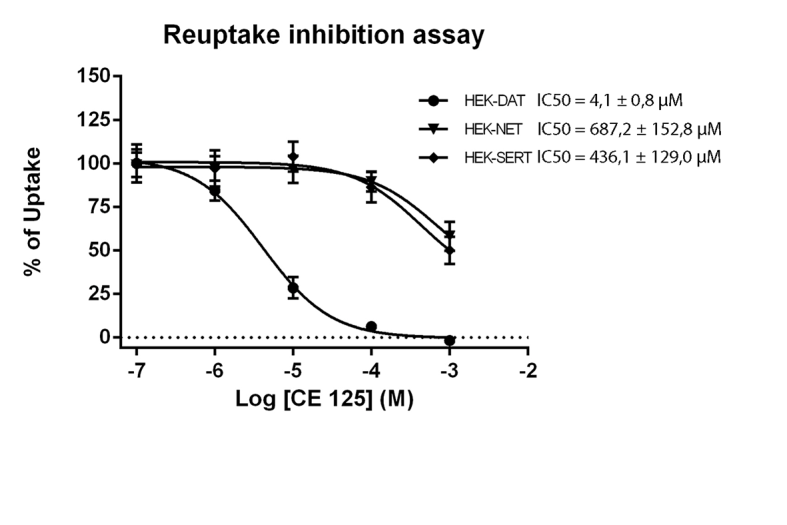
采用再摄取抑制实验测定CE‐125阻断底物[³H]DA、[³H]MPP⁺和[³H]5‐HT通过其相应转运体多巴胺转运体、NET和SERT摄取的效力。CE‐125对多巴胺转运体摄取的抑制作用具有更高的效力(IC50= 4.1 ± 0.8 μM;n = 3),相较于NET(IC50= 687.2 ± 152.8 μM;n = 3)和SERT(IC50= 436.1 ± 129.0 μM;n = 3)。结果如图1所示。

3.2. 敞箱实验
如补充图5所示,在总移动距离、静止时间、局部和大幅运动、平均速度、中心区域穿越次数、自发方向改变频率以及在边缘区域停留时间等参数上,处理组与未处理组动物之间无差异。
3.3. 高架十字迷宫
如补充图6所示,在各组之间,左开臂停留时间、左闭臂停留时间、总移动距离等参数均无显著差异,在开放臂和闭合臂中的移动距离、在开放臂和闭合臂中的停留时间以及静止时间。
3.4. 转棒
如补充图7所示,各组在旋转棒上的停留时间无显著差异。
3.5. 神经行为观察量表
As given在补充表1中,各组之间无显著差异。
3.6. 强迫游泳实验
如补充图8所示,在估计不动时间时,各组之间没有显著差异。
3.7. 放射臂迷宫
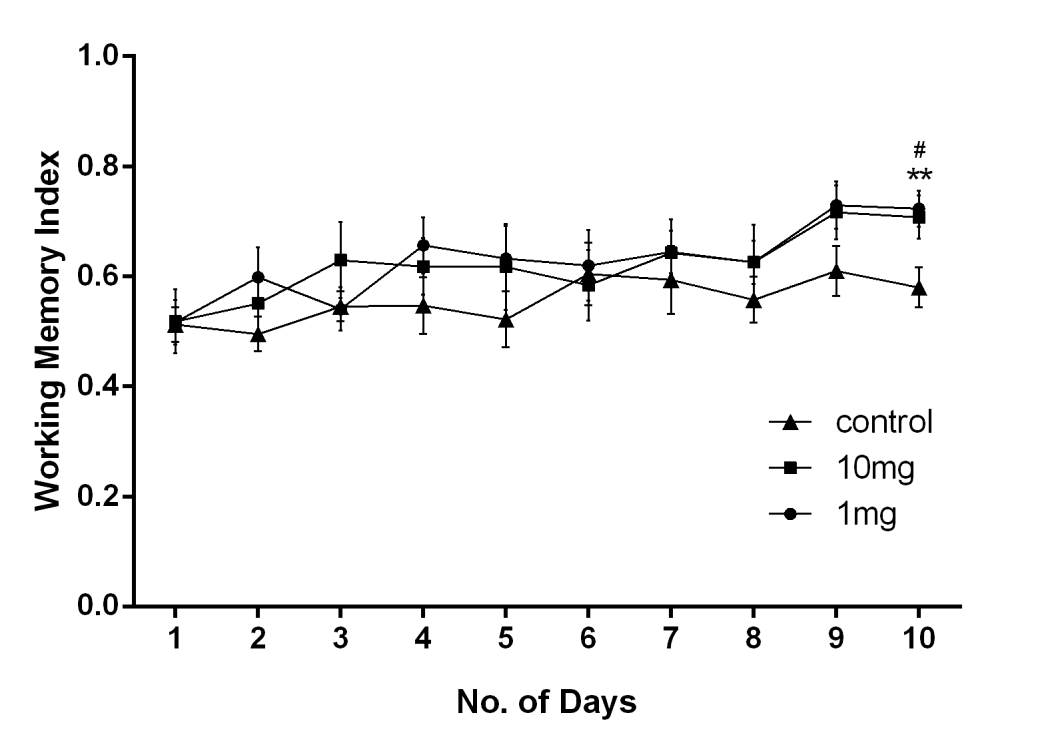
1毫克、10毫克和对照组大鼠的记忆表现在训练天数中逐步提高。工作记忆指数(WMI)通过将首次进入有诱饵臂的次数除以进入有诱饵臂的总次数来计算。在对照组中,WMI逐渐增加至第6天,并在后续训练天数中保持稳定;然而,在1毫克和10毫克/千克体重 CE‐125处理组中持续改善(图 2)。因此,与对照组相比,10毫克和1毫克组在第10天表现出显著的记忆改善(F (9, 270) = 3.011;p < 0.01)。在10毫克组中,训练天数之间的潜伏期也观察到显著差异(F (9,270) = 2.800,p < 0.001)(补充图9)。Bonferroni事后分析比较溶剂对照组与不同时间点的CE‐125处理组,显示出显著变化。
在12臂放射迷宫中持续10天评估工作记忆指数。与溶剂对照组相比,接受CE‐125的大鼠表现更好。随着天数的增加,1毫克/千克和10毫克/千克体重的训练大鼠的工作记忆指数均有提高(F (9, 270) = 3.011;P< 0.01)。数据采用方差分析和Bonferroni 事后检验进行分析。数据以均值 ±标准误表示。** p < 0.01,溶剂对照组 vs. 1毫克/千克;# p < 0.05,溶剂对照组 vs. 10毫克/千克体重。
在12臂放射迷宫中对潜伏期进行了为期10天的评估。接受CE‐125(10毫克/千克)的大鼠表现优于溶剂对照组和1毫克/千克剂量组(F (9, 270) = 2.800;P< 0.001)。
数据采用方差分析和Bonferroni 事后检验进行分析。数据以均值 ±标准误表示。### P < 0.001,溶剂对照组与10毫克/千克(补充图9)。
3.8. 免疫印迹结果
3.8.1. D1R(多巴胺受体D1)
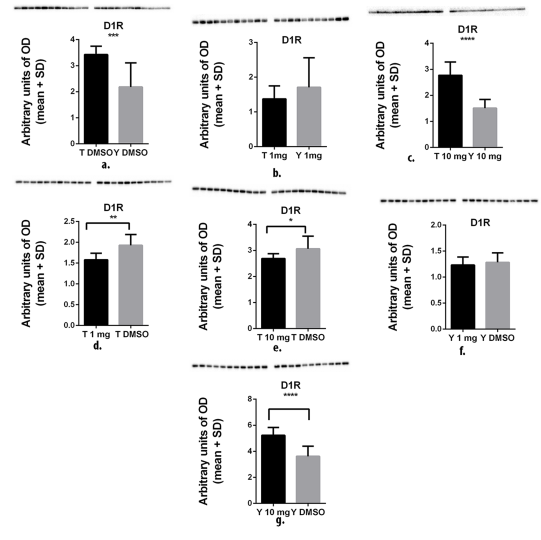
在溶剂处理组和经10毫克/千克体重CE‐125处理的组中,训练显著增加了D1R水平,如图 3a,c所示。1毫克/千克体重CE‐125处理对D1水平无影响,即训练大鼠与未训练动物之间未观察到显著差异(图3b)。1 毫克和 10 毫克/千克体重的CE‐125降低了训练大鼠中的D1R水平(图3d,e)。虽然1毫克/千克体重的CE‐125对D1R水平无影响,但在未训练动物中,10毫克/千克体重显著增加了D1R水平(图3f,g)。
3.8.2. D2受体
在训练和未训练的溶剂处理组中,D2受体水平相当(图4a)。尽管上述各组对应的D2受体水平相似,但经1 毫克和 10 毫克/千克体重CE‐125处理的组中,未训练动物的D2受体水平显著降低(图4b,c)。
4. 讨论
该研究的主要发现是CE‐125的两个剂量均改善了工作记忆表现。结果表明,动物学会了该任务,且D1R和pDAT水平受到训练以及化合物的影响。
CE‐125的合成实现了高纯度,并通过核磁共振和小分子质谱进行了表征。再摄取抑制实验表明,该化合物对多巴胺转运体(DAT)的再摄取具有特异性抑制作用,而对血清素和去甲肾上腺素转运体的再摄取抑制作用则低约两个数量级。
行为检测未显示在每日腹腔给药CE‐125、腹腔剂量为10毫克/千克体重后出现任何行为/毒性变化。
在灵长类动物和啮齿动物中的前期研究提出,D1R与工作记忆相关:Brozoski 等人[33]发现,在恒河猴背外侧前额叶皮层中多巴胺的选择性耗竭可通过给予左旋多巴或阿扑吗啡(一种D1/2受体激动剂)得到逆转;事实上,学习过程中阻断海马D1类受体会影响单次尝试位置记忆[34]。已知多巴胺受体拮抗剂SCH23390会抑制大鼠的空间与非空间记忆[35],且多项行为学研究表明,D1R在多种工作记忆范式中对记忆表现至关重要[36,38,38,39,40]。早在多年前就已提出,D1R激动作用在前额叶皮层的工作记忆过程中发挥重要作用[41,42],而在放射臂迷宫中利用先前获得的空间信息的能力需要前额叶皮层D1R的激活以及D1R对海马输入的调节,这进一步指出了D1R在工作记忆中的关键作用[43]。本研究发现,训练可增加额叶皮层中的D1R水平,但训练合并CE‐125则无此效果;然而,这并不与以往研究相矛盾,因为文献中关于D1R的报道并未测量该受体在额叶皮层的水平。
pDAT 即活化水平在本研究的训练后未治疗大鼠的额叶皮层中降低,在先前的研究中海马体也出现类似情况[24],但在本研究中,给予1毫克/千克体重的CE‐125会增加pDAT水平,这些结果的解释仍不明确。CE‐104是CE‐125的类似物,然而,在训练并经药物处理的大鼠额叶皮层中,其pDAT水平未显示出统计学上的显著差异[23]。CEs与DAT结合并随后抑制多巴胺再摄取的过程可能与DAT或pDAT水平的变化无关。
综上所述,CE‐125 是一种有效且特异的多巴胺转运体再摄取抑制剂,在没有引起不良行为变化的情况下,显著改善了放射臂迷宫中的工作记忆。它将在进一步的药理学和药物研究中,成为具有挑战性的跟踪化合物。





















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








