类似暴饮的乙醇饮用增加成年小鼠腹侧被盖区Otx2、Wnt1和Mdk基因表达
卡桑德·科尔斯1,2和艾米·W·拉塞克1
1表观遗传学酒精研究中心,精神病学系,伊利诺伊大学芝加哥分校,芝加哥,伊利诺伊州,美 国。2解剖学与细胞生物学系,伊利诺伊大学芝加哥分校,芝加哥,伊利诺伊州,美国。
摘要
酒精使用障碍与多巴胺能系统的病理生理变化相关。同源框基因2(OTX2)是一种转录因子,对位于腹侧被盖区(VTA)的多巴胺能神经 元的发育至关重要,而VTA是大脑中参与药物强化的关键区域。先前的研究表明,胚胎发育期间的乙醇暴露会降低中枢神经系统中Otx2mRNA水 平。我们假设,在成年动物中类似暴饮的乙醇摄入会改变OTX2的水平。为了验证这一点,在小鼠采用“黑暗中饮酒”方案连续饮用乙醇4天后, 分别通过定量实时PCR和蛋白质印迹法检测小鼠腹侧被盖区中Otx2的mRNA和蛋白质水平。在乙醇饮用后,还检测了VTA中已知或推测的 OTX2转录靶基因(Sema3c、Wnt1和Mdk)的表达。在第四次饮酒阶段24小时后,VTA中的Otx2mRNA和蛋白质水平升高,并且Mdk转录本的 表达也相应增加。有趣的是,Wnt1转录本在第四次饮酒阶段结束后立即在VTA中升高,但在24小时后恢复至对照水平。接下来,我们研究了在小 鼠VTA中病毒介导的Otx2减少是否会影响乙醇或蔗糖的摄入。将表达靶向Otx2的shRNA或对照shRNA的慢病毒载体注射到VTA中,随后在“黑 暗中饮酒”方案中测试小鼠对乙醇和蔗糖的饮用情况。降低VTA中OTX2的水平并未改变乙醇或蔗糖的消耗。一个局限性在于OTX2减少的程度可 能不够充分。尽管VTA中的OTX2在成年小鼠类似暴饮的行为中可能不起作用,但它可能参与乙醇诱导的该区域转录变化。
关键词 :酒精使用障碍,多巴胺,乙醇,小鼠,Otx2,Wnt1,Mdk
引言
根据美国疾病控制与预防中心(CDC)的数据,酒精滥用 是全球第三大可预防的致死因素。与酒精相关的损害对美 国造成了巨大的经济负担,其中75%的成本归因于暴饮。1,2迫切需要了解导致暴饮的生物学机制,因为这可能有助于发现新的治疗靶点,从而减少有害饮酒及其相关的健康 和经济成本。调节暴饮行为的一个神经解剖学基础是腹侧 被盖区(vTA)。vTA中的多巴胺能神经元在药物奖赏和 强化中起关键作用,并参与暴饮行为以及酒精使用障碍 (AUD)的发展。3乙醇会急性激活vTA内的多巴胺能神 经元,4-6 而长期乙醇暴露则会引起多巴胺能系统的适应不良性改变。7-9
同源框基因2(OTX2)是一种转录因子,参与大脑发 育过程中腹侧被盖区(vTA)多巴胺神经元的分化,胚胎 发育期间的乙醇暴露会改变大脑中Otx2的基因表达。例如, 与孕期饮用水的大鼠雄性后代相比,孕期饮用乙醇的大鼠 雄性后代全脑中的Otx2mRNA显著减少。小鼠脑干中 Otx2的基因表达也与胚胎形成期间乙醇诱导的细胞死亡数 量相关。这些结果提示,乙醇可能通过影响Otx2基因表达 来改变多巴胺神经元的发育和/或功能。
青少年小鼠vTA中Otx2蛋白减少与成年后对压力诱发 抑郁的易感性相关17 ,且酒精使用障碍与抑郁症之间存在 显著共病18-20 。然而,Otx2不仅在胚胎发育期间表达,其 在成年小鼠的多巴胺神经元中也持续表达21,22 。据我们所 知,成年动物饮酒对vTA中Otx2基因和蛋白水平的影响尚 未被研究。因此,在本研究中,我们检测了vTA中 OTX2的mRNA和蛋白质水平
使用成熟的黑暗中饮酒(DID)测试,在达到暴饮水平的 酒精摄入后,对成年小鼠腹侧被盖区进行分析。已知腹侧 被盖区(vTA)内OTX2转录活性的靶基因包括Wnt1和 Sema3c。因此,除了检测Otx2转录本的表达外,我们还 确定了已知及推测的OTX2转录靶点在暴饮水平的乙醇饮 用后是否在腹侧被盖区(vTA)发生表达改变。
本文展示的结果表明,小鼠暴饮水平的乙醇摄入会导 致腹侧被盖区(vTA)中Otx2mRNA和蛋白质的增加。
我们还发现乙醇诱导了Wnt1以及一个假定的OTX2转录靶 基因Mdk的表达上升,并且我们发现Mdk启动子区域含 有OTX2结合基序。值得注意的是,我们先前发现,在 VTA中降低Mdk水平会导致小鼠的乙醇摄入增加24。我们 假设,在VTA中降低Otx2的表达会产生与降低Mdk相似 的效果。因此,为了确定OTX2在乙醇饮用行为中是否具 有相关作用,我们使用表达短发夹(sh)RNA的慢病毒载 体靶向Otx2进行RNA干扰,以降低小鼠腹侧被盖区中 Otx2的表达水平,并在DID测试中检测乙醇饮用行为。我 们的结果为暴饮水平的乙醇摄入对多巴胺能系统中基因表 达变化的影响提供了重要的新机制见解。
材料与方法
动物
雄性和雌性C57BL/6J小鼠于8周龄时购自杰克逊实验室 (美国缅因州巴港)。实验前,小鼠在12小时反转黑暗周 期环境(上午10点关灯)中单只饲养2至3周,并于10至 11周龄开始进行乙醇消耗测试。小鼠可随意获取食物( Teklad7912饲料,Envigo,美国印第安纳州印第安纳波 利斯)。除2小时或4小时的乙醇和蔗糖饮用测试期间外, 小鼠也可随意获取水。所有操作均经伊利诺伊大学芝加哥 分校动物护理委员会(许可号16‐144和19‐132)批准。动 物护理遵循美国国立卫生研究院Guide f or the Care and Use of Laboratory Animals的规定,并尽一切努力减少动物痛 苦。
黑暗中饮酒(DID)
DID测试是一种小鼠暴饮模型,可产生药理学上相关的血 液酒精浓度(BALs)(⩾80 mg%)。23在黑暗周期开始3小 时后,向每只小鼠的家居笼中提供一根改良的吸管,其中 装有20%乙醇(DeconLabs,美国宾夕法尼亚州普鲁士 王市)溶于水的溶液或纯水(对照组)。24在进行DID实 验前3天的星期五,让小鼠先在一个2小时饮酒阶段内适应 装有水的吸管。实验前对小鼠进行称重
DID测试开始前4小时。小鼠在星期一至星期三期间,在 黑暗周期开始3小时后,有2小时的时间可以饮用20%乙醇 溶液或水,并在每次饮酒阶段结束时测量消耗的液体量。
在第四天(星期四),小鼠有4小时的饮水时间,并在2小 时和4小时时分别测量液体消耗量。对于经历反复黑暗中 饮酒周期的小鼠(即慢病毒实验),在星期四饮酒阶段结 束后将乙醇瓶更换为标准水瓶,并在下一个星期一恢复 DID测试(停用3天,随后连续4天饮用乙醇)。这些相同 的小鼠在乙醇饮用测试完成3天后还进行了蔗糖消耗测试, 使用与乙醇测试相同的程序提供2%(重量/体积)蔗糖溶 液,并在第四次蔗糖饮用测试完成1天后(~20小时)实施 安乐死。
VTA解剖
小鼠在第四次饮酒阶段后立即(称为“0小时”组)或24 小时后通过快速断头法实施安乐死,以检测基因表达和蛋 白质水平。迅速将大脑从颅骨中取出,并使用脑切片矩阵 (Zivic仪器公司,匹兹堡,宾夕法尼亚州,美国)将脑组 织切成1毫米厚切片,再用内径为1毫米的玻璃巴斯德移液 管从切片中punched出腹侧被盖区(vTA)。该解剖方 法富集了腹侧被盖区(vTA),但可能也包含部分周围组 织。组织穿孔样本被转移至1.5毫升离心管中,在干冰上速 冻后储存于−80°C,直至进行RNA或蛋白质测定。在断头 后立即采集躯干血,或在第12次饮酒阶段后的慢病毒实验 中,在4小时饮酒阶段结束后通过尾静脉使用肝素化毛细 管采集血液,用于测量血液酒精浓度(BALs)。血样储存 于−80°C,直至进行BALs测定。
烟酰胺腺嘌呤二核苷酸-乙醇脱氢酶( NAD-ADH)酶活性测定
血液酒精水平(BALs)的测定方法如Zapata等人25所述。
对于细胞裂解和去蛋白处理,将10μl全血样本和乙醇标准 品与40μl3.4%高氯酸混合,于4°C以2000转/分钟离心6 分钟。取7μl上清液,加入96孔板中的三复孔中。样品在 含有2.36μg/ml乙醇脱氢酶(ADH,Sigma‐Aldrich公 司,圣路易斯,密苏里州)和0.43mg/ml β‐NAD( Sigma‐Aldrich公司)的0.43MTris‐HCl缓冲液(pH 8.8)中,室温孵育40分钟。通过检测样品在340纳米处的 吸光度来测定β‐NADH的累积量。
定量实时PCR(qPCR)
使用miRNeasy微型试剂盒(凯杰,格曼敦,马萨诸塞州, 美国)按照制造商说明提取RNA。取总RNA(80ng/μl) 使用高容量cDNA反转录试剂盒(赛默飞世尔科技)进行 第一链cDNA合成。定量PCR采用SsoAdvanced通用 SYBRGreen超级混合液(伯乐实验室,赫克莱斯,加利 福尼亚州,美国)。参考基因选用Hp rt和Rp l13a。所有基 因的引物序列见表1。相对基因表达通过ΔΔ循环定量值 (Cq)方法计算。通过分析Th的表达来确定VTA组织富 集情况。样本排除标准为经格拉布斯检验识别出的ThCq 值离群值,该情况表明VTA解剖不准确。在96个样本中, 有2个因属于离群值而被排除。此外,由于部分样本的总 RNA耗尽,用于检测Wnt1mRNA水平的样本数量较少。
蛋白质印迹
组织在来自细胞信号技术公司(丹弗斯,马萨诸塞州)的50 μl RIPA缓冲液(150mM氯化钠、1.0%IGEPAL®CA‐630、0.5% 脱氧胆酸钠、0.1%十二烷基硫酸钠、50mM三羟甲基氨基甲 烷,pH8.0)中进行匀浆。RIPA缓冲液中添加了赛默飞世尔科 技的Halt™磷酸酶和蛋白酶抑制剂混合液。使用赛默飞世尔科技 的双辛可宁酸(BCA)蛋白测定法测定蛋白质浓度。等量的蛋白 质(20 μg)进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳( SDS‐PAGE)。使用赛默飞世尔科技的Novex™4%至12% Tris‐甘氨酸迷你凝胶、WedgeWell™格式、15孔进行蛋白质分 离,并将蛋白质转移至伯乐实验室的硝酸纤维素膜上。膜在含5 %(w/v)脱脂奶粉的Tris缓冲盐水(TBS,25mMTris‐HCl 和150mM氯化钠)中封闭后,于 4 2, 1 1000, 13497 1 _2157176 °C与
一抗孵育过夜(OTX:Proteintech#‐‐AP,RRID:AB;TH, 1:10,000,Millipore#MAB318,RRID:AB_2201528;以及
β‐肌动蛋白,1:10,000,圣克鲁兹生物技术公司,# sc‐47778,RRID:AB_626632)。然后将膜在室温下与偶联 红外(IR)染料的二抗孵育1小时(LI‐COR生物科学公司, 美国内布拉斯加州林肯市,IRDye680RD驴抗小鼠IgG,# 925‐68072,RRID:AB_2814912;IRDye800CW驴抗兔 IgG,#925‐32213,RRID:AB_2715510)。使用Odyssey Fc系统(LI‐COR生物科学公司)检测条带,并用Image StudioLite软件(LI‐COR生物科学公司)进行定量。每个 样品的蛋白质水平均以β‐肌动蛋白条带的平均密度为基准进 行归一化处理。TH条带信号极低或无法检测的样品被排除。
慢病毒生产
使用慢病毒载体pLL3.7产生表达靶向Otx2的短发夹R NA(shRNA)(shOtx2)或非靶向shRNA对照( shScr)的复制缺陷型慢病毒,该载体由U6启动子表达 shRNA,并由巨细胞病毒(CMV)启动子表达增强型绿 色荧光蛋白(GFP)。26 Otx2的23核苷酸靶向序列为5′‐ TTGCAAATGATTGATCAAATATA‐3′,对应于Otx2转录 本(Genbank编号NM_001286481.1)的第1549‐1571位。
立体定向手术
使用慢病毒载体(shScr为1 μl的4 × 107 pg/mlp24gag抗 原,shOtx2为3 × 107 pg/ml)双侧立体定向递送至腹侧 被盖区(vTA),操作步骤如前所述。26,27简而言之,8周 龄雄性和雌性C57BL/6J小鼠通过腹腔注射(IP)氯胺酮 和赛拉嗪(剂量分别为100和8mg/kg)进行麻醉,并固 定于立体定向定位仪(DavidKopf仪器公司,美国加利 福尼亚州图洪加)。双侧病毒注射的坐标为:前囟前后方 向−3.2mm,内侧/外侧±0.5mm,背侧/腹侧−4.7mm。
病毒以0.2μl/min的速度注射,注射后套管保留额外7分 钟以防止病毒回流。在

结果
乙醇摄入和血液酒精水平
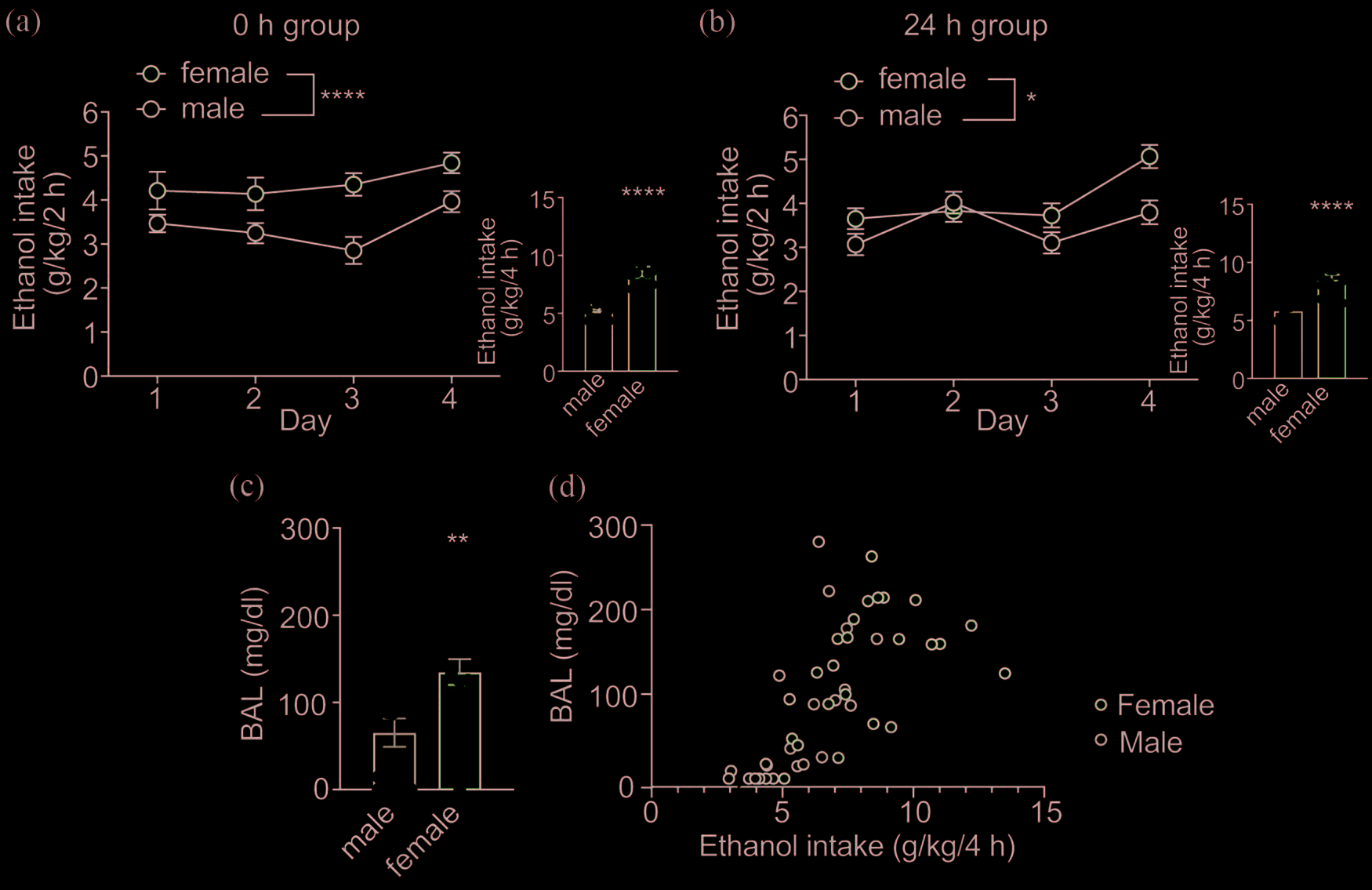
雄性和雌性小鼠接受了为期4天的间歇性饮酒程序(DID), 分别给予乙醇或水(对照),并在最后一次饮酒阶段结束后立 即(0小时组)或24小时后实施安乐死,随后分离腹侧被盖区 (vTA)用于RNA和蛋白质的检测。乙醇摄入量如图1所示。
在2小时饮酒阶段中,雌性小鼠的乙醇饮用量显著高于雄性小 鼠,这与我们之前的观察结果一致28 (图1a,0小时组:性别, F(1,45)= 20.72,P<.0001;时间,F(3,135)= 3.23,P=.024;交互作用,F(3,135)= 0.71,P=.55;图1b,24小时组: 性别,F(1,46)= 7.09,P=.011;时间,F(3,138)= 9.24,P <.0001;交互作用,F(3,138)= 3.29,P=.023)。在第四天 的4小时饮酒阶段中,雌性小鼠的乙醇摄入量也高于雄性小鼠 (0小时组:t(46)= 5.41,P<.0001;24小时组:t(46)= 5.24,P<.0001)。与雌性小鼠更高的乙醇饮用水平一致,其 血液酒精水平(BALs)也显著高于雄性小鼠(图1c,雄性: 65.3 ± 16.3mg/dl;雌性:135.0 ± 14.8mg/dl;t(45)= 3.16, P=.003)。在两种性别中,血液酒精水平均与4小时饮酒阶 段期间摄入的乙醇量呈显著正相关(图1d,雄性:R2= 0.476, P=.0002;雌性:R2= 0.214,P=.026)。这些结果表明,在 间歇性饮酒方案(DIDprotocol)中,雄性和雌性小鼠均摄 入了达到醉酒水平的乙醇。
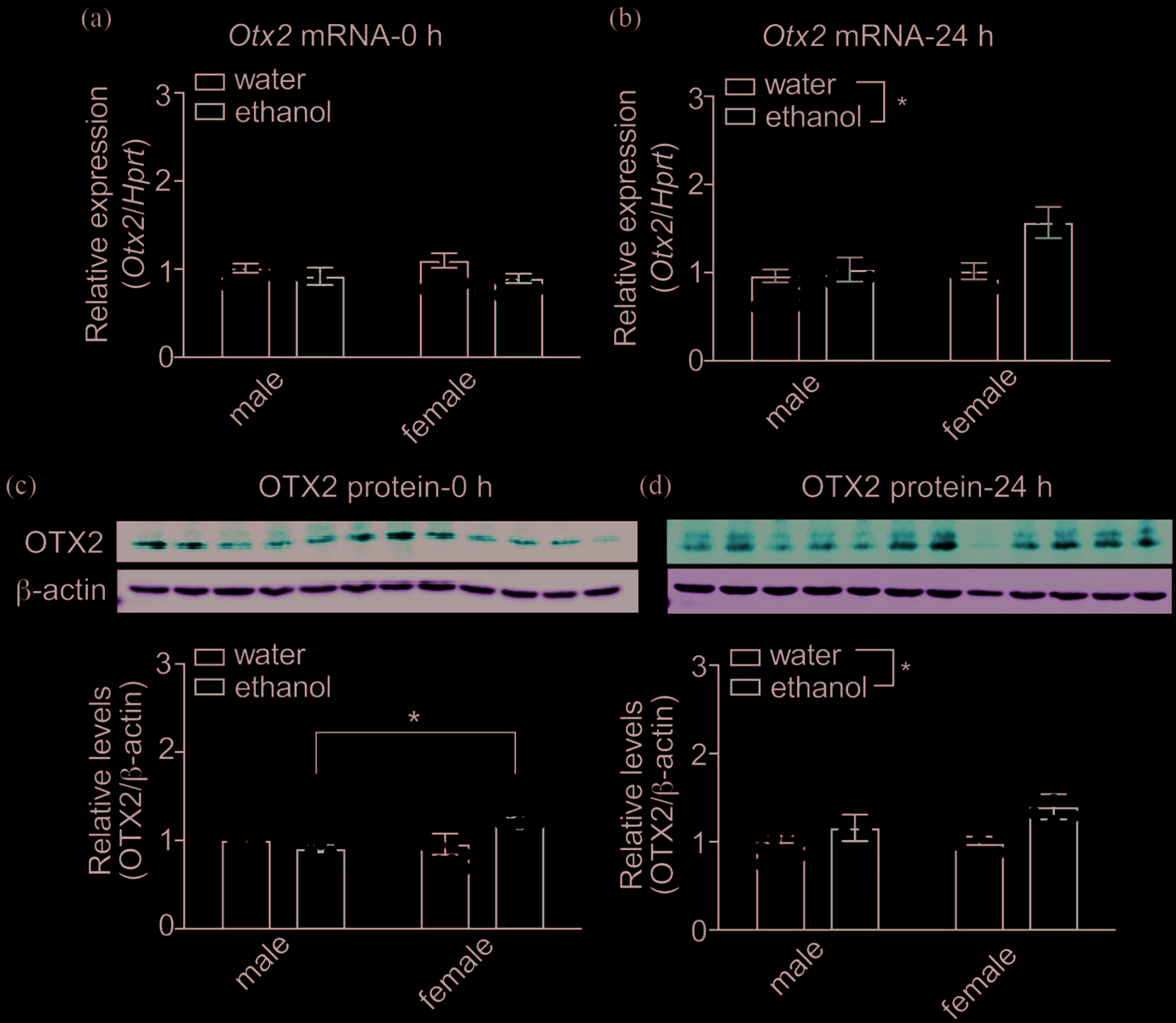
Otx2信使RNA和蛋白质水平在类似暴饮的乙醇 摄入后24小时在腹侧被盖区(vTA)升高
最后一次饮酒阶段结束后,与饮用水对照组相比,vTA中 Otx2mRNA水平在乙醇饮用后未发生显著变化(图2a, 水,每性别n= 9 ,乙醇,每性别n= 9 ;处理,F(1,32)= 3.93,P=.056;性别,F(1,32)= 0.19,P=.67;交互作用, F(1,32)= 0.59,P=.45)。然而,在第四次饮酒阶段24小 时后,乙醇饮用组vTA中的Otx2mRNA水平较对照组升 高(图2b,水,每性别n= 12 ,乙醇,雄性n= 12 ,雌性 n= 11 ;处理,F(1,43)= 6.35,P=.016;性别,F(1,43) = 5.64,P=.022;交互作用,F(1,43)= 3.76,P=.059)。
此外,vTA中Otx2的表达存在性别差异,雌性的Otx2水平 高于雄性。这似乎是由于饮用乙醇的雌性小鼠中Otx2增加 更为明显所致,尽管性别与乙醇的交互作用尚未达到统计 学显著性。
腹侧被盖区(vTA)中的OTX2蛋白质水平在饮酒阶段结束 后立即检测时,雌性乙醇组高于雄性乙醇组(图2c,雄性水组, n= 12,雄性乙醇组,n= 10,雌性水组,n= 11,雌性乙醇组, n= 11;处理,F(1,40)= 0.99,P=.327;性别,F(1,40)= 2.88, P=.097;交互作用,F(1,40)= 5.17,P=.029;事后Tukey检验, 雌性乙醇组对雄性乙醇组,P=.043)。在24小时后
在第四次饮酒阶段,与对照组相比,无论性别如何,饮用 乙醇组的OTX2蛋白质水平均较高(图2d,雄性水组n= 9, 雄性乙醇组n= 9,雌性水组n= 8,雌性乙醇组n= 8;处理, F(1,30)= 6.11,P=.019;性别,F(1,30)= 0.89,P=.35; 交互作用,F(1,30)= 1.27,P=.27)。综上所述,这些数 据表明,暴饮水平的乙醇摄入会导致小鼠腹侧被盖区( vTA)中Otx2转录本和Otx2蛋白水平升高,且这种升高 特异性地出现在乙醇饮用阶段结束后的24小时。
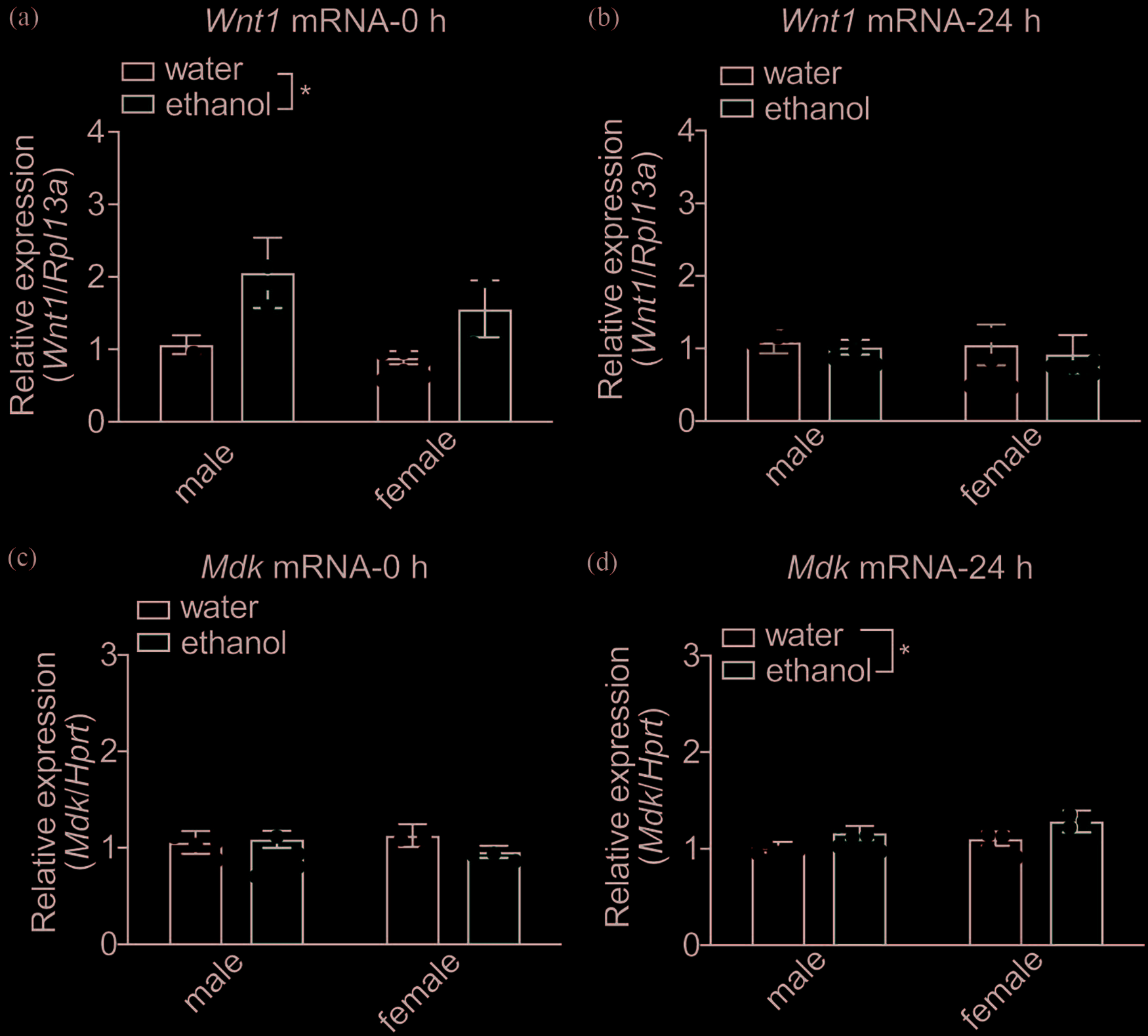
类似暴饮的乙醇饮用后腹侧被盖区(vTA)中 Wnt1和Mdk的表达增加
接下来,我们研究了OTX2的两个已知转录靶点Wnt1和 Sema3c的表达是否因暴饮式乙醇摄入水平而发生改变。
Sema3c的转录本水平在饮酒阶段结束后立即或24小时后均未 发生变化(数据未显示)。相反,Wnt1的转录本水平在饮酒 阶段结束后立即升高(图3a,雄性水组n= 8,雄性乙醇组 n= 7,雌性水组n= 8,雌性乙醇组n= 7;处理,F(1,26)= 7.63,P=.01;性别,F(1,26)= 1.26,P=.27;交互作用, F(1,26)= 0.28,P=.60),并在24小时后恢复至对照水平 (图3b,雄性水组n= 12,雄性乙醇组n= 11,雌性水组n = 10,雌性乙醇组n= 9;处理,F(1,38)= 0.24,P=.63;性 别,F(1,38)= 0.11,P=.74;交互作用,F(1,38)= 0.02,P=.89)。
因此,暴饮乙醇饮用导致在饮酒阶段结束后立即出现腹 侧被盖区(vTA)中Wnt1基因表达增加。
接下来,我们确定了类似暴饮的乙醇消耗是否会影响 腹侧被盖区(vTA)中Mdk基因的表达。MDK是一种对多 巴胺能神经元存活重要的神经营养因子29,30 ,我们先前已 证明Mdk参与乙醇饮用行为24 。值得注意的是,通过使用 JASPAR数据库31 ,我们发现Mdk基因的启动子在转录起 始位点上游2798至2791(TTAATCCA)和1063至1056 (GTAATCCT)碱基对处有两个OTX2的共识结合位点, 提示Mdk的表达可能受OTX2的转录调控。乙醇饮用在最 后一次饮酒阶段结束后立即检测时并未影响MdkmRNA水 平(图3c,雄性水组n= 9,雄性乙醇组n= 9,雌性水组 n= 9,雌性乙醇组n= 9;处理,F(1,32)= 0.48,P=.49; 性别,F(1,32)= 0.082,P=.78;交互作用,F(1,32)= 1.02,P=.32)。然而,24小时后,乙醇饮用组的 MdkmRNA水平较对照组升高(图3d,
雄性水组n= 12,雄性乙醇组n= 12,雌性水组n= 12,雌性乙 醇组n= 11;处理,F(1,43)= 4.14,P=.048;性别,F(1,43) = 1.68,P=.20;交互作用,F(1,43)= 0.037,P=.85)。
最后,我们检测了类似暴饮的乙醇饮用是否会改变腹 侧被盖区(vTA)中酪氨酸羟化酶(Th)的基因和蛋白质表 达,因为已有证据表明OTX2可以影响TH蛋白水平。14
Th基因表达在任一时间点乙醇饮用后均未发生变化(补充图1)。与mRNA结果一致,TH蛋白水平也未因乙醇消 耗而发生改变(补充图1)。这些结果表明,暴饮水平的 乙醇摄入(至少持续4天)不会显著影响Th基因和蛋白质 水平。
降低Otx2表达对小鼠腹侧被盖区类似暴饮的 乙醇饮用无影响
由于乙醇饮用后小鼠腹侧被盖区(vTA)中的Otx2蛋白增 加,我们接下来确定了vTA中Otx2是否
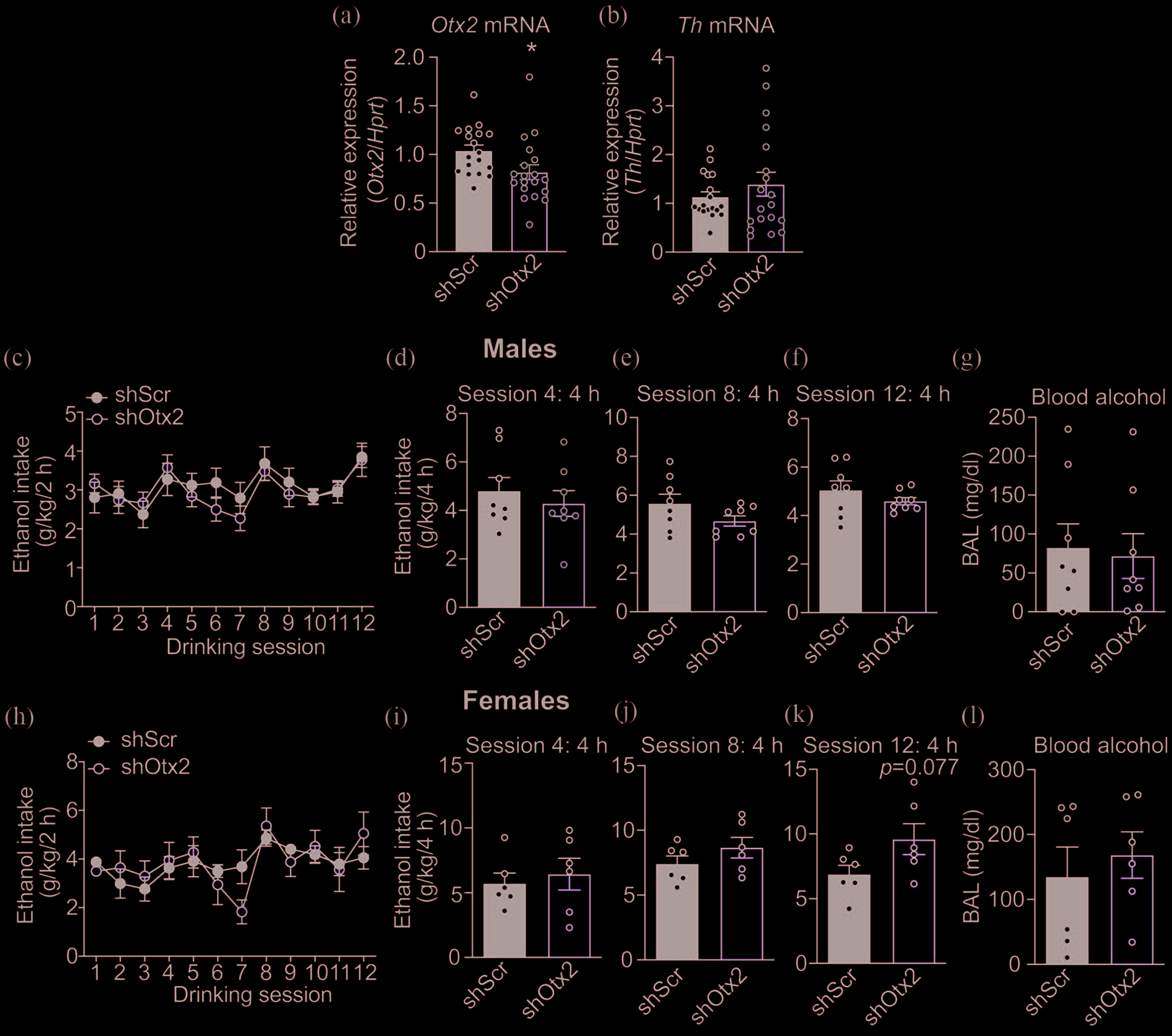
腹侧被盖区(vTA)可能在乙醇摄入中发挥作用。为此, 我们使用慢病毒载体通过RNA干扰降低vTA中Otx2的水 平。将表达靶向Otx2的短发夹RNA(shOtx2)或对照非 靶向shRNA(shScr)以及作为转导细胞报告基因的绿色 荧光蛋白(GFP)的慢病毒微量注射到小鼠的vTA中。我 们在注射后3周测量了小鼠Otx2转录本的水平,以确定 shOtx2是否降低了vTA中Otx2的表达。从脑切片中分离 出转导的vTA区域,提取RNA,并通过定量PCR分析 cDNA中的Otx2mRNA水平。与表达shScr的小鼠相比, vTA中表达shOtx2导致Otx2转录本水平下降~20%(图 4a,雌性shScr组,n= 9,雌性shOtx2组,n= 10,雄性 shScr组,n= 9,雄性shOtx2组,n= 9,t(35)= 2.31,P=.027)。在同一组样本中,shOtx2对ThmRNA水平无显 著影响(图4b,t(35)= 0.96,P=.342)。
接下来,小鼠在VTA注射表达shOtx2或shScr的慢病毒, 并在手术后3周通过间歇性饮酒方案检测乙醇摄入。实验期 间消耗的乙醇
2小时饮酒阶段在表达shOtx2和shScr的小鼠之间没有差异(图 4c,雄性shScr,n= 8,雄性shOtx2,n= 8;shRNA,F(1, 162)= 0.95,P=.33;饮酒阶段,F(11,162)= 2.88,P=.0018; 交互作用,F(11,162)= 0.51,P=.83;图4h,雌性shScr,n= 6, 雌性shOtx2,n= 6;shRNA,F(1,116)= 0.003,P=.96;饮酒 阶段,F(11,116)= 2.51,P=.007;交互作用,F(11,116)= 0.71, P=.72)。我们还测量了每周第四次饮酒阶段持续4小时的乙醇 摄入量。与2小时饮酒阶段类似,表达shScr或shOtx2的小鼠在 乙醇消耗量上无显著差异(图4d–f,雄性,第4次饮酒阶段, t(14)= 0.67,P=.51;第8次饮酒阶段,t(14)= 1.63,P=.13;第 12次饮酒阶段,t(14)= 1.09,P=.29;图4i–k,雌性,第4次饮 酒阶段,t(10)= 0.49,P=.63;第8次饮酒阶段,t(10)= 1.26, P=.24;第12次饮酒阶段,t(10)= 1.97,P=.077)。最后,在 第12天4小时饮酒阶段结束后立即测量血液酒精水平,表达 shScr和shOtx2的小鼠之间的血液酒精水平没有差异(图4g, 雄性,t(14)= 0.26,P=.80;图4l,雌性,t(10)= 0.57,P=.58)。
综上所述,这些结果表明降低Otx2
降低Otx2表达在腹侧被盖区(vTA)不影 响蔗糖消耗
尽管减少腹侧被盖区(vTA)中的Otx2并未改变小鼠的乙醇 饮用行为,但我们测试了这是否会影响蔗糖摄入量,因为已 有研究提示vTA中的Otx2与快感缺失有关。用于乙醇饮用测 试的同一批小鼠在完成乙醇饮用测试3天后,接受了为期4天 的2%蔗糖溶液摄入测试。在每天2小时的测试阶段中,表达 shScr和shOtx2的小鼠之间对蔗糖溶液的消耗量没有显著差 异(图5a,雄性,shRNA,F(1,56)= 0.47,P=.50;天数, F(3,56)= 4.82,P=.0047;交互作用,F(3,56)= 0.09,P=.97;
图5c,雌性,F(1,40)= 0.39,P=.54,天,F(3,40)= 3.81, P=.017;交互作用,F(3,40)= 0.31,P=.82)。在第4天的 4小时阶段中,蔗糖摄入也未见差异(图5b,雄性,t(14)= 0.08,P=.94;图5d,雌性,t(10)= 0.89,P=.39)。
最后,在完成蔗糖饮用测试后,我们通过免疫组织化学 方法检测了vTA中的病毒转导情况,并使用酪氨酸羟化酶抗体、绿色荧光蛋白和OTX2抗体测量了OTX2蛋白质水平(图 5e–h)。在注射表达shScr和shOtx2慢病毒的小鼠中,病毒 扩散范围在前后方向上为~0.33mm,表明两组间vTA区域的 病毒转导程度相当。此外,与shScr组相比,shOtx2组中 GFP阳性细胞的OTX2蛋白水平降低了66%(图5h,shScr组 n= 9只小鼠,shOtx2组n= 10只小鼠,t(17)= 4.2,P=.0006)。酪氨酸羟化酶(TH)方面无显著差异
讨论
在这里,我们发现类似暴饮的乙醇饮用会增加成年小鼠腹 侧被盖区(vTA)中Otx2mRNA和Otx2蛋白、Wnt1 mRNA以及MdkmRNA的水平。本研究的一个有趣发现 是,尽管雌性小鼠的乙醇摄入量高于雄性,但类似暴饮的 乙醇饮用所诱导的许多转录和蛋白质变化在雄性和雌性中 均出现。这表明,一定阈值剂量的酒精可诱导vTA中的转 录变化,且这种变化与性别无关(至少在我们检测的基因 范围内)。尽管先前的研究发现胚胎发育期间的乙醇暴露 会影响大脑中Otx2的基因表达,但成年小鼠在类似暴饮饮 酒后vTA中Otx2表达的变化此前尚未被研究。我们在乙醇 饮用阶段结束24小时后观察到OTX2蛋白水平升高,提示 乙醇饮用后vTA中OTX2靶基因的转录也可能发生改变。
我们首先测量了乙醇饮用后vTA中已知的OTX2靶基 因Wnt1和Sema3c的表达。选择这些基因是因为Peña等人17 发现,在雄性小鼠出生后第10至20天经历母体分离应激会 导致vTA中Sema3c和Wnt1基因启动子上的OTX2结合减少, 且其表达降低,这表明这些基因的转录活性受OTX2调控。
我们发现,乙醇饮用后Sema3cmRNA水平未发生变化。然 而,在第四次饮酒阶段结束后立即检测,饮用乙醇的小鼠 vTA中Wnt1转录本水平升高。Wnt1水平在第四次饮酒阶段 结束24小时后恢复至正常水平。这些数据表明,在暴饮阶 段vTA中的Wnt1表达被短暂诱导,可能由此导致WNT1蛋白增加。在第四次饮酒阶段结束后立即检测,OTX2蛋白 水平并未升高,表明在此时间点OTX2可能并不参与乙醇 诱导的Wnt1mRNA水平上升。相反,有可能是WNT1促进 了乙醇饮用24小时后观察到的vTA中OTX2的增加,因为 已有证据显示WNT1对Otx2的表达存在相互调控。32 β‐ catenin是WNT信号通路的下游介质,可结合到Otx2的启 动子区域并调节其表达,32而我们发现Otx2
转录本在24小时时升高。要直接验证这一假设,需要进行 实验来测量乙醇饮用后WNT1蛋白水平以及β‐catenin在 Otx2启动子上的结合情况,并通过操控WNT1的表达来确 立其在乙醇诱导的Otx2变化中的因果作用。有趣的是,已 有研究发现慢性酒精暴露会抑制肝脏中的WNT1/β‐ catenin信号通路,34但在酒精使用障碍背景下,成年大 脑中的WNT1信号尚未得到研究。这将是未来研究的一个 极佳方向。
我们还发现,在乙醇饮用阶段结束24小时后,腹侧被 盖区(vTA)中MdkmRNA水平升高。我们团队先前的 研究表明,体外单次乙醇暴露可导致人神经母细胞瘤细胞 系中MDK表达增加35 ,并且小鼠Mdk在防止过度乙醇饮 用方面发挥作用,因为与对照小鼠相比,Mdk基因敲除小 鼠以及在腹侧被盖区(vTA)表达Mdk短发夹RNA的小 鼠乙醇摄入量更高24 。我们探讨了Mdk是否可能是 OTX2调控的基因,因为Mdk和Otx2均对多巴胺神经元的 发育至关重要10-14,21,29,30。通过计算机模拟分析,我们在 Mdk基因的启动子区域发现了预测的OTX2结合位点,因 此乙醇饮用后24小时观察到的Otx2蛋白表达增加可能促 进了此时Mdk转录本的增加。确定OTX2是否直接与 Mdk启动子结合将非常重要。如果确实如此,这些数据表 明Mdk是腹侧被盖区(vTA)中一个新的乙醇响应性 OTX2靶基因。
因为已有研究显示,在vTA中降低Mdk会增加乙醇摄 入量,24我们决定检验降低Otx2水平是否同样会导致乙醇 消耗增加的假设。在小鼠的vTA中降低Otx2并未影响乙醇 或蔗糖的摄入。对此结果的一种简单解释是,vTA中 OTX2蛋白的减少程度不足以引起行为变化。通过qPCR检 测发现,在病毒注射3周后,Otx2转录本水平仅降低了20 %。此外,我们也没有检测shOtx2对Mdk基因表达的影响。
然而,我们在行为测试结束后,对vTA中被病毒感染的单 个细胞进行了OTX2免疫反应性的定量分析,发现OTX2蛋 白减少了66%,表明shOtx2是有效的。另一种可能是病 毒转导未覆盖vTA足够大的区域从而产生效应,尽管我们 曾使用该慢病毒载体在vTA中敲低其他基因的表达,并观 察到对饮酒行为的双向影响。24,26,36通过IHC还发现vTA 中其他非多巴胺能细胞也存在OTX2蛋白,而本研究所使 用的慢病毒理论上可转导所有细胞。如果OTX2在vTA不 同细胞类型中的功能具有相反的作用,则可能需要在特定 细胞类型中敲低Otx2才能揭示其对乙醇饮用表型的影响。
在vTA中敲低Otx2也可能引发代偿性变化,从而阻止了酒 精和蔗糖饮用行为的改变。
另一种可能性是,降低OTX2水平可能使小鼠更容易 出现类似暴饮的行为,但需要另一个环境干扰(例如应激 源)来显现出对酒精摄入的显著影响。例如,在幼年小鼠 vTA中降低Otx2会使它们在成年期更容易产生应激诱导的 抑郁样行为。17另一个相关问题是,在成年vTA中干扰 OTX2可能无效,因为OTX2的活性可能仅在特定发育窗口 17或关键期才需要,这与OTX2在视觉系统关键期可塑性 中的已知作用一致。37,38最后,也有可能是vTA中的 OTX2并不参与乙醇摄入的调控。Otx2在中枢神经系统的 某些区域表达,可能通过在这些区域的转录活性参与类似 暴饮的乙醇饮用。例如,Otx2在内侧缰核中高表达,并调 控缰核‐脚间核环路39的发育,该环路参与奖赏与厌恶40 。
Otx2也在脉络丛中强烈表达。41 OTX2蛋白由脉络丛室管 膜细胞分泌进入脑脊液,并通过与周围神经网结合被皮层 表达小清蛋白的中间神经元摄取41,42 ,从而以非细胞自主 方式调节转录。皮层中的OTX2活性也可能影响类似暴饮 的饮酒行为。未来的研究应探索OTX2可能发挥作用的其 他脑区,以调控暴饮及其他与酒精使用障碍相关的行为。
作者贡献
两位作者共同设计了实验,CC进行了实验,两位作者共 同撰写了论文稿。
ORCIDiD
卡桑德·科尔斯https://orcid.org/0000‐0002‐9379‐6209艾米· W·拉塞克https://orcid.org/0000‐0002‐7099‐2442
补充材料
本文的补充材料可在线获取。




















 1220
1220

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








