不应期(Refractory Period):核心机制、分类与科研应用全解析
不应期是动作电位产生后,神经元(或可兴奋细胞)在一段时间内对新刺激的反应能力下降或丧失的生理现象,本质是电压门控离子通道(尤其是Na⁺通道)的状态转换(失活→恢复)导致的兴奋性暂时改变。这一特性直接限制神经元的动作电位发放频率、调控神经回路信号传递,也是经颅电刺激(tES)、深部脑刺激(DBS)等技术参数设计的关键依据,与视皮层电刺激、轴突模型研究高度相关。
一、核心定义与分类(按兴奋性恢复程度划分)
根据神经元对刺激的响应能力,不应期分为绝对不应期和相对不应期,两者衔接出现,总时长约1~5毫秒(ms),具体时长因神经元类型(如视皮层锥体神经元、中间神经元)、轴突特性(髓鞘化程度)而异。
| 类型 | 时间范围(动作电位后) | 核心生理机制 | 对刺激的反应 | 关键通道状态 |
|---|---|---|---|---|
| 绝对不应期(Absolute Refractory Period, ARP) | 0.5~2 ms(去极化峰值→复极化中期) | 电压门控Na⁺通道完全失活(无法被激活),即使强刺激也无法触发新的动作电位 | 完全无反应(无论刺激强度多大,均不产生动作电位) | Na⁺通道:失活态( inactivation gate 关闭);K⁺通道:激活态(持续开放) |
| 相对不应期(Relative Refractory Period, RRP) | 2~5 ms(复极化中期→超极化结束) | Na⁺通道逐渐从失活态恢复为静息态(可被激活),但膜电位处于超极化状态(比静息电位更负),需更强刺激才能达到阈电位 | 仅对超阈值刺激(强度远超阈电位)有反应,动作电位振幅可能略低、时程略长 | Na⁺通道:部分恢复为静息态;K⁺通道:逐渐关闭(仍有少量K⁺外流);膜电位:-75~-80 mV(超极化) |
补充:超常期(Supranormal Period)
部分神经元在相对不应期后会出现短暂的“超常期”(约5~10 ms),此时膜电位接近阈电位,低于阈电位的弱刺激即可触发动作电位(兴奋性高于静息状态),随后恢复正常兴奋性。这一现象在视皮层神经元的高频信号传递中可能起到微调作用,但实际应用中(如tES参数设计)影响较小。
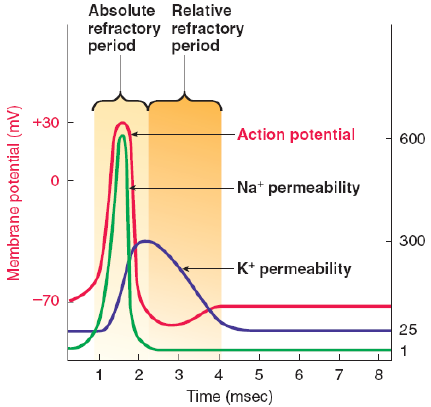
二、核心机制:离子通道的状态转换
不应期的本质是电压门控Na⁺通道的“失活-恢复”周期,结合动作电位的离子机制可清晰理解:
- 动作电位去极化阶段:Na⁺通道快速激活(开放),Na⁺内流导致膜电位飙升;
- 去极化峰值后:Na⁺通道迅速进入失活态( inactivation gate 关闭,与“关闭态”不同——失活态需等待膜电位复极化才能恢复,关闭态可直接被刺激激活);
- 复极化阶段:K⁺通道持续开放,K⁺外流使膜电位回落,此时Na⁺通道保持失活态(绝对不应期);
- 超极化阶段:K⁺通道逐渐关闭,膜电位从超极化回归静息电位,Na⁺通道逐步从失活态恢复为静息态(相对不应期);
- 恢复后:Na⁺通道完全恢复静息态,神经元可被正常阈刺激触发动作电位。
关键结论:Na⁺通道的失活态持续时间决定绝对不应期长度,Na⁺通道的恢复速度和超极化程度决定相对不应期长度。
三、影响不应期的关键因素(适配科研与仿真参数)
1. 神经元/轴突类型
- 视皮层锥体神经元(投射神经元):绝对不应期约1~2 ms,相对不应期约2~3 ms,总时长3~5 ms(适合中等频率信号传递,发放频率上限约200 Hz);
- 视皮层中间神经元(抑制性神经元):绝对不应期短(0.5~1 ms),相对不应期约1~2 ms,总时长1.5~3 ms(发放频率上限可达500~1000 Hz,参与高频神经回路调控);
- 髓鞘化轴突:不应期略短于无髓鞘轴突(髓鞘加速膜电位复极化,促进Na⁺通道恢复)。
2. 环境与生理条件
- 温度:体温升高(如37℃→40℃)加速Na⁺通道恢复,不应期缩短(每升高10℃,不应期约缩短30%);低温(如25℃)则延长不应期(仿真时需固定37℃人体标准温度);
- 离子浓度:细胞外Na⁺浓度升高→Na⁺通道恢复速度加快→不应期缩短;细胞外K⁺浓度升高→静息电位去极化→相对不应期缩短(神经元兴奋性升高);
- pH值:酸性环境(pH<7.0)抑制Na⁺通道恢复→不应期延长;碱性环境(pH>7.8)加速恢复→不应期缩短。
3. 药物/神经调控干预
- 钠通道阻滞剂(如河豚毒素TTX):延长绝对不应期(甚至完全阻断Na⁺通道,消除动作电位);
- 阳极tES:使膜电位去极化,缩短相对不应期(神经元兴奋性升高);
- 阴极tES:使膜电位超极化,延长相对不应期(神经元兴奋性降低)。
四、在神经科学+电刺激研究中的核心应用
1. tES/DBS参数设计的核心约束
不应期直接限制神经元的最大发放频率(理论上限=1/绝对不应期,如绝对不应期1 ms→最大频率1000 Hz,但实际生理条件下因能量限制,视皮层神经元最大发放频率约200~500 Hz),因此tES参数设计需遵循:
- 低频tES(<10 Hz,如tDCS):刺激间隔(100 ms)远长于不应期(3~5 ms),神经元有足够时间恢复兴奋性,可有效触发动作电位;
- 中频tES(10~100 Hz,如tACS):刺激间隔(10~100 ms)接近不应期,需精准控制刺激强度(避免叠加在绝对不应期),否则会导致动作电位“阻滞”;
- 高频tES(>100 Hz,如rTMS):刺激间隔(<10 ms)短于不应期,神经元无法及时恢复,会被“抑制”(无法产生动作电位),适用于调控过度兴奋的神经回路(如癫痫)。
2. 视觉皮层信息编码的调控
视皮层神经元通过动作电位的发放频率编码视觉信息(如强光→高频发放,弱光→低频发放),不应期是频率编码的“天然限制器”:
- 中央视野对应的V1区神经元:不应期较短(约3 ms),最大发放频率约300 Hz,可编码精细视觉信息(如高空间频率光栅);
- 周边视野对应的V1区神经元:不应期较长(约5 ms),最大发放频率约200 Hz,编码粗略视觉信息(如运动方向);
- 研究启示:通过VEP记录群体神经元的发放同步性(如P100波的时程),可间接评估不应期长度——P100波宽增加可能提示不应期延长(如tES抑制后)。
3. 轴突区室模型的关键参数
构建视皮层轴突模型时,需将不应期参数融入离子通道动力学,确保仿真结果贴近生理实际:
- Hodgkin-Huxley(HH)模型:通过设置Na⁺通道的失活时间常数(τₕ)模拟绝对不应期(τₕ≈1 ms),复极化时间常数模拟相对不应期;
- LIF模型(简化模型):直接设置“不应期参数”(如refractory_period=3 ms),期间神经元不响应任何刺激;
- 髓鞘化轴突模型:郎飞氏结处Na⁺通道密度高,恢复速度快,不应期短于结间段,需分区设置不应期参数(如郎飞氏结不应期1 ms,结间段2 ms)。
4. 神经损伤与修复研究
- 视皮层轴突损伤(如髓鞘脱落):Na⁺通道分布紊乱→不应期延长→动作电位发放频率降低→VEP的P100振幅降低、潜伏期延长;
- 干预评估:通过tES促进髓鞘再生后,可测量不应期缩短(如从5 ms→3 ms),同步观察VEP参数恢复,量化修复效果。
五、研究技术与测量方法
1. 实验测量技术
- 膜片钳(Patch Clamp):金标准,直接记录单个神经元的动作电位,测量绝对/相对不应期(如给予系列刺激,记录能触发动作电位的最小刺激强度及时程);
- 多电极阵列(MEA):同时记录多个神经元的不应期,分析神经回路中神经元的不应期同步性;
- VEP(视觉诱发电位):间接评估群体神经元的不应期——通过改变刺激频率(如1~100 Hz闪光刺激),记录VEP振幅变化(当刺激频率超过神经元最大发放频率时,振幅显著下降,对应不应期约束)。
2. 仿真模型中的参数设置示例
- 视皮层锥体神经元(HH模型):Na⁺通道失活时间常数τₕ=1 ms(绝对不应期1 ms),K⁺通道关闭时间常数τₖ=2 ms(相对不应期2 ms);
- 髓鞘化轴突区室模型:郎飞氏结区不应期=1 ms,结旁段(FLUT)=1.5 ms,结间段(STIN)=2 ms。
六、总结
不应期是神经元的核心生理特性,由Na⁺通道的失活-恢复周期决定,分为绝对不应期(完全无反应)和相对不应期(仅对强刺激反应),总时长3~5 ms(视皮层神经元)。其核心价值在于:
- 限制神经元最大发放频率,避免过度兴奋;
- 调控神经回路信号传递的时序(如视觉信息的快速编码);
- 为tES/DBS参数设计提供关键约束(如频率、强度);
- 作为神经损伤/修复的量化指标(如髓鞘损伤→不应期延长)。






















 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?










