微藻在北欧气候下利用源分离人尿进行户外中试规模培养
摘要
人尿仅占城市污水人均产生量(150–200升/天)中的1–1.5升/天,却贡献了约80%的氮和50%的磷。因此,研究者对尿液的源分离以及探索从中回收营养物质的方法产生了兴趣。本研究旨在利用源分离人尿中的营养物质,在北欧气候条件下进行户外微藻培养。一种淡水绿藻尖刺栅藻(Scenedesmus acuminatus)在半连续运行的户外跑道池中培养,液体体积为2000升,水力停留时间为15天,培养所用源分离人尿的稀释比例分别为1:20和1:15。即使在低至5°C的培养温度下,微藻仍可去除52%的氮和38%的磷,并达到0.34克VSS/升的生物量密度。收获的微藻生物质可用于生产甲烷,产率为285升CH4/千克挥发性固体。
引言
市政污水(Maurer et al., 2005)越来越多地在集中式废水处理单元中进行处理,即一个或一组城市共用一个单一的处理单元(Maurer et al., 2005)。下水道通过长距离管道输送大量稀释的废水,涉及大量的挖掘工程以及泵送所需的能源——对于集中式污水处理系统,约80%至90%的资本成本与收集系统相关,且在人口稠密地区可能实现规模经济(Maurer et al., 2005)。另一方面,分散式处理系统可定义为在废水产生源头附近进行收集、处理、排放和回用的处理单元(Maurer et al., 2005)。配置有大型集群子系统(人口 > 2000)的分散式处理系统据估计比集中式污水处理系统(人口约30,000)更经济,运行和维护要求较低,但资本成本较高(Jung et al., 2018)。
生活污水中约80%的氮、50%的磷和90%的钾来自人尿,具体比例取决于饮食和生活方式、洗涤剂使用等(Chang 等人,2013)。然而,每人每天产生的尿液量仅为1–1.5升(Chang 等人,2013),而总废水排放量可能高达150–250升/天。除大量氮、磷和钾外,人尿还含有硼、铜、锌、钼、铁、钴和锰等微量元素。在传统集中式废水处理系统中,氮和磷仅能部分以可再利用的形式回收。尿液分离厕所的发展使得尿液可以被单独分离用于养分回收,而非排入集中式废水处理厂(亚当松,2000;伊戈斯等人,2017)。
已研究多种方法从源分离尿液中回收营养物质,例如鸟粪石沉淀(Wilsenach et al., 2007)、离子交换(Lind et al., 2000)和氨吹脱(Başakçilardan-Kabakci etal., 2007)。然而,鸟粪石沉淀中的氮回收率较低,且需要额外添加镁;氨吹脱则需要消耗额外能源。若将微藻培养于尿液中,可能提供一种经济且环境可持续的营养物质回收方式,因为生长中的微藻细胞可利用这些营养物质(Feng and Wu, 2006)。小球藻物种,例如,已被报道可吸收高浓度的氮和磷(NH3-N = 273 mg/L,总磷 = 58.75 mg/L)(Kim et al., 2015)。崔和李,2015曾报道,小球藻可在不同培养基中生长,其氮磷比变化范围广泛,为5–30。阿佐夫和戈德曼,1982指出,当游离氨达到20 mg/L时,小球藻的光合速率会降低至其最大速率的50%。因此,有必要对人尿进行稀释,以降低高浓度氨对微藻生长的毒性影响。此前已研究过不同微藻在稀释人尿中的生长情况,包括蓝细菌Spirulina platensis(冯和吴,2006)以及微藻小球藻(贾蒂宁等人,2016)、索科绿球藻(团特等人,2014)和尖刺栅藻(亚当松,2000)。小球藻据报道可在添加了乙二胺四乙酸(EDTA)和铁的0.5%稀释尿液中生长,最高生物量密度可达约133 mg/L干重(亚当松,2000)。然而,目前尚无关于在北欧气候条件下,利用从23小时到1小时不等的日照长度及室外温度范围从到30 °C的大规模户外培养小球藻或其他微藻的研究报道。
在人尿中大规模培养微藻将为养分提供一个汇。最终,为了闭合养分循环,需要设想微藻生物质的适当最终用途。将微藻用作生物燃料、营养保健品(药品级营养素)或高价值化学品正受到越来越多的关注(综述和讨论见,Kim etal., 2016;Passos et al., 2014)。虽然大多数从微藻生产生物燃料的过程需要昂贵的干燥、提取和燃料转化步骤,但在厌氧消化(AD)中,天然菌群中的微生物能够将藻类生物质中的有机物分解为简单的单体,进而转化为沼气(Abdelaziz etal., 2013)。除了产生的沼气外,底物中的营养物质保留在厌氧消化残余物中,可进一步精炼为肥料或回用于藻类培养(Kinnunen et al., 2014)。对于以小球藻为主的生物质,主要在不同合成培养基或废水中培养,测得的生物甲烷潜力(BMP)在107至410升CH4 kg−1挥发性固体之间变化,且BMP据报会因生长培养基的不同而变化(Frigon et al., 2013;Kinnunen 和 Rintala,2016;Roberts et al., 2016;Zhen et al., 2016)。
芬兰坦佩雷市正在海达兰塔建设一个新城区,该城区将作为一个实验性生活实验室,并促进循环经济的发展。在海达兰塔,城市将推进去中心化等策略,重点在于从该地区产生的废水中就地回收资源。本研究探讨了在海达兰塔的中试规模户外跑道池中,利用源头分离并水解(储存数月以杀灭病原体,同时尿素发生水解)的人尿培养微藻尖刺栅藻的可行性。研究确定了实验室规模和中试规模下人尿稀释以满足藻类生长的需求。此外,还测试了从中试规模跑道池收获的微藻生物质的生化产甲烷潜力。据我们所知,此前尚未有在北欧气候条件下利用中试规模户外跑道池处理真实人尿进行微藻培养的报道。
材料与方法
尖刺栅藻的实验室培养
尖刺栅藻(SAG 38.81)购自德国哥廷根大学的藻类培养保藏中心(SAG)。原始培养物在持续荧光照射 40μmol 光子/m².s¹ 条件下,于700 mL改良N8培养基中培养,其成分为(每升):0.5055 g KNO₃;0.74 g KH₂PO₄;0.2598 g Na₂HPO₄;0.05 g MgSO₄ ×7H₂O;0.0175 g CaCl₂ ×2H₂O;0.0115 g FeNaEDTA×3H₂O;0.0032 g ZnSO₄ ×7H₂O;0.013 g MnCl₂ ×4H₂O;0.0183 g CuSO₄ ×5H₂O 和 0.007 g Al₂(SO₄)₃ ×18H₂O,pH值为8.5。培养基持续以0.2升/分钟的流速通入含5% CO₂的空气。初始光密度(OD660)为0.5。当OD660达到5.5–5.8(生长饱和)时,取用蒸馏水洗涤后的5毫升细胞接种至700毫升新鲜培养基中,并将饱和培养物最终置于8°C避光保存(用于后续研究作为接种物)。
源分离尿液的收集与储存
源分离尿液(后文简称为尿液)来自海达兰塔(芬兰坦佩雷)的实验性文化与会议中心,通过使用分流式干厕收集,使用者为该中心的访客。尿液被收集到1000 L的塑料储罐中,并在环境温度(5–20°C)下储存至少6个月,以杀灭病原体并水解尿素。储存后的尿液组成(为池塘运行期间所采集不同样品的平均值)如表1所示。
筛选不同稀释度尿液作为培养基
用作S. acuminatus培养基的源分离尿液(表1)用自来水稀释,得到以下稀释度:0×、2×、3×、4×、5×、10×、15×、20×和25×。其中2×稀释度表示自来水中含50%(v/v)尿液,25×表示含4%尿液。在250毫升锥形瓶中,每个稀释度下取100毫升培养基,接种5毫升S. acuminatus储备培养物,设两个重复。培养在25 °C、150转/分钟、白色荧光灯连续光照强度为40μmol/m².s¹条件下进行七天。每天测定OD660以监测S. acuminatus的生长情况。
跑道池中微藻的培养
两个用于在人尿上培养微藻的跑道池(RwP)位于芬兰坦佩雷海达兰塔的人尿收集点附近的一个温室内(图 S1)。小型跑道池(SRwP;长:宽:深 3米:0.5米:0.4米)和大型跑道池(BRwP;长:宽:深 7米:1米:0.6米)的液体体积分别约为400 L和2000 L。这些池子由砾石建造,并衬有1.5 mm厚的高密度聚乙烯膜。为了保持液体流速恒定,池中安装了桨轮(转速为10 转/分钟),由0.5 马力齿轮电机(Regal Beloit,马拉松电机,美国)驱动。
SRwP用10升在改良N8培养基中培养的S. acuminatus(光密度约660 为0.5)接种,并采用分批操作方式,使用 20×稀释的尿液。10天后,将约350升培养物(光密度 660 为0.75)作为接种物用于BRwP,BRwP中加入 20×稀释的尿液,使总体积达到2000升。剩余的SRwP培养物(50升)用作分批操作的接种物。
表1 尿液(五个样品)在环境温度下储存至少6个月后的平均组成(和标准偏差)。
| 参数 | 范围 |
|---|---|
| pH | 8.8 ± 0.0 |
| COD(毫克/升) | 5500 ± 200 |
| Ntot(毫克/升) | 3480 ± 130 |
| NH₄⁺‐N (毫克/升) | 1800 ± 750 |
| Ptot(毫克/升) | 190 ± 52 |
| 钠 (毫克/升) | 690 ± 30 |
| 钾 (毫克/升) | 600 ± 38 |
| 镁 (毫克/升) | 2.3 ± 0.4 |
| 钙 (mg/L) | 14 ± 5 |
COD — 化学需氧量。
在较小的池塘中进行操作,该池塘用于研究S. acuminatus在 20×尿液中的最大生长情况,同时也作为培养储备池。通过每周添加淡水(约10升)以补偿蒸发损失,从而保持SRwP中培养基液位恒定。
前15天采用分批模式运行后,BRwP以15天的水力停留时间(HRT)和 20×稀释倍数的尿液进行半连续模式运行28天,之后将尿液稀释倍数调整为 15×。第79天后,BRwP转为分批操作,至第148天因温度和光照强度下降而停止池体运行。
BRwP每周投喂两次,每次移除500 L培养液,并补充 20×(25 L尿液和475 L自来水)或 15×(33 L尿液和467 L水)稀释的尿液。每次投喂时采集两个样品,分别在投喂前和投喂后15分钟采集。每次投喂前,将500 L微藻培养物收集到一个配有尼龙滤布(孔径 < 10μm)的排水坑中。从滤布上回收微藻生物质,并采集过滤水的混合样品(500 mL)。收获的生物质在20°C条件下以4000转/分钟离心2分钟。沉淀的藻类颗粒用去离子水洗涤,再次离心(2分钟,4000转/分钟,20°C),然后或使用德国CHRIST公司Alpha 1–4 LD型冷冻干燥机冷冻干燥至少17小时,或原样保存于 −20 °C。
甲烷产气潜力
收获的生物质的甲烷产气潜力通过119 mL玻璃血清瓶进行三组平行批次试验测定。甲烷产率测定使用在BRwP不同生长阶段采集的生物质,分别为 20×稀释阶段(健康细胞生长,第25天)、 15×稀释起始阶段(细胞死亡,第32天)、 15×稀释稳定阶段(冷冻干燥,第53天并原样保存至第79天)。试验所用接种物为处理市政污水处理厂污泥的中温厌氧消化器产生的消化液(芬兰坦佩雷维尼卡宁拉赫蒂)。向瓶中加入30 mL接种物和微藻生物质作为底物,底物与接种物的挥发性固体(VS)比例为1:1(挥发性固体,VS)。加入蒸馏水使总液体体积达到60 mL,并添加4 g/L NaHCO₃作为缓冲剂。以仅含接种物、蒸馏水和缓冲剂且总体积为60 mL的体系作为空白对照(三个重复),实验组测得的甲烷产量需减去对照组产生的甲烷体积。瓶内通入氮气1分钟,然后用橡胶塞和铝封密封。培养物在35°C条件下静置培养。
分析与计算
每天工作日测量跑道池中培养基的光照强度和温度。每天工作日从跑道池中采集培养液样品,收获后的出水每周采集两次。对培养液样品进行光密度(OD)、pH值、溶解氧(DO)、总悬浮固体(TSS)、挥发性悬浮固体(VSS)、总化学需氧量(TCOD)、可溶性化学需氧量(SCOD)、总可溶性磷(Ptot)、总可溶性氮(Ntot)、氨氮(NH₄⁺‐N)以及其他阳离子(钾、镁、钙和钠)的分析。TCOD表示整个样品的COD,而SCOD则是在使用0.45 μ m注射器过滤器过滤后测定的。
使用pH电极和DO探头(HACH Lange,HQ40D,美国)测量 pH值和溶解氧(DO)。通过紫外‐可见分光光度计(岛津UV‐1700 PharmaSpec)在660纳米处测量光密度(OD 660 )来监测所有实验中的藻类生长情况。此外,使用明场显微镜(Axio‐Imager,卡尔·蔡司,德国)对藻类生长和健康状况进行额外监测,并使用AxioCam HRc拍摄样品照片。配备AxioVision软件(Carl Zeiss,德国)的CCD相机。总悬浮固体 (TSS)和挥发性悬浮固体(VSS)根据标准方法(美国公共卫生协会,1998)进行分析。Ptot、Ntot和NH₄⁺‐N根据制造商提供的方案,使用 HACH Lange试剂盒(LCK 350、LCK 303和LCK 304)测定,测定前经0.45μm注射器滤膜过滤。样品中的阳离子根据离子色谱标准 SFS‐EN ISO 10,304–1进行分析,所用仪器为离子色谱仪(Dionex DX‐120,美国),配备AS40自动进样器、IonPac CS12A阳离子交换柱 和CSRS 300抑制器(4 mm)。淋洗液含2 mM甲烷磺酸,淋洗液流速为1 mL min⁻¹。COD按照芬兰标准(芬兰标准SFS 5504,1998)采用重铬酸盐法进行分析。源分离尿液中的总COD(TCOD)被测定,在收集藻类生物质后的出水中,经0.45 μm注射器滤膜过滤后测定可溶性化学需氧量(SCOD)。
收获效率采用公式 (1) 计算:
$$ \text{Efficiency} = \frac{\text{VSS} {\text{inlet}} - \text{VSS} {\text{outlet}}}{\text{VSS}_{\text{inlet}}} \times 100\% $$
其中,VSSinlet为半连续池中培养物的挥发性悬浮固体(VSS),VSS outlet为生物质收获后出水的挥发性悬浮固体(VSS)。
根据公式 (2) 和公式 (3) 计算池塘中的营养平衡:
$$ \text{Inflow} = \text{Assimilation} + \text{Precipitation} + \text{Volatilization} + \text{Outflow} $$
$$ \text{Removal} (\%) = \frac{\text{Assimilation} + \text{Precipitation} + \text{Volatilization}}{\text{Inflow}} \times 100\% $$
其中,进水中特定营养物的浓度通过进料尿液样品测得。假设反应池处于完全混合状态,因此出水样品可代表池塘内容物。根据进出水样品的差异计算得出的生物量同化、沉淀和挥发的总和被视为营养物去除。进出水浓度在实验室中通过采集的样品进行测定。
沼气中的甲烷含量和体积采用气相色谱‐火焰离子化检测器(GC‐FID)测定,方法如文献(Kinnunen 等,2015)所述。甲烷产量已换算至标准条件(NTP):温度 273 K 和压力 1000 毫巴。
结果
尿液不同稀释度作为培养基的筛选
研究了未稀释尿液(0×)、低稀释倍数尿液(2× ‐ 5×)和高稀释倍数尿液(10×、 15×、 20×、 25×)作为S. acuminatus培养基在 7天批次实验中的适用性(图1)。第一组稀释度(0× – 5×)无法支持微藻生长。在第4天,5×稀释度的光密度OD660略有上升至1,但随后OD660 迅速降至初始值0.8以下。第二组稀释度(10× ‐ 15×)在前3天显示出微藻生长改善,但之后OD 660 下降,可能由于第4天后发生细胞死亡。然而,在 20×稀释度的培养物中观察到持续生长,其OD 660 从 0.9持续增加至1.4,这是本次所有批次实验中获得的最高OD 660 。在 25×稀释度下,初期生长使OD 660 升至1.3,之后OD 660 下降至1.1。
在所有不同稀释度的培养瓶中,起始pH为8.7(图1b),此后pH持续上升,但在培养于 20×和25×稀释尿液的培养物中,接近孵育末期 (第4天后)时pH略有下降。

跑道池(400 L)批次模式运行
S. acuminatus在SRwP中以400升的工作体积进行分批模式培养,培养液中含有经 20×稀释的尿液,以研究最大可能的藻类生长,通过 OD660和VSS进行测定。批次培养持续了近五个月,覆盖夏季(七月, 第1–14天,温度15–20°C)、秋季(八月、九月和十月,第15–102天,温度10–15°C)以及初冬(十一月和十二月,第103–148天,温度< 5 °C)。S. acuminatus 的生长以OD660表示,在培养液温度升高或降低时分别出现突然的峰值和下降,整体呈持续上升趋势(图2a)。然而,在整个实验期间,微藻在温度下降后的几天内均恢复并重新开始生长 (图2a)。池塘中微藻培养物的OD660值在第77天达到最高值6.78,最终OD660值为第148天的6.56。从第60天起,池塘温度低于10°C,从第100天起持续低于5°C。大约在第148天,室外温度降至零下,因池塘内容物结冰,研究被迫停止。
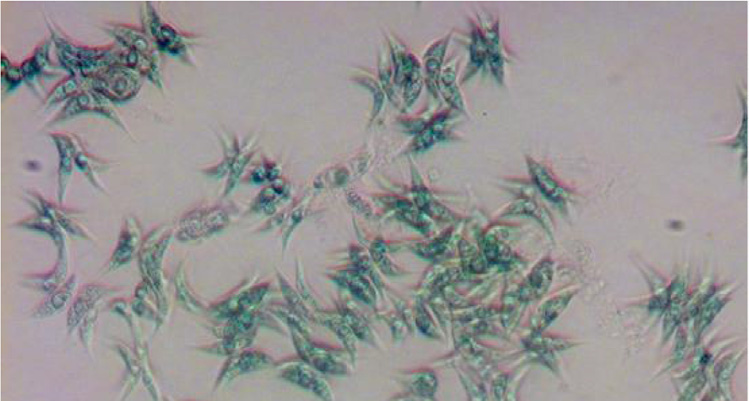
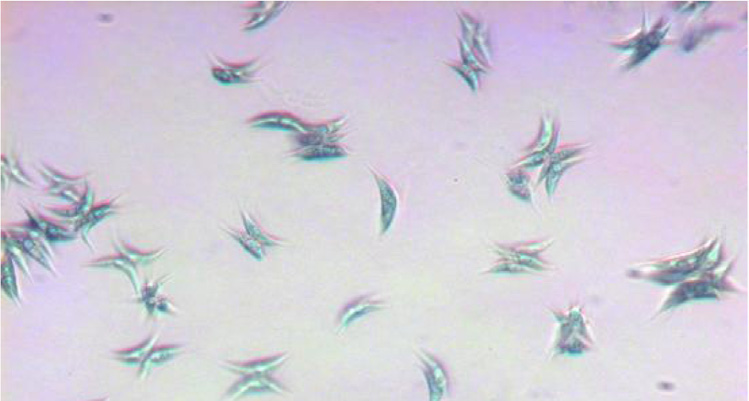
还监测了池塘中的VSS,以确定生物量浓度(克/升)是否与OD呈现相似的趋势 660 。最大挥发性固体为2.3 克/升(图2b),出现在第42天,此时也记录到了最大OD 660 值。第42天后,VSS突然下降,随后逐渐开始回升,并从第100天起保持在2.11 克/升至2.29克/升之间。池塘的 pH值fl波动剧烈且迅速;最初60天内pH值在7.4至11之间变化,之后波动减小,pH值维持在7.4至8.4之间(图2b)。实验第14天的显微图像 (温度19°C)显示S.acuminatus以四个细胞组成的密集菌落形式生长 (图2c),而图2d显示在温度为8°C的第77天,细胞密度降低。

跑道池(2000 升)半连续和分批模式运行
S. acuminatus 在一个工作体积为 2000 升的半连续运行跑道池 (BRwP)中培养了 148天。在最初的 28天(从七月中旬到八月中旬,平均温度17°C),池塘以稀释倍数为 20×的尿液进行喂养。28天后,尿液的稀释倍数降低至 15×,并继续半连续进料51天(至第79天,其中 第37至45天间有中断,平均温度11°C),之后采用分批模式运行69天 (至第148天,平均温度7°C)。
较高的稀释倍数(20×)支持微藻持续生长,在28天后达到最大光密度660和挥发性悬浮固体(VSS)分别为1.1 g/L和0.34 g/L(图3)。pH值在8.5至11之间波动较大(图3)。当尿液稀释倍数降低至 15×时,观察到微藻生长下降,7天内光密度660从0.99降至0.68,挥发性悬浮固体(VSS)从0.42 g/L降至0.28 g/L。此外,根据目视观察,培养物颜色从健康的绿色变为褐色。为从可能的冲击负荷中恢复,池塘仅用自来水进料10天(第37–45天),之后继续投加 15×稀释的尿液。在第49天 至第79天期间,池塘培养物的光密度660和挥发性悬浮固体(VSS)分别稳定在约0.70和0.31 g/L。从第80天开始进行分批操作后,光密度660缓慢上升,至第120天达到最高值0.97。尽管池塘内容物的挥发性悬浮固体(VSS)总体趋势与光密度660相似,但其增长不如光密度660,明显,在实验最后阶段以分批模式运行时,挥发性悬浮固体(VSS)约为0.34 g/L。微藻生物质的采收效率为挥发性悬浮固体(VSS)的 57 ± 8%,每周收集约150 g湿生物质(每次采收日约75 g)。
池塘中可溶性磷、铵和可溶性总氮(TN)浓度如图4所示。当池塘以半连续模式运行,使用 20×稀释尿液时,按公式(2)计算,在15天的周期内,磷、NH₄⁺N和总氮(TN)的去除率分别达到约38%、67%和52%。在使用 15×稀释尿液进行半连续操作期间,磷、NH₄⁺ N和总氮(TN)的去除率分别降低至约13%、18%和22%。在实验最后阶段以分批模式运行池塘时,几乎未观察到营养物质的去除。在整个运行期间,钠、钾、镁和钙等微量元素均未被显著吸收。
 温度和光密度(OD 660 )、(b) pH值以及(c) 挥发性悬浮固体 (VSS)的变化情况。)
温度和光密度(OD 660 )、(b) pH值以及(c) 挥发性悬浮固体 (VSS)的变化情况。)

甲烷产气潜力
收获的生物质的甲烷产气潜力通过119 mL玻璃血清瓶进行三组平行批次试验测定。甲烷产率测定使用在BRwP不同生长阶段采集的生物质,分别为 20×稀释阶段(健康细胞生长,第25天)、 15×稀释起始阶段(细胞死亡,第32天)、 15×稀释稳定阶段(冷冻干燥,第53天并原样保存至第79天)(图5)。其中两个生物质样品的甲烷产量在测定开始后立即产生,这两个样品分别采自15倍稀释倍数的生长阶段(冷冻干燥,第53天和原样保存,第79天),在测定开始后的10天内形成了总甲烷量的70–90%。第25天(20×尿液稀释)和第32天(15×尿液稀释)采集的生物质样品初始甲烷产率比另外两个样品慢(图5)。经过冷冻干燥后,收获的生物质(第53天, 15×和第25天, 20×)的生化甲烷潜力(BMP)高于250 L/kg VS,而未经冷冻干燥的生物质其值低于200 L/kg VS。对于冷冻干燥生物质,最大 BMP出现在使用 20×尿液(285 ± 20L/kg VS)培养期间,其次是 15×稀释倍数(275 ± 25L/kg VS)生长阶段收获的生物质,最低 BMP(250 ± 15L/kg VS)出现在藻类细胞死亡时期,即尿液稀释度变化期间(第32天)。
讨论
实验室条件下S. acuminatus培养的尿液稀释度筛选
S. acuminatus被选用于本研究,是因为其在废水处理研究中广泛应用,例如用于厌氧消化出水(Tao等,2017b)和生活污水二级处理出水(Posadas等,2015),并且因其能够在8–11 克/升的高生物量浓度下生长(Tao等,2017a,b)。利用微藻对人尿进行处理和营养物回收时,若能在未稀释的情况下直接使用尿液将最为有利。因此,稀释筛选实验的主要目的是确定微藻能够有效生长的最低尿液稀释度。结果表明,在分批操作实验中,小球藻 可在 10×稀释度(初始氨氮浓度为200毫克/升)下生长,而在更低的稀释度下则无法生长;但只有在20×稀释度(初始氨氮浓度为100毫克/升)时,才能观察到正常生长,且初始生长后生物量浓度无明显下降。
人尿是一种非常浓缩的营养液。在新鲜尿液中,氮化合物以尿素为主,但当尿液储存时,尿素会水解为氨和二氧化碳(亚当松,2000)。微藻可直接将铵同化为有机化合物,这可以解释稀释尿液中藻类初期快速生长的现象。非离子态或游离氨的浓度随pH值升高而增加,其浓度达到约50mg/L时可能对藻类具有毒性,具体取决于藻类种类(Azov and Goldman, 1982;Udert等,2006)。本研究中较高的pH值(pH > 10)是由碳酸盐和氨的缓冲能力以及藻类光合作用过程中对 HCO₃⁻离子的吸收所引起的,高pH还可能导致未螯合的铁、磷酸盐和碳酸盐发生沉淀,从而无法被微藻吸收利用(Kawasaki etal., 1982; Udert等,2006)。培养期末pH值下降显然是由于藻类对铵的吸收,导致H⁺生成,从而降低pH值。高pH值也可能表明培养体系可能受到 CO₂ 限制,而后期pH值下降则表明生长减缓。
一些先前的研究也报道了生长受限或没有生长的情况在批次实验中,微藻在稀释倍数低于 20×的尿液中的生长受到限制或无法生长。例如,钝顶螺旋藻在5000倍稀释的水解人尿中生长受限,光密度660低于0.2,该结果由Coppens 等人 (2016) 报道。当在 5×倍稀释的水解尿液中培养索科绿球藻 时,光密度750在一天内从0.1增加到约 0.3,但从第二天开始光密度750不再增加(团特等人,2014)。在未经任何稀释的尿液中也观察到了相同的现象。图安特等人(2014)还测试了 20×种稀释度,并得出结论: 20×稀释度下的生长最高,因为光密度750在未添加微量元素的情况下,一天内从0.1上升至0.8。
螺旋藻等微藻在新鲜人尿更高稀释倍数(120倍)下的生长已有报道,Spirulina由Chang et al.(2013)报告。然而,Changet al.(2013)所研究的新鲜人尿中氮tot(8800 mg/L)和磷tot(792 mg/L)浓度高于本研究所用的源分离储存尿液(氮tot:3480 ± 130mg/L,磷tot: 190 ± 52 mg/L)。据报道,小球藻的微藻生长(Chlorella vulgaris) 在所有尿液稀释度(1:25 至 1:100)下具有相似的生长速率,其中 1:100 稀释度时生长略高(0.6 g/L VSS),相较于1:25 稀释度(0.52 g/L VSS)和 1:300 稀释度(0.48 g/L VSS)(Jaatinen et al., 2016)。微藻在人尿中的生长很大程度上取决于 pH 值、温度、光照强度和反应器构型,因为这些参数决定了磷、氮和微量元素的可利用性,同时影响氮的毒性。因此,很难从受控环境中进行的实验室研究得出在真实条件下(例如跑道池中)会发生什么结论,这就需要开展中试规模研究。
S. acuminatus 在跑道池中的培养
在体积为400升的分批式跑道池中,使用稀释尿液培养40天后获得的最大光密度值为6.8,与合成改良N8培养基中的生长情况相当,在后者中8天时的最大光密度值为6.4。小型跑道池中获得的最大光密度远高于分批瓶中第4天培养时获得的最大光密度值1.3。相同的尿液稀释度。平均光照强度、环境温度、每日日照时数和蒸发速率在整个跑道池运行期内逐渐降低。随着温度下降(低于15°C)以及日照时间缩短和光照强度减弱,自第43天起微藻生长减少(OD660< 4.5)。然而,在经历了约20天的缓慢生长和可能的细胞死亡后,生长速率开始稳步上升,并在最后20天平均温度仅为10°C的情况下,于第77天 OD660再次达到6.8。尽管微藻生长的最适温度通常在20至30°C之间,但在平均混合液温度为7–11°C的条件下,已在体积分别为464升和800升的跑道池中成功实现了养猪场(Godos et al.,2009)和市政污水( Posadas et al., 2015)中的碳和营养物去除。
pH值升高可能导致氨毒性,原因是游离氨浓度增加(亚当松, 2000),然而在较低温度下这种影响并不显著(Udert等,2006)。本研究中, 15×和 20×稀释尿液中的氨氮浓度分别约为120和90 mg NH₄‐N/L,这不应引起对 S. acuminatus (Tao等,2017a)有毒。例如,Tao等(2017a)在实验室规模的光合生物反应器中观察到小球藻的生长,即使氨浓度高达480 NH₄‐N/L。
因此,池塘中生长受阻可能是由于温度较低和日照时间较短。然而,这些变化在北欧户外条件下是不可避免的。亚当松(2000)采用 50×稀释人尿在半连续式圆柱形反应器中培养S. acuminatus,补充铁、镁和乙二胺四乙酸(EDTA)后,最大生物量浓度达到287 毫克/升(VSS)。本研究中,在 20×稀释度下生物量浓度达到424 毫克 VSS/升,在 15×稀释度下达到460 毫克 VSS/升,表明较低稀释倍数下营养物质的可利用性更高。图安特等人(2014)也观察到,在1升光生物反应器中,使用5倍稀释的合成人尿液并在光照强度为490 mmol 光子/m²·s条件下,索科绿球藻的生长(6 克 VSS/升)优于20倍稀释和990 mmol 光子/m²·s条件下的生长(2.9 克 VSS/升),这可能是由于营养物质的可利用性更高所致。
本研究是首个报道在北欧气候下于开放式跑道池中利用源分离人尿进行微藻生长的研究。藻类在低温、较低光照强度和较短日照时间下的生长表明,微藻池在北欧地区用于尿液处理具有潜力。然而,仍需更详细的评估以了解限制因素,并最终优化池塘性能。
氮和磷去除
当大池塘以半连续模式运行并使用20×稀释尿液时,可观察到约38%的可溶性磷、67%的NH₄⁺‐N以及52%的总氮(TN)被去除。本研究中总氮去除效率更高,而磷去除率低于亚当松(2000)报道的结果 (总氮去除率为23%,可溶性磷去除率为57%),其是在40L规模的圆柱形光生物反应器中培养Scenedesmus并使用 50×稀释尿液进行的试验。然而,本研究中的营养物质去除是磷酸盐沉淀、氨通过挥发作用向环境中损失以及微藻吸收共同作用的结果。加西亚等人(2000)证明,在藻类池中,氨向大气的损失是氮去除最主要的机制,且该比例随pH 升高而增加。随着pH上升,非离子态氨含量增加,导致氨被解吸(脱除),反之亦然(NH₃+ H⁺ ↔NH₄⁺)。本研究中,微藻培养物的 pH在小池塘中波动范围为7.5至11,在大池塘中为8至11。较高的pH会导致更多的氨向大气损失(Chang 等人,2013)。温度的变化会影响氨的溶解或挥发(游离氨浓度随温度升高而增加),从而引起pH变化。在本研究期间,随着温度降低,pH波动逐渐减缓(第50天后平均温度 为< 10°C),减少了氨挥发的变化。未来开展对pH的连续监测甚至 pH控制、温度以及不同形态氨浓度的研究,将有助于更深入理解营养物质的归趋。此外,通过氨蒸发造成的损失可能是本研究中氮去除最主要的机制,但这一假设仍需进一步研究验证。
可溶性磷的浓度tot在半连续操作的前七天内,稀释尿液从 6.31 mg/L 降至 3.26 mg/L, 20×稀释尿液从 10.10mg/L 降至 7.56 mg/L。15×七天后,浓度保持稳定或在某些时间点出现上升,表明藻细胞对磷酸盐的吸收中断。Jaatinen et al.(2016)在分批培养中使用1:25稀释尿液时报告,在10天内磷的最终浓度为9.4 mg/L(初始为14 mg/L),此后浓度保持不变。碱性pH值导致尿液中的H₂PO₄⁻转化为HPO₄²⁻和 PO₄³⁻,这些物质可与尿液中的钙²⁺和镁²⁺发生沉淀(Chang et al., 2013)。随着pH值的变化,磷酸盐可能发生沉淀和溶解(Chang et al., 2013)。这可能是本研究中在大池运行期间(例如第35–49天)偶尔观察到磷酸盐浓度升高的原因。此外,死亡的藻细胞会释放细胞内的磷和氮,从而增加培养基中的磷酸盐含量(Jaatinen et al., 2016)。因此,准确量化磷酸盐吸收量较为困难,需要进行详细的形态学研究。
Bryant 和 Appah(2017)观察到小球藻从稀释人尿中去除的磷比氮多,并且随着氮和磷的摩尔比降低以及光照强度减弱,磷的去除率增加。本研究获得的结果与Bryant 和 Appah(2017)所报道的结果相反。然而,Bryant 和 Appah(2017)的实验是在实验室条件下于 250mL flask中进行的,而本研究中有多种参数同时发生变化。Posadas 等人(2015)的研究也显示磷酸盐去除率(57%)低于氮去除率(79%)。因此,显然存在其他因素,或可能是多个因素之间的相互作用,会影响微藻在大规模露天培养中的养分吸收比例。
从收获的藻类生物质中生产甲烷
本研究中的一个挑战是使用简单过滤方法采收微藻生物质。仅能通过滤布从池塘中收获约50%的微藻生物质。尽管如此,筛选高效的采收方法并非本研究的主要目标,未来有必要开展采用高效且连续采收方法的进一步研究。
小球藻为主的生物质在不同合成培养基中培养时,测得的生物甲烷潜力介于107至410升/千克挥发性固体之间(Frigon 等人,2013; Kinnunen 和 Rintala,2016;Roberts 等人,2016;Zhen 等人, 2016)。Roberts 等人(2016)报道,在人工Jaworski培养基中培养的实验室小球藻生物质具有更高的生物甲烷潜力(261 升/千克挥发性固体),相较于使用合成肥料在生物反应器中培养的生物质(161 升/千克 挥发性固体),这可能是由于大规模生物反应器中的生长条件更具挑战性所致。本研究中以尿液为培养基的微藻生物质的生物甲烷潜力(250–300 升/千克挥发性固体)与先前在合成培养基中报道的数值相当。不同培养天数收获的藻类细胞甲烷产量差异可归因于生长条件(如光照强度、温度和pH值)不同导致的细胞组成差异(Kinnunen 和 Rintala, 2016)。不同的生长条件会导致营养物质吸收的不同,从而可能导致细胞组成的差异。本研究并未设计用于揭示不同参数对生物甲烷潜力的影响,因此需要进一步研究以了解生物甲烷潜力随生长条件和藻类细胞健康状态的变化情况。研究结果及此前报道的生物甲烷潜力值明确表明,为了理解微藻生物质作为通过厌氧消化途径生产的潜在可再生能源材料的异质性,迫切需要更深入地了解影响其厌氧生物降解性的因素。然而,本研究已足以证明利用在人尿上生长的藻类细胞进行甲烷生产的可行性。此外,还需指出的是,冷冻干燥生物质与原样保存的生物质之间存在显著差异。冷冻干燥可能通过破坏部分微藻细胞而起到了预处理的作用。然而,此类预处理在更大规模下并不可行,因此应探索避免冷冻干燥但仍保持相同生物甲烷潜力的可能性。
放大外推
本研究表明,在稀释人尿中进行微藻培养是可行的,无需额外添加微量元素或CO₂ 补充。坦佩雷市预计约有20,000人将开始居住在旧工业区海达兰塔。而约20,000人的尿液日产量为大约为每天30米³,储存六个月的尿液体积约为5400立方米³。根据目前的结果,处理20,000人产生的尿液需要一个容积为6000立方米、占地面积约为2公顷的微藻池,在水力停留时间为15天和尿液稀释倍数为 15×的条件下运行。本研究中微藻池出水的总磷(TP)和总氮(TN)浓度分别约为7毫克/升和30毫克/升,因此排放前仍需进行某种形式的后续处理。目前来看,使用如此大的占地面积在实际中似乎不现实。因此,有必要减少水力停留时间和尿液稀释倍数,以降低占地面积需求。尝试新型反应器设计也可能具有重要意义,这有助于实现更紧凑的反应器结构并提高养分回收率。此外,还需开展有关高效且自动化的生物质采收以及采收后生物质的下游处理的研究工作。尽管如此,根据本研究结果,当系统按20,000人规模放大时,微藻池每天可去除约55千克的总氮(TN)和2.3千克的总磷(TP)。在该区域全部人口的尿液上生长的藻类生物质每年可用于生产约33,000立方米的甲烷(表2)。
结论
本研究表明,稀释后的源分离人尿可为开放式跑道池中的微藻生长提供足够的营养物质。研究还表明,即使在低至1°C的培养温度下,仍有可能实现微藻生长。S. acuminatus 在未添加微量元素、人工光照或 CO₂的情况下,于跑道池中成功利用稀释尿液进行培养。然而,在这些条件下以及简单的开放式池系统中,尿液必须稀释20倍才能实现合理的生长。微藻在尿液中的生长情况与在实验室反应器中合成培养基内的生长相当。S. acuminatus 从尿液中去除了约1500 千克/千克挥发性固体·天的总氮(TN)和50 千克/千克挥发性固体·天的总磷,所产生物质的最大甲烷产气潜力为285 L CH₄/kg VS。后续研究计划采用更高效的采收方法,并重点关注养分质量平衡。
表2 微藻生物质在稀释人尿中生长用于养分回收后,甲烷产气潜力在20,000人区域内的外推结果。
| 总氮去除 | 55 千克/天 |
| 总磷去除 | 2.3 千克/天 |
| 最大挥发性固体 | 0.74 克/升 |
| 甲烷产量 | 275 升/千克挥发性固体 |
| 对于水力停留时间为15天的情况,甲烷产量 | 27 升/天或10,000 升/年 |
| 在 15×稀释倍数下,所需尿液量 | 133升或9升/天,水力停留时间为15天 |





















 36
36

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








