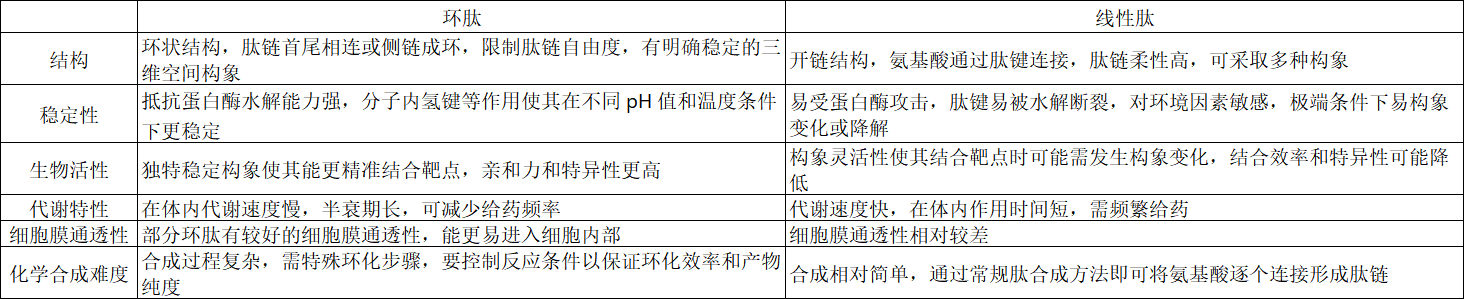
结构
- 环肽:通过肽链首尾相连或侧链成环形成环状结构,限制了肽链的自由度,具有明确而稳定的三维空间构象。
- 线性肽:是氨基酸通过肽键连接形成的开链结构,肽链具有较高的柔性,可在空间中采取多种不同的构象。

稳定性
- 环肽:由于环状结构的存在,其抵抗蛋白酶水解的能力较强,因为环状结构使蛋白酶难以接近肽键,同时分子内氢键等相互作用也增强了结构的稳定性。在不同的 pH 值和温度条件下,环肽也相对更稳定,不易发生变性或降解。
- 线性肽:线性结构使它更容易受到蛋白酶的攻击,肽键容易被水解断裂。其对 pH 值和温度等环境因素较为敏感,在极端条件下容易发生构象变化或降解,导致生物活性丧失。
生物活性
- 环肽:具有独特而稳定的空间构象,能够更精准地与靶点结合,表现出更高的亲和力和特异性。例如,一些环肽可以特异性地结合到细胞表面的受体上,作为拮抗剂或激动剂发挥作用,具有很强的靶向性。
- 线性肽:虽然也能与靶点结合,但由于其构象的灵活性,可能需要在结合过程中发生构象变化来适应靶点,这可能会降低其结合效率和特异性。
代谢特性
- 环肽:在体内的代谢速度通常较慢,能够在血液循环或组织中保持较长时间的活性,因此具有较长的半衰期。这使得它们在药物研发中具有优势,可以减少给药频率,提高药物的疗效和患者的依从性。
- 线性肽:代谢速度往往较快,在体内的作用时间较短,需要频繁给药才能维持有效的药物浓度。
细胞膜通透性
- 环肽:部分环肽具有较好的细胞膜通透性,能够更容易地进入细胞内部,从而发挥其生物学功能,如一些细胞穿透肽可以携带药物分子进入细胞。
- 线性肽:一般来说,细胞膜通透性相对较差,这可能限制了它们在某些需要细胞内作用靶点的应用。

化学合成难度
- 环肽:合成过程相对复杂,需要特殊的环化步骤来形成环状结构,并且在合成过程中需要注意控制反应条件,以避免副反应的发生,确保环化的效率和产物的纯度。
- 线性肽:合成相对简单,通过常规的肽合成方法,如固相合成法或液相合成法,就可以较为容易地将氨基酸逐个连接起来,形成所需的线性肽链。
























 3683
3683

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








