本文内容速览:
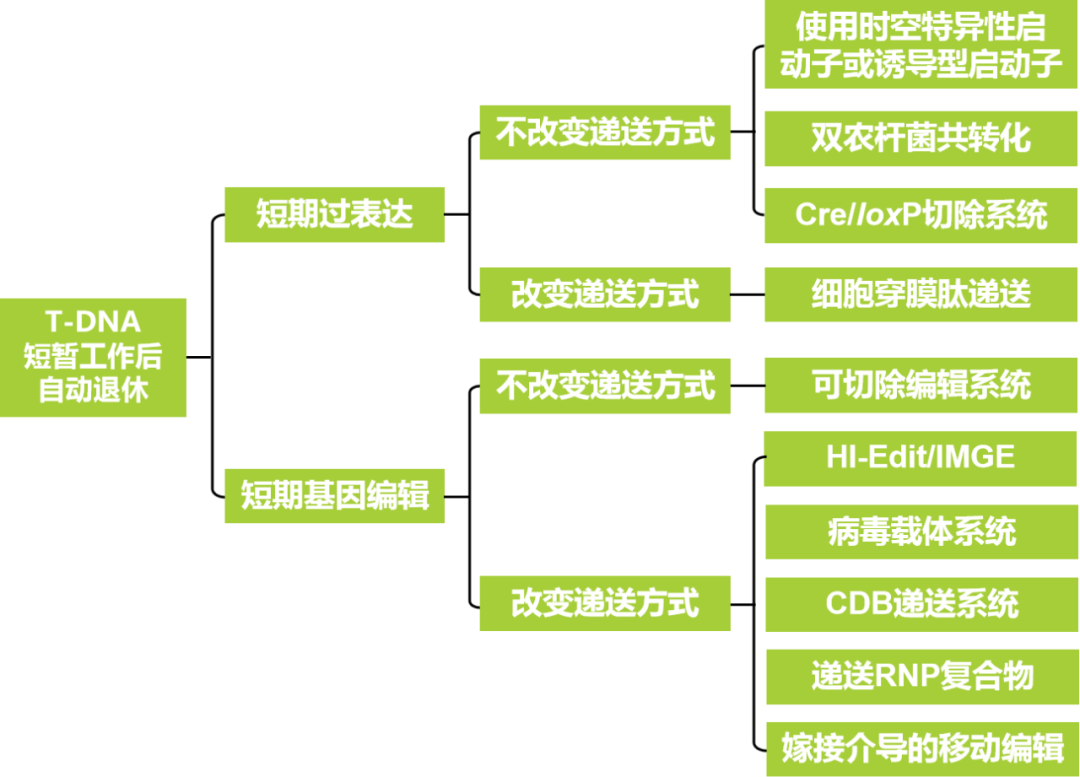
在植物遗传转化与基因编辑研究中,我们常常面临一些“两难”问题。
问题一:有些基因“只能共苦,不能同甘”
伯小远在之前的文章“显著提高遗传转化效率,只需一步(一)、(二)、(三)”中介绍了许多提高植物遗传转化效率的因子,例如BABY BOOM(BBM)、WUSCHEL(WUS)和GROWTH-REGULATING FACTOR(GRF)等,这些发育调节因子在前期遗传转化的过程中能显著促进转化和再生,这对难以转化或再生的物种如小麦、玉米和棉花等非常重要。但是需要注意,这些因子一旦后期在植株内持续表达,不仅对目的基因的功能分析有影响,甚至有些会导致植物产生不育、畸形等表型缺陷。因此,如何让这些调节因子只在某一段时间内发挥作用成为了一个需要思考的问题。
问题二:必要时候需得“卸磨杀驴”
在以基因编辑作为新型分子育种手段的研究中,我们通常期望获得无外源T-DNA残留(T-DNA free)的编辑植株。传统的稳定遗传转化方式使带有Cas9和sgRNA的T-DNA整合入基因组,需要经过自交或杂交分离后得到T-DNA free的编辑植株,而这依赖于对大量转基因材料的鉴定,另外,有些物种生长周期过长,短时间内无法完成自交或杂交,甚至有些物种本就无法自交或杂交,最终导致无法得到T-DNA free的编辑植株。因此,如何在植物体内实现CRISPR/Cas9系统的短期作用,在编辑后迅速清除带有Cas9和sgRNA的T-DNA,成为了一个新的需求。
伯小远初步梳理了近年来植物中实现短期过表达和短期编辑的策略(这里和平时常说的“瞬时”转化有些不一样,所以本文称之为“短期”),小远将它们粗分为两类:(1)不改变T-DNA递送方式的策略:通过可控表达或可切除系统在时间维度上控制T-DNA的作用;(2)改变T-DNA递送方式的策略:通过病毒载体、合适的介质或嫁接等方式在物理位置上控制T-DNA的作用。
01
植物中短期过表达的策略
不改变递送方式
这类方法使用传统农杆菌介导的遗传转化方法,但通过“精准控制”基因表达或存在时间,实现短期过表达的功能。
使用时空特异性启动子或诱导型启动子
最直接的思路,就是为这些发育调节基因安装一个“定时开关”或“区域门禁”,这正是特异性或诱导型启动子的用武之地。
2018年,杜邦先锋公司William Gordon-Kamm团队在In Vitro Cellular & Developmental Biology-Plant杂志上发表了一篇题为“Rapid genotype ‘independent’ Zea mays L. (maize) transformation via direct somatic embryogenesis”的文章,作者从玉米转录组数据库中筛选出在叶片、胚胎和愈伤组织中高表达,但在根、分生组织中低表达或不表达的磷脂转移酶蛋白基因Zm-PLTP。作者在转基因载体设计中使用PLTPpro驱动Bbm,以及使用生长素诱导型启动子Axig1pro驱动Wus2,在含生长素的培养基上,Bbm和Wus2实现高表达,促使外植体细胞诱导出体细胞胚,后期将外植体移至再生培养基以及后续植株生长阶段,Bbm和Wus2表达水平较低甚至不再表达,从而避免了这两个基因持续表达对植株发育造成的缺陷影响。此优化的载体PHP79066(Zm-Axig1pro::Wus2+Zm-PLTPpro::Bbm)在多个自交系中的转化效率达62.5%。
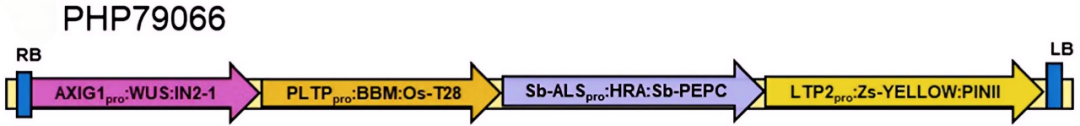
图1 玉米转化实验所用载体PHP79066的示意图(Lowe et al., 2018)。
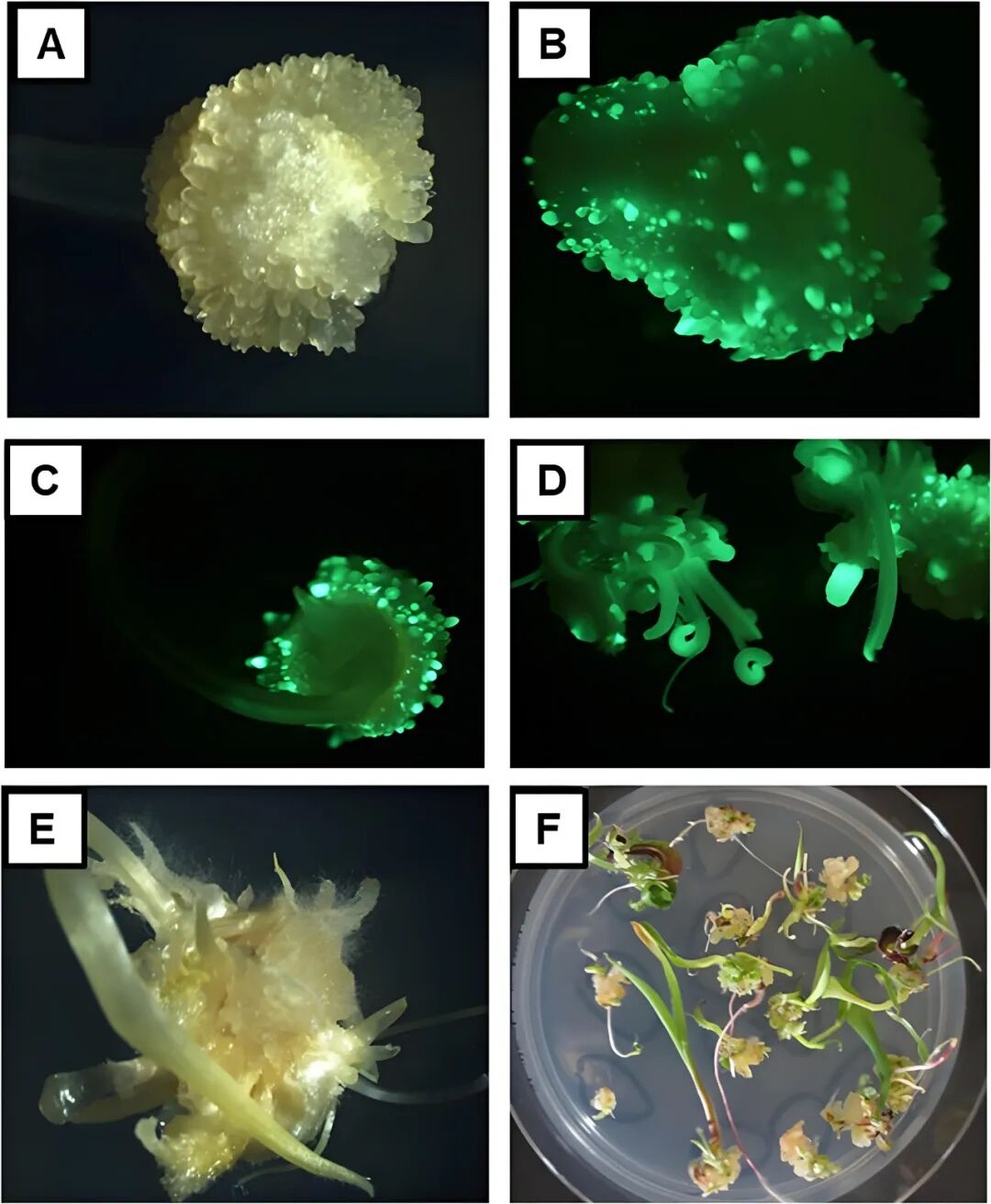
图2 玉米转化过程(Lowe et al., 2018)。(A)侵染7天后的胚表面;农杆菌感染后不同时间点的绿色荧光信号:4天(B)、7天(C)和10天(D);(E、F)农杆菌感染后分别于第14天和第24天萌发的转基因幼苗。
双农杆菌共转化
如果觉得上面控制基因的“开关”不够彻底,那么能否从根本上避免这些基因的整合,只利用其瞬时表达的产物呢?“利他型”转化策略巧妙地实现了这一点。
2020年,科迪华公司Bill Gordon-Kamm团队在In Vitro Cellular & Developmental Biology-Plant杂志上发表了一篇题为“Use of non-integrating Zm-Wus2 vectors to enhance maize transformation”的文章,作者使用两种农杆菌,一种携带筛选标记基因和可视化报告基因,另一种携带Wus2表达盒,通过调节两种农杆菌菌株的比例(转化效率最高的比例为9:1),共侵染玉米外植体后,可获得只含筛选标记基因和可视化报告基因但不含Wus2的T0植株。作者认为,即便Wus2未整合进基因组,其瞬时表达产生的蛋白或信号也能刺激邻近细胞形成体细胞胚,因此将这种方法命名为“利他型”转化方法(altruistic transformation),利用该方法,多个先前被认为难以转化的热带及温带玉米自交系如PH2KD1、PH4BAH、PH1V69、PHW52等均获得了稳定的转基因植株。
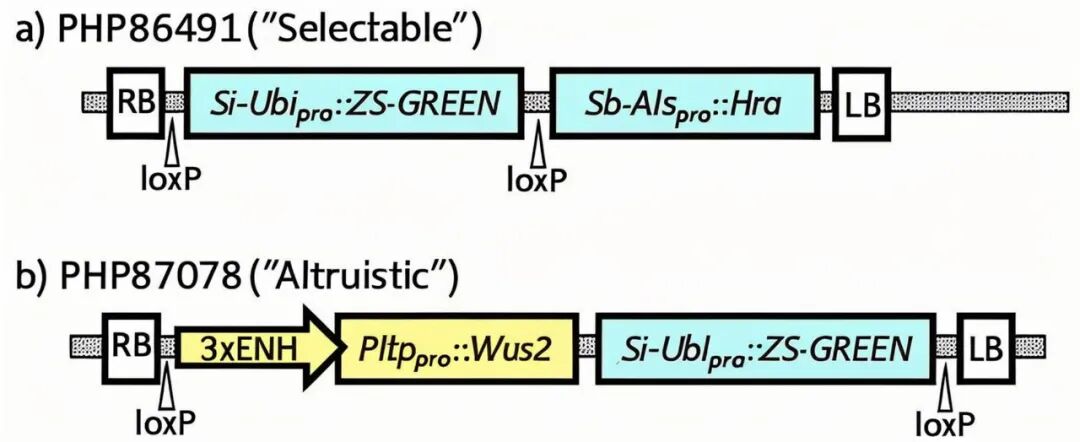
图3 所示为实验中使用的载体(Hoerster et al., 2020)。双元载体PHP86491(a)中的T-DNA包含强组成型ZS-GREEN(可视化报告基因)和弱组成型Hra表达盒(Hra为筛选标记基因,其编码一种对磺酰脲类除草剂如Imazapyr不敏感的ALS酶,转化后含Hra的组织可在含Imazapyr的培养基上生长)。双元载体PHP87078(b)中的T-DNA包含一个使用Pltppro启动子(在玉米幼胚盾片和愈伤组织中特异性表达)的Wus2表达盒,上游有三个病毒增强元件(简称3×ENH),以及强组成型ZS-GREEN。利他型T-DNA中的Wus2表达盒用黄色突出显示。
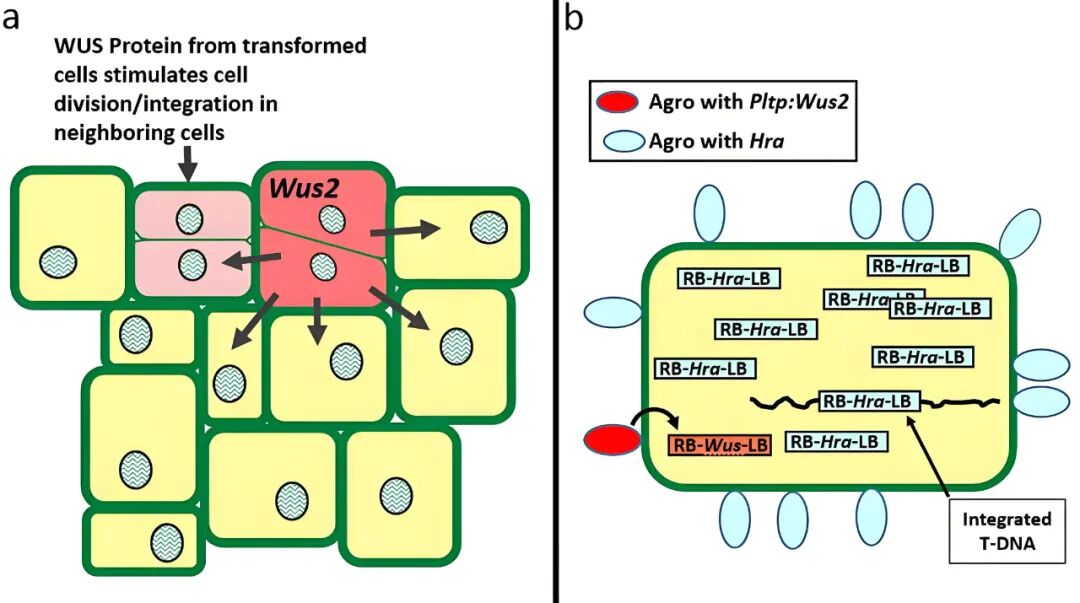
图4 关于“利他型”转化方法的两种解释模型(Hoerster et al., 2020)。(a)WUS蛋白的移动会刺激已独立整合T-DNA的邻近细胞进行分裂;(b)两种菌株的T-DNA均进入细胞,当两种农杆菌的比例为9:1时,可能使含有筛选标记的T-DNA更容易整合,而含Wus2的T-DNA数量较少更难整合,且Wus2的表达是短暂的。
Cre/loxP 切除系统
有没有一种方法,可以让基因在完成使命后,连同自身一起“自我销毁”?Cre/loxP重组系统就像一套精准的“分子剪刀”,能够实现这种定点清除。
2020年,科迪华公司Ajith Anand团队在Frontiers in Plant Science杂志上发表了一篇题为“An efficient gene excision system in maize”的文章,作者建立了一种能在再生前自动切除形态发生基因Bbm/Wus2以及筛选标记基因的系统,使得到的T0植株既可快速生成,又无形态发生基因和筛选标记基因残留。
作者评估了三种由Cre-loxP重组酶驱动的自切除(auto-excision)策略:①将形态发生基因和Cre基因放在两个loxP位点之间,由发育调控型启动子如Ole、Glb1、End2、Ltp2、Rab17或Kn1等在特定发育时期激活Cre表达以切除目标序列。②将筛选标记基因(Hra)的关键部分分别置于两个loxP位点的前后,只有在Cre介导的切除发生后,筛选标记基因才会被正确组装并表达,从而直接筛选出已发生切除的事件。③使用热激启动子如Hsp17.7、Hsp26驱动Cre,在组织培养的特定阶段(体细胞胚胎成熟期)通过热激处理来精确控制切除时机。结果显示,第③种策略表现最佳,在45℃下热激2小时,使用Hsp17.7pro::Cre载体的转基因事件切除频率高达77.8%,并成功获得单拷贝、无残留、形态正常和遗传稳定的玉米植株。
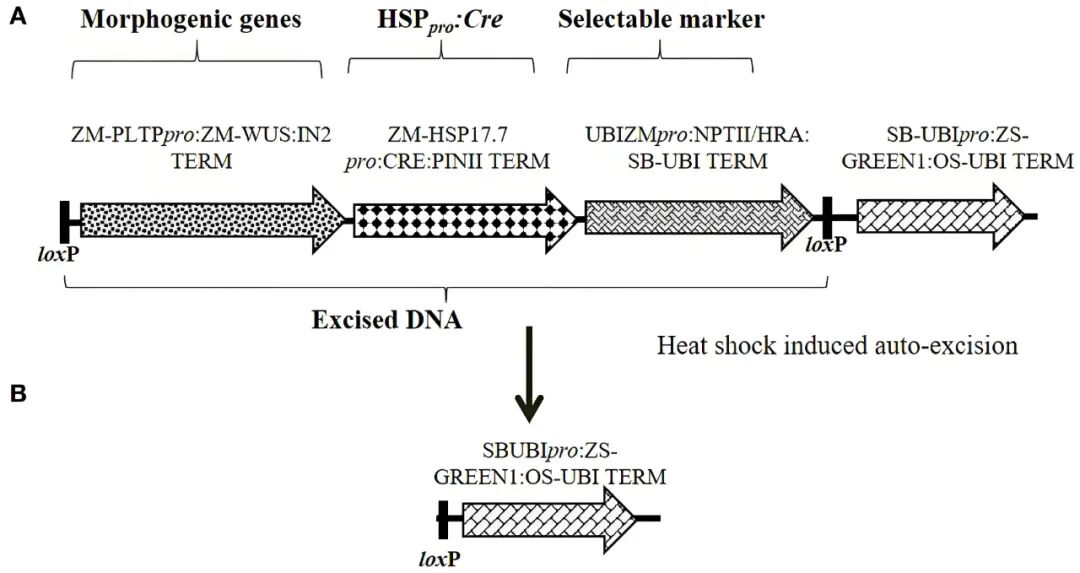
图5 所示为策略③使用的载体,用于测试通过热激启动子驱动Cre表达以实现基因切除的自切除载体结构设计示意图(Wang et al., 2020)。(A)展示了形态发生基因、Hsp17.7pro驱动Cre表达和筛选标记基因(Hra或NPTII)的表达盒顺序,这些表达盒将在Cre表达时被切除;(B)切除后,包含ZS-GREEN表达盒的DNA片段留在T0植株中,以便通过视觉观察确认切除。
备注:关于Cre-loxP系统的详细信息可见文章“分子剪刀的进阶应用:基因表达放大器与遗传标记消除器”。
改变递送方式
这类方法跳出T-DNA整合的框架,直接递送mRNA、蛋白或小肽,从根源上避免外源基因残留。但关于这方面的文献,小远并没有找到更多,大家看到的话,欢迎分享给小远。
细胞穿膜肽(CPP)递送
一个更彻底的思路是绕过T-DNA本身,直接将具有生物功能的蛋白质送入细胞,从根源上杜绝外源基因整合的可能。
细胞穿膜肽(CPP)是一种短链氨基酸,像是一种高效的“运输小车” ,为将大分子蛋白高效递送至植物细胞这一难题带来了曙光。2023年,加州大学伯克利分校Markita P. Landry团队在Communications Biology杂志上发表了一篇题为“Delivered complementation in planta (DCIP) enables measurement of peptide-mediated protein delivery efficiency in plants”的文章,作者开发了一种名为DCIP的新技术,该技术基于荧光互补检测方法,能够实现植物细胞中肽和重组蛋白的细胞质递送,并且可以定量测量蛋白质递送效率。其中,作者发现,通过细胞穿膜肽R9递送进去的WUS蛋白不仅是完整的,而且具有转录因子活性,能够调控植物内在的基因网络。并且作者惊讶地发现,不带R9穿膜肽的WUS蛋白也能自行进入植物细胞,尽管效率低于R9融合版本。通过序列比对,发现WUS蛋白内包含一个与已知穿膜肽相似的同源结构域第三螺旋,所合成的短肽(WUSP)被证实具有一定的穿膜能力。虽然后续并未利用此技术在植物中进行短期过表达,但该文为利用CPP携带发育调节因子(如WUS、GRF)进入细胞,实现短期功能激活,提供了全新的、极具潜力的技术路线。
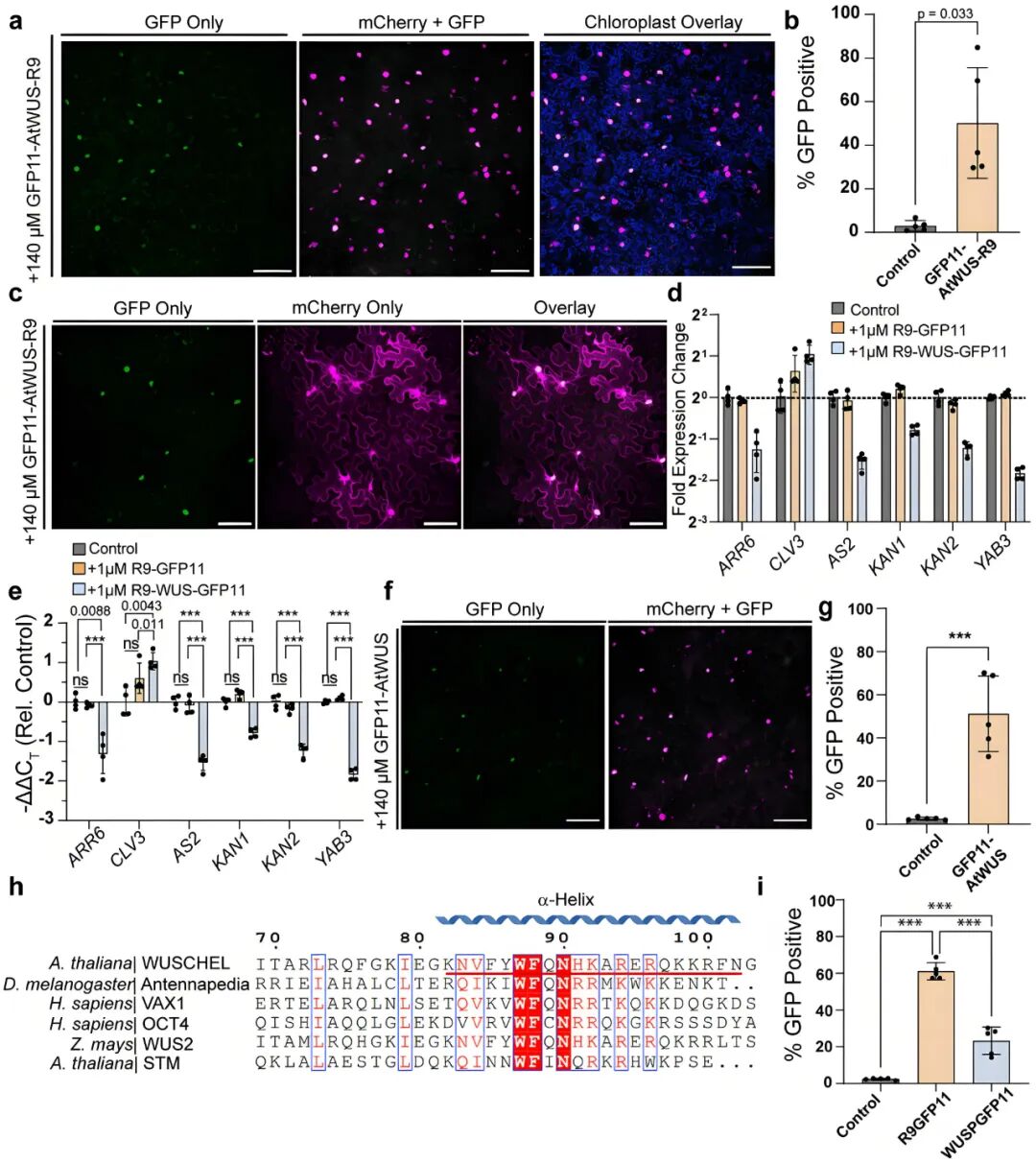
图6 形态发生转录因子WUSCHEL的递送(Wang et al., 2023)。(a、b)递送GFP11-AtWUS-R9后,叶片中显示WUS成功递送的代表性图像,以及GFP定量分析;(c)递送的AtWUS在细胞质定位传感器(cytoDCIP)叶片中显示其固有的核定位能力;(d)用GFP11-AtWUS-R9或R9-GFP11处理拟南芥幼苗后,WUS下游靶基因的RT-qPCR分析;(e)与对照组相比,GFP11-AtWUS-R9处理组的基因表达变化具有统计学显著性;(f)不含穿膜肽R9的GFP11-AtWUS也能进入细胞;(g)GFP11-AtWUS与GFP11-AtWUS-R9的递送效率定量比较;(h)WUS与其他植物和动物同源结构域蛋白的序列比对,红色下划线为测试的WUS衍生穿膜肽;(i)WUS衍生穿膜肽(WUSP)与R9的递送效率比较。
备注:DCIP的原理:作者设计了一个由GFP11和sfGFP1-10组成的系统,当GFP11被成功递送到细胞质中并与sfGFP1-10互补时,会发出绿色荧光信号。
02
植物中短期基因编辑的策略
不改变递送方式
可切除编辑系统
类似于图5中的方法,在传统编辑载体中嵌入“自毁程序”,如重组酶系统,使Cas9和sgRNA在完成任务后被清除。
火疫病是由细菌引起的严重病害,是苹果中最具破坏性的疾病。2019年,意大利圣米歇尔·阿迪杰研究与创新中心Mickael Malnoy团队在Plant Biotechnology Journal杂志上发表了一篇题为“Reduced fire blight susceptibility in apple cultivars using a high-efficiency CRISPR/Cas9-FLP/FRT-based gene editing system”的文章,作者开发了一种新的高效基因编辑系统CRISPR/Cas9-FLP/FRT,利用FLP/FRT可切除系统(与前述Cre-loxP系统类似,FLP是重组酶,能够切割FRT位点),将Cas9和筛选标记置于两个FRT位点之间,并用热激启动子驱动FLP重组酶表达,经热激处理后,FRT位点之间的DNA片段可被完整切除。作者使用该系统敲除苹果中与火疫病易感相关的基因,在苹果这种难以去除外源DNA的多年生木本植物中,成功实现了可遗传的无标记基因编辑。
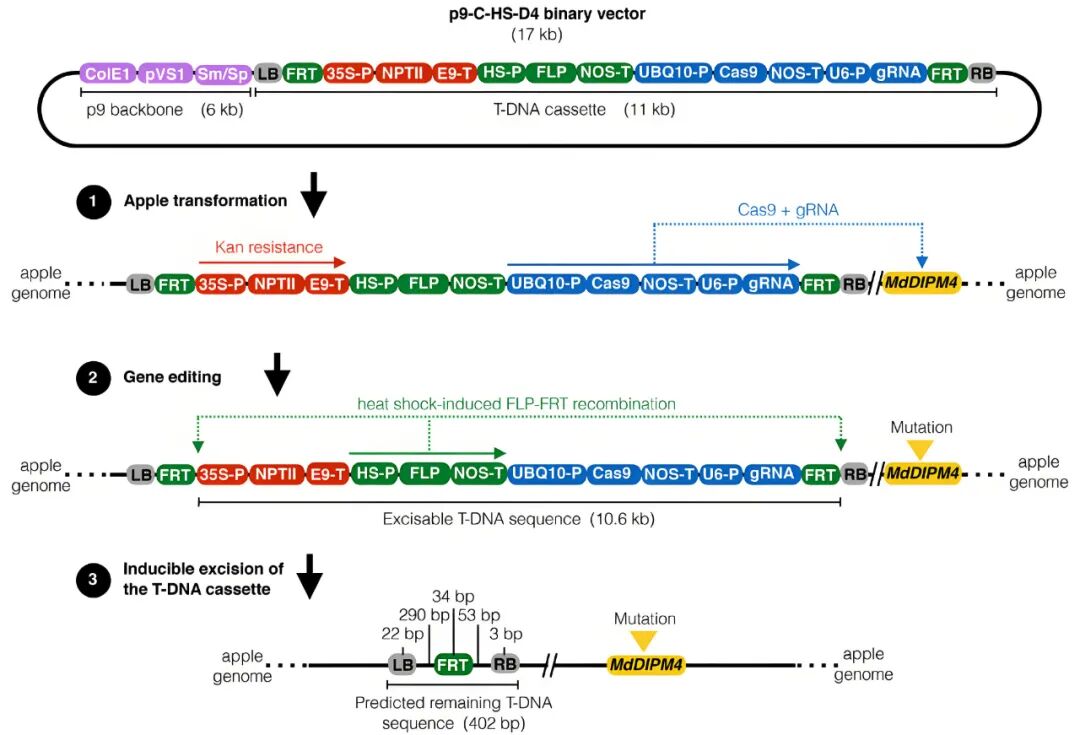
图7 基于CRISPR/Cas9-FLP/FRT基因编辑系统的p9-C-HS-D4双元载体结构与作用机制示意图(Pompili et al., 2019)。该双元载体是通过将一个11kb的T-DNA表达盒克隆到一个6kb的p9载体骨架(紫色框)中构建而成。T-DNA表达盒包含:一个用于苹果转化后筛选的卡那霉素抗性系统(红色框,步骤1);一个用于靶向基因组MdDIPM4(黄色框)的基因编辑系统(蓝色框,步骤2);以及一个用于切除外源DNA的热激诱导型FLP/FRT重组系统(绿色框,步骤3)。

图8 嘎拉和金冠品种中MdDIPM4编辑植株的火疫病严重程度(Pompili et al., 2019)。接种1个月后拍摄的照片,显示了野生型和部分转基因株系中由火疫病诱导的坏死表型。红色和蓝色箭头分别指示了坏死的中断和新再生出的枝条。G:嘎拉;GD:金冠。该文结果显示,对嘎拉和金冠的转化效率分别为1.55%和2.55%,编辑效率分别为77.8%和73.3%,部分植株实现了100%的外源DNA删除。
改变递送方式
通过HI-Edit/IMGE技术、病毒、CDB递送、RNP、嫁接等非整合方式递送编辑元件,实现“无T-DNA整合、无组培”的可遗传编辑。
HI-Edit/IMGE
2019年,先正达公司Timothy Kelliher和Qiudeng Que团队在Nature biotechnology杂志上发表了一篇题为“One-step genome editing of elite crop germplasm during haploid induction”的文章。同一时期,中国农业科学院生物技术研究所王宝宝团队和华南农业大学王海洋团队在Molecular Plant杂志上发表了一篇题为“Development of a haploid-inducer mediated genome editing system for accelerating maize breeding”的文章。这两篇文章分别提出的HI-Edit和IMGE策略,将单倍体诱导育种与基因编辑技术结合,可在短时间内对任意品种进行改良,使基因编辑技术的应用不再受遗传转化技术及政策的限制。
作者们的思路是,将Cas9/sgRNA编辑元件导入玉米单倍体诱导系,当该诱导系作为父本授粉时,花粉中携带的Cas9/sgRNA编辑元件在受精早期会作用于母本基因组,编辑目标基因,随后,来自父本的基因组会被迅速清除,最终形成仅保留母本遗传信息、目标基因已被编辑且完全不含外源T-DNA的单倍体植株,将其加倍后即可获得纯合、T-DNA free的编辑植株。更详细的信息可参考小远之前的文章“青出于蓝-单倍体诱导技术的衍生”。
虽然这个技术中也涉及到遗传转化,但更关键的步骤在于后面的杂交/授粉,因此小远将其归于“改变递送方式”的分类中。
病毒载体系统
病毒介导的植物基因编辑通常无需依赖传统的遗传转化技术,因此对缺乏稳定高效遗传转化体系的物种来说,是获得基因编辑突变体乃至开展分子育种的有力方法。
受病毒装载能力限制,病毒介导的植物基因编辑策略大致分为两类:一类是仅用病毒表达sgRNA,在已稳定表达Cas9的宿主中诱导编辑;另一类是病毒载体同时表达Cas9和sgRNA,侵染非转基因背景的宿主植物,完成编辑。递送的方式,分为农杆菌注射或摩擦接种、通过烟草获得病毒提取物再感染宿主、通过昆虫这种中间宿主感染宿主等。
在植物中,病毒介导的植物基因编辑难点有两个。一个难点在于后代难以脱毒,目前还没有通用的脱毒方案。虽然大多数病毒并不整合至植物基因组,但如果植物进入生殖期后病毒仍在扩散,则其可能进入花器官以致后代仍带有病毒,然而,植物的分生组织天生排斥病毒(该现象被称为Meristem exclusion),因此当编辑元件进入分生组织编辑了这些细胞,这些细胞后续发育成的新分蘖或花器官则自然无毒;选用无法经过种子传播的病毒也是一个锦上添花的方法。另一个难点在于,正由于病毒难以进入分生组织,若仅感染体细胞则编辑位点无法遗传,而这通过在编辑载体中添加移动元件如截短的开花位点T(FT)、类tRNA序列(TLS)可以解决,这些移动元件能促使编辑元件向分生组织移动,在形成分蘖或花器官之前完成编辑,使编辑可遗传。
关于病毒介导的植物基因编辑,更详细的信息可参考小远之前的文章“病毒≠毒物!”
2025年,中国农业大学王献兵团队在Nature Plants杂志上发表了一篇题为“Transgene- and tissue culture-free heritable genome editing using RNA virus-based delivery in wheat”的文章,作者利用大麦黄条点花叶病毒(Barley yellow striate mosaic virus,BYSMV)改造的基因编辑载体,可同时表达Cas9和靶向小麦基因的sgRNA,通过农杆菌浸润本氏烟,提取病毒粗提液注射褐飞虱2龄若虫再让其取食小麦,成功实现植株的系统感染,在小麦栽培品种科兴3302、百农4199、百农207、豫州473和周麦36等成功获得纯合突变的分蘖和可遗传的子代编辑植株,并将此方法命名为BYSMV-ViGET系统。该系统不依赖转基因、无需组培,一代即可获得纯合突变体,并且可稳定遗传,为小麦的基因功能研究和编辑育种提供了高效的遗传工具。
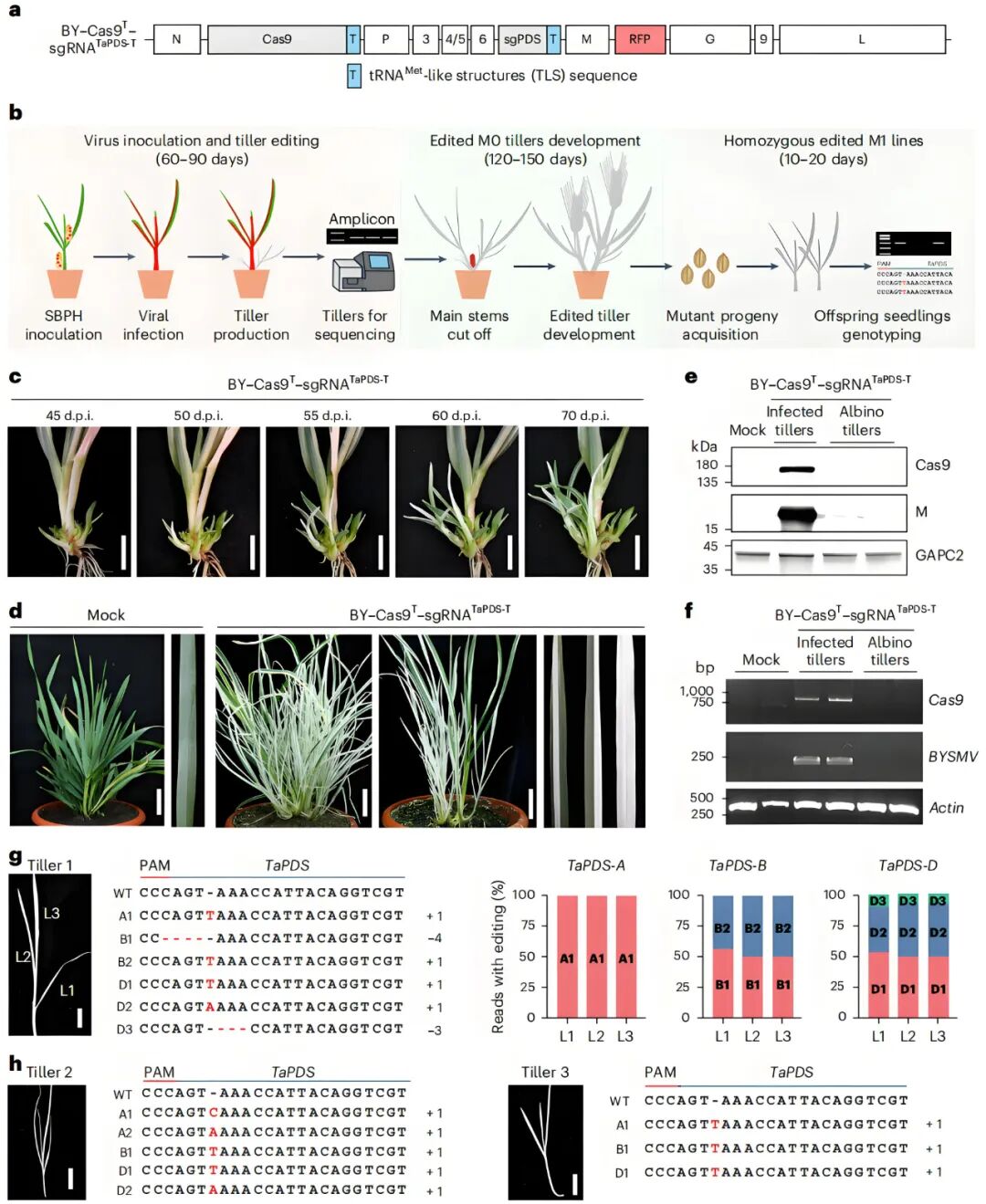
图9 对感染BY-Cas9T-sgRNATaPDS-T的六倍体小麦突变分蘖的诱导(Qiao et al., 2025)。(a)BY-Cas9T-sgRNATaPDS-T的载体结构示意图;(b)通过感染病毒产生小麦突变体的流程;(c)感染后45至70d,从感染病毒的小麦植株中诱导白化分蘖;(d)大约在感染后150d,具有白化分蘖的代表性小麦植株;(e)使用从图d所示的感染叶片或白化分蘖中提取的蛋白质,对Cas9和病毒M蛋白进行免疫印迹分析;(f)使用RT-qPCR技术在对照、感染的叶片和白化分蘖中检测Cas9 mRNA和BYSMV基因组RNA;(g)来自白化分蘖1的三片叶子中的突变模式;(h)白化分蘖2和分蘖3中的双等位或纯合突变。
CDB递送系统
切-浸-芽(Cut-dip-budding,CDB)递送系统是一种规避组织培养的植物遗传转化方法,适用于具有根出芽/条能力(root suckering)的物种。其操作流程是:首先将植物的芽切割后浸泡在含有根癌农杆菌(该农杆菌携带基因编辑元件及根诱导质粒)的溶液中;随后,插条在农杆菌作用下形成基因编辑过的毛状根;最终,这些毛状根能利用植物自身的克隆繁殖能力,直接萌发出携带目标突变的新生芽条。该体系已成功应用于橡胶草(Cao et al., 2023)、甘薯(Cao et al., 2023)、中药植物(Lu et al., 2024)及多肉植物(Lu et al., 2024)等。

图10 使用CDB系统对药用植物进行转化(Lu et al., 2024)。(A)CDB递送系统的工作流程图(备注:文献中是这么表述的,但小远表示有点奇怪,这也不是工作流程图呀);(B-I)显示RUBY阳性的毛状根以及由转化根产生的RUBY阳性的Clerodendrum chinense、Clerodendrum bungel、Clerodendrum yunnanense、Clerodendrum canescens、Clerodendrum colebrookianum、Lycium chinense、Rubus rosifolius、Anemone hupehensis植株。

图11 使用改良的CDB方法转化Crassula arborescens(Lu et al., 2024)。(a)表达RUBY报告基因的C. arborescens转基因芽;(b)RUBY阳性的不定芽正常生长。
递送RNP复合物
最直接的“瞬时”编辑方式,莫过于将预先组装好的Cas9蛋白和sgRNA的复合物(RNP)直接递送到细胞内。编辑完成后,RNP会迅速被细胞降解,无残留风险。RNP的递送策略包括利用物理化学方法如显微注射、电转、轰击、喷施和PEG介导等,利用介质如纳米颗粒、碳基材料、囊泡和聚合物等多种方法。相关的研究文章不少,大家可以找感兴趣的看看,小远这里就列举一个刚发表的文章案例吧。
2025年,日本筑波国立农业食品研究所Ryozo Imai课题组在Frontiers in Genome Editing杂志上发表了一篇题为“A long shelf-life melon created via CRISPR/Cas9 RNP-based in planta genome editing”的文章。作者开发了一种名为植物粒子轰击-核糖核蛋白复合体递送技术(in planta particle bombardment ribonucleoprotein,iPB-RNP)的无需组织培养、无T-DNA、可遗传的基因编辑技术,使用Cas9蛋白+sgRNA预组装的RNP复合物包被金颗粒,直接轰击哈密瓜种子胚芽的顶端分生组织(SAM),最终成功创造了保质期显著延长的突变体。
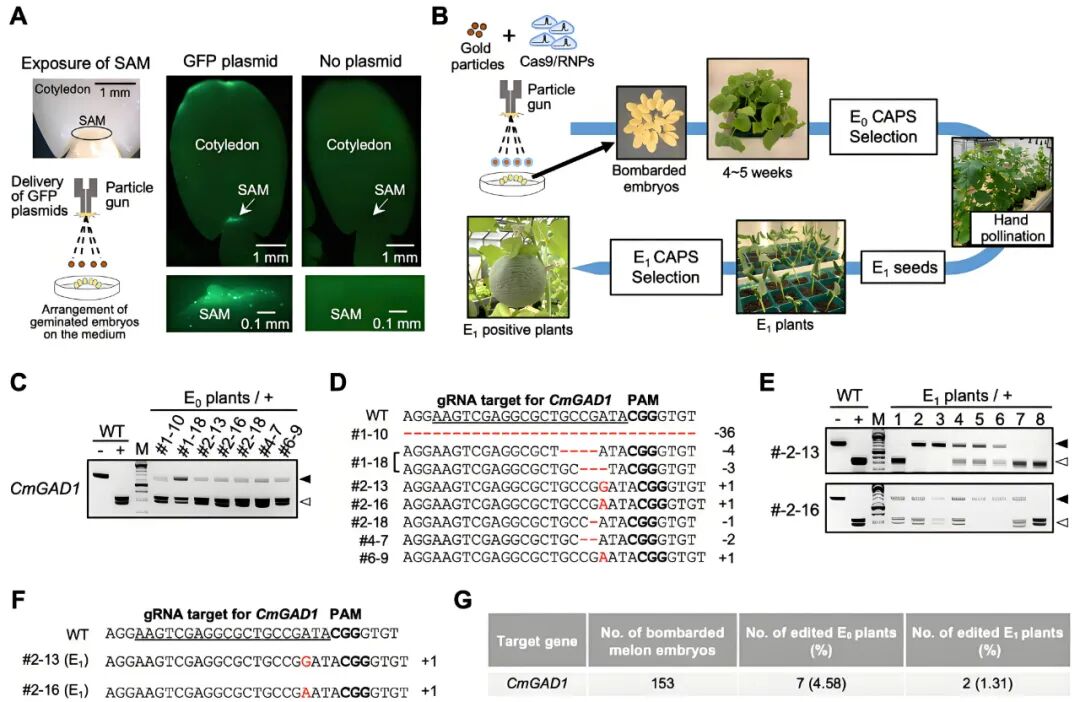
图12 在哈密瓜中通过iPB-RNP法介导的基因编辑(Sasaki et al., 2025)。(A)通过微粒子轰击将GFP表达质粒递送至哈密瓜茎顶端分生组织的过程;(B)在哈密瓜中进行iPB-RNP基因编辑的流程示意图;(C)在靶向CmGAD1位点携带突变的E0代植株的酶切扩增多态性序列分析(CAPS),“–”和“+”分别表示未经和经过RNP消化植株DNA的反应,黑色和白色三角分别指示RNP处理后未消化和已消化的条带;(D)阳性E0代植株与WT序列的CRISPR/Cas9靶序列比对,插入和缺失以红色标出;(E)来自两个E0代植株(#2–13和#2–16)的E1代后代的基因特异性CAPS分析;(F)阳性E1代植株与WT序列的CRISPR/Cas9靶序列比对,插入以红色高亮显示;(G)靶向CmGAD1的基因编辑实验总结,基因组编辑效率基于轰击的胚数计算。
嫁接介导的移动编辑
大自然中,砧木和接穗之间会进行物质交换,能否利用这种天然的运输系统,将基因编辑元件从一个植株传递到另一个植株?
2023年,马克斯-普朗克研究所Friedrich Kragler课题组在Nature biotechnology杂志上发表了一篇题为“Heritable transgene-free genome editing in plants by grafting of wild-type shoots to transgenic donor rootstocks”的文章。作者通过将可移动的类tRNA序列(TLS)融合到CRISPR/Cas9基因编辑系统中,使Cas9和gRNA可以从转基因拟南芥砧木转移到野生型拟南芥或芸薹接穗中,成功实现了可遗传的基因编辑。该系统能够在一代内获得无转基因成分的后代植株,省略了转基因消除、培养恢复和选择的复杂过程。关于这篇文章,小远已经在“听说无需组培就可以获得基因编辑植株”为大家详细讲解过了,这里就不多说了。
短期过表达与短期基因编辑策略正成为植物分子生物学与精准育种的重要方向。前者使发育调控基因如BBM、WUS、GRF等仅在转化早期短暂表达,从而提高再生效率又避免后期干扰;后者则为获得无T-DNA残留的编辑植株提供了多种可能途径,为解决长生命周期或不具自交/杂交能力物种的编辑难题提供了可行路径。
References:
Cao X, Xie H, Song M, Lu J, Ma P, Huang B, Wang M, Tian Y, Chen F, Peng J, Lang Z, Li G, Zhu JK (2023) Cut-dip-budding delivery system enables genetic modifications in plants without tissue culture. Innovation (Camb) 4: 100345
Hoerster G, Wang N, Ryan L, et al. Use of non-integrating Zm-Wus2 vectors to enhance maize transformation: Non-integrating WUS2 enhances transformation[J]. In Vitro Cellular & Developmental Biology-Plant, 2020, 56(3): 265-279.
Lowe K, La Rota M, Hoerster G, Hastings C, Wang N, Chamberlin M, Wu E, Jones T, Gordon-Kamm W (2018) Rapid genotype "independent" Zea mays L. (maize) transformation via direct somatic embryogenesis. IN VITRO CELL DEV-PL 54: 240-252
Lu J, Li S, Deng S, Wang M, Wu Y, Li M, Dong J, Lu S, Su C, Li G, Lang Z, Zhu JK (2024) A method of genetic transformation and gene editing of succulents without tissue culture. PLANT BIOTECHNOL J 22: 1981-1988
Lu J, Lu S, Su C, Deng S, Wang M, Tang H, Wang Z, Li G, Lang Z, Zhu JK (2024) Tissue culture-free transformation of traditional Chinese medicinal plants with root suckering capability. HORTIC RES-ENGLAND 11: d290
Pompili V, Dalla CL, Piazza S, Pindo M, Malnoy M (2020) Reduced fire blight susceptibility in apple cultivars using a high-efficiency CRISPR/Cas9-FLP/FRT-based gene editing system. PLANT BIOTECHNOL J 18: 845-858
Qiao JH, Zang Y, Gao Q, Liu S, Zhang XW, Hu W, Wang Y, Han C, Li D, Wang XB (2025) Transgene- and tissue culture-free heritable genome editing using RNA virus-based delivery in wheat. NAT PLANTS 11: 1252-1259
Sasaki K, Urano K, Mimida N, Nonaka S, Ezura H, Imai R (2025) A long shelf-life melon created via CRISPR/Cas9 RNP-based in planta genome editing. Front Genome Ed 7: 1623097
Wang JW, Squire HJ, Goh NS, Ni HM, Lien E, Wong C, Gonzalez-Grandio E, Landry MP (2023) Delivered complementation in planta (DCIP) enables measurement of peptide-mediated protein delivery efficiency in plants. COMMUN BIOL 6: 840
Wang N, Arling M, Hoerster G, Ryan L, Wu E, Lowe K, Gordon-Kamm W, Jones TJ, Chilcoat ND, Anand A (2020) An Efficient Gene Excision System in Maize. FRONT PLANT SCI 11: 1298




















 3776
3776

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








