本文内容速览:

在“你了解RNAi技术有多深?(一)”这篇推文中,小远给大家介绍了RNAi的发现与历史、RNAi的四种不同途径以及RNAi在沉默基因中的应用:hpRNA和amiRNA。今天小远将接着上次推文的内容继续为大家分享:RNAi在沉默基因中的最后一个应用——VIGS,以及RNAi在作物病害防控中的应用——HIGS、SIGS和MIGS。
01
RNAi在沉默基因中的应用
VIGS
病毒诱导的基因沉默(Virus-induced gene silencing,VIGS)是一种不依赖转基因技术的基因功能降低研究方法,其综合植物病毒的非转基因系统性侵染、植物的免疫应答及细胞RNAi沉默机制于一体,可以简易、快速且高效地沉默靶基因,属于转录后基因沉默。相比于依赖遗传转化的基因功能缺失研究方法,VIGS技术具有不需要遗传转化、实验周期短、研究成本低及应用植物范围广等特征,被越来越多地应用于不同作物的基因功能研究中。
VIGS的技术原理
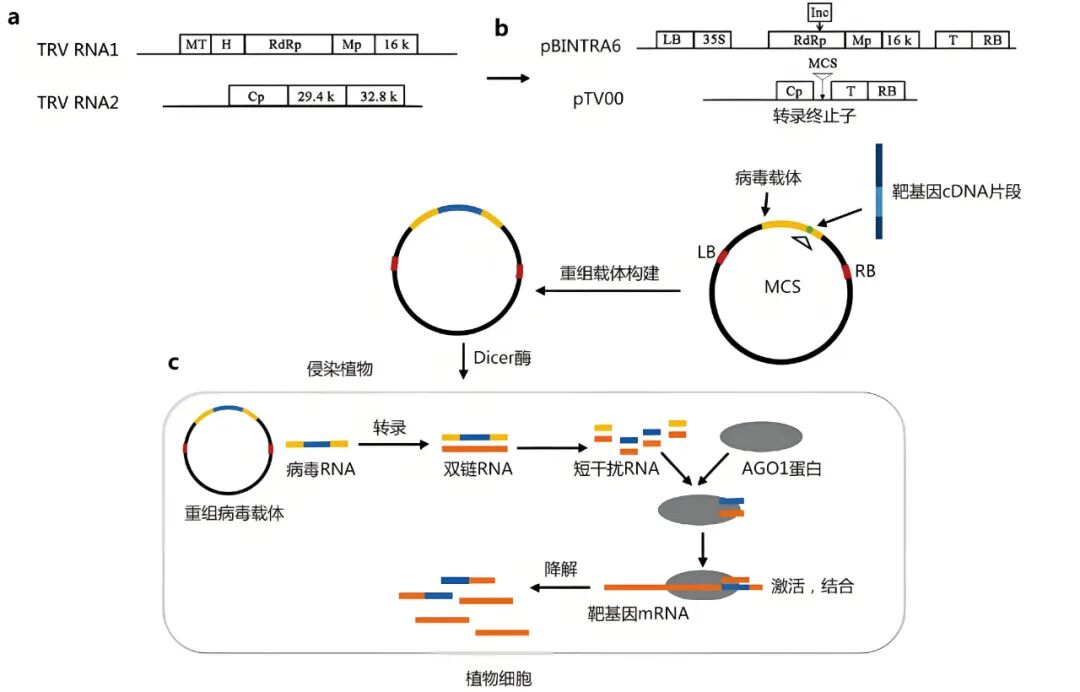
图1 VIGS原理(郝梦媛等, 2022)。(a)野生型TRV RNA1和TRV RNA2基因组结构;(b)人工改造后的pBINTRA6和pTV00T-DNA结构;(c)植物细胞内的病毒免疫机制过程。
病毒沉默载体的发展
合适的病毒载体是影响VIGS技术应用的关键因素之一。对植物病毒序列的侵染性克隆,对病毒基因功能、侵染机理、病毒-植物互作的研究以及对病毒载体的改造都极大地推进了VIGS技术的发展。虽然现有的VIGS仍以RNA病毒载体为主,但已有多个DNA病毒及卫星病毒被成功开发成VIGS载体,它们各自具有不同特点以及应用范围,这里不具体展开,感兴趣的小伙伴可以自己去查阅相关资料噢。
VIGS体系中,应用的RNA病毒载体绝大多是正义单链RNA病毒(+ssRNA)(病毒≠毒物!中有关于病毒的相关介绍,大家可自行查阅),像马铃薯X病毒(Potato virus X,PVX),豌豆早枯病毒(Peaearly browning virus,PEBV),黄瓜花叶病毒(Cucumber mosaic virus,CMV),烟草花叶病毒(Tobacco mosaic virus,TMV),烟草脆裂病毒(Tobacco rattle virus X,TRV),雀麦草花叶病毒(Brome mosaicvirus,BMV),大麦条纹花叶病毒(Barley stripe mosaic virus,BSMV)等。其中,最早被开发利用的是PVX和TMV,但这两种病毒对宿主的致病症状较重,基因沉默的时间短、效率低,且对顶端分生组织无效(Arunima Purkayastha and Indranil Dasgupta, 2009; Dominique Robertson, 2004; Cakir et al., 2010; Holzberg et al., 2002; Pacak et al., 2010; Ruiz et al., 1998)。
TRV介导的VIGS是目前应用最广泛的VIGS系统,具有寄主范围广、沉默效率高、持续时间长、病毒症状轻和可感染分生组织等优点(张景霞等, 2015)。TRV是一种土传的杆状RNA病毒,其基因组由2条RNA链——RNA1和RNA2组成(图1),其中,RNA1编码RNA聚合酶、运动蛋白以及其他蛋白质,RNA2主要编码病毒外壳蛋白和介导线虫传播的29.4kD和32.8kD蛋白(Liu et al., 2012)。Ratcliff等在2001年构建了基于TRV病毒的双元载体pBINTRA6(TRV1)和pTV00(TRV2),将RNA2序列中介导线虫传播的29.4kD和32.8kD蛋白编码基因替换为1个多克隆位点(Multiple cloning site,MCS),用于目的基因片段的插入(图1B)。通过该VIGS系统,作者在本氏烟草中成功沉默了外源GFP及内源PDS基因(Ratcliff et al., 2001)。
VIGS体系的整体流程
在对功能基因进行研究时,VIGS技术的基本操作过程是一致的。首先需要准确找到目标基因,选择最佳长度的基因片段;再选择合适的病毒,并构建重组病毒沉默载体;然后将重组载体导入到宿主;沉默处理后在特定条件下培养宿主植物;最后对沉默表型和基因功能进行鉴定。
这里特别强调一点,将重组载体导入宿主需根据不同的载体、不同的要求选择最合适的方法。例如,当用TRV载体浸染烟草和番茄时多采用真空渗透和高压喷射法,但若只想在其局部浸染且取得较好的效果应采用注射浸润法(Fu et al., 2005)。目前根据已经报道的文章,可以总结出三大类将重组载体导入宿主的方法:摩擦接种法、农杆菌介导转化法和微粒轰击法。
文献案例
具体的文献案例可参见“没有转化体系的物种,如何研究其基因功能?(三)”,这里就不再列举新的案例了。
02
RNAi在作物病害防控中的应用
大量研究证实,RNAi途径在植物生长发育各阶段以及响应外界胁迫过程中都发挥着非常重要的作用(Yu et al., 2017;Chang et al., 2020;Zhao-Hui Xie, 2010)。植物进化出多种方式保护其自身免受病原菌侵染,其中对病原相关分子诱导的免疫(Pathogen-associated molecular pattern (PAMP)-triggered immunity,PTI)和效应子诱导的免疫(Effector-triggered immunity,ETI)两个相互关联的免疫反应已经有了深入研究(Wang et al., 2022)。植物利用细胞膜表面模式识别受体(Pattern-recognition receptor,PPR)识别病原菌保守的PAMP分子,触发一系列的抗性级联反应,即PTI;为了抑制植物PTI反应,病原菌释放效应子(Effector)蛋白进入植物细胞内,而植物细胞内受体蛋白NLR(Nucleotide-binding/leucine-rich-repeat receptor)能够识别效应子诱导ETI反应(Wang et al., 2022)。
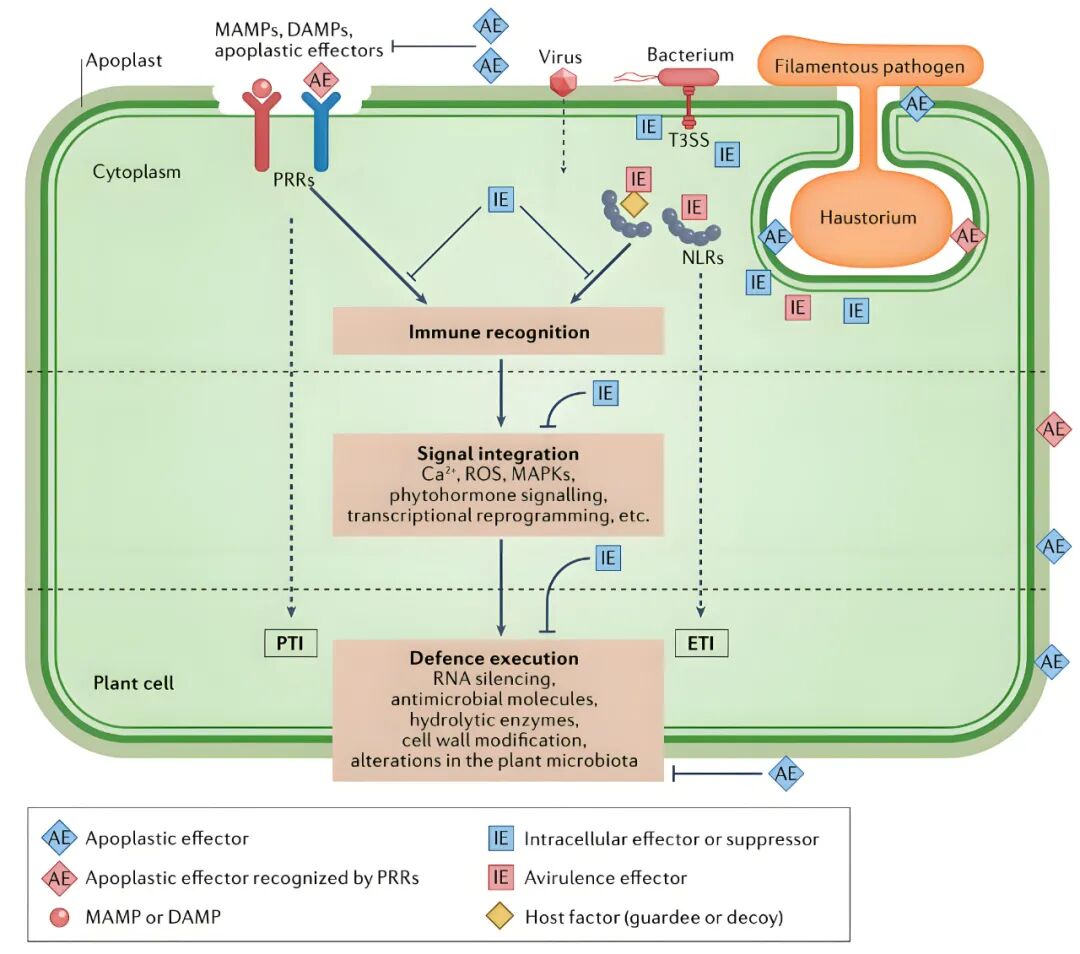
图2 植物先天免疫的逐步激活(Wang et al., 2022)。
越来越多的研究表明,除了这种由蛋白介导的植物免疫反应外,RNA也能够在植物细胞内或者进入病原细胞通过多种途径参与植物-病原互作。例如,植物小RNA不仅能够通过调控内源基因影响植物对病原菌的抗性,还能够进入病原菌细胞靶向病原基因抑制致病性。
基于在植物-病原互作的重要作用,RNAi机制在作物病害防控领域具有广阔的应用前景。研究人员已经在作物抗病育种、生物农药等领域开发出多种病害防控技术,主要包括:宿主诱导的基因沉默技术(Host-induced gene silencing,HIGS),喷施诱导的基因沉默(Spray-induced gene silencing,SIGS)以及最新报道的微生物诱导的基因沉默(Microbe-induced gene silencing,MIGS)技术。
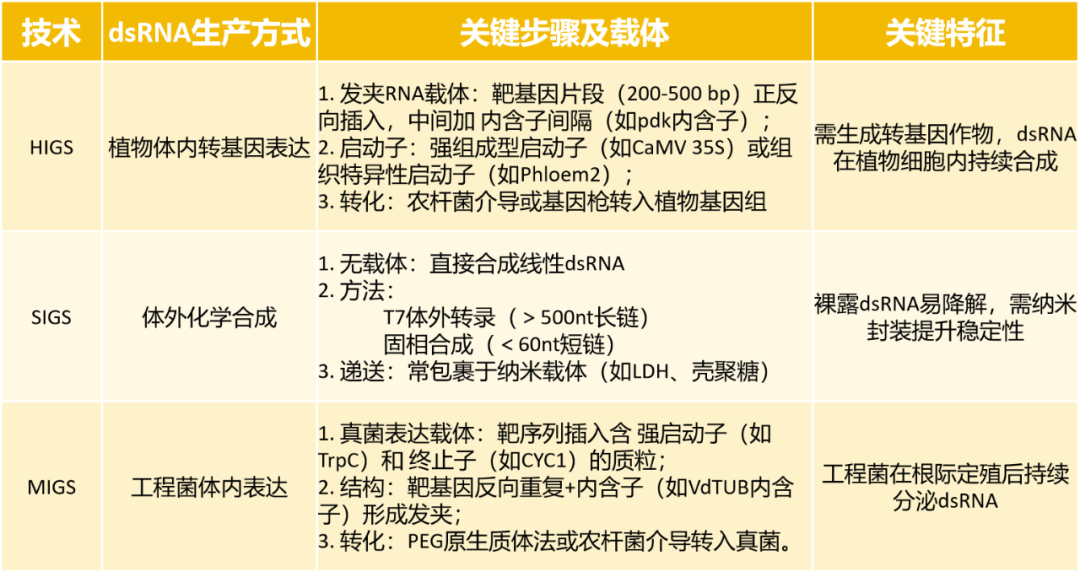
HIGS
Nowara等发现植物表达靶向大麦白粉病菌葡聚糖转移酶(GTF1/GTF2)效应子(Avra10)的RNA干扰分子,能引起侵染大麦的白粉病菌吸器减少、菌丝生长受到抑制,从而提高大麦的白粉病抗性,据此首次提出了宿主诱导的基因沉默(HIGS)的概念(Nowara et al., 2010)。
HIGS技术
HIGS技术是VIGS技术的发展。HIGS通常以病原菌或害虫生长发育、致病过程中的关键基因为靶点,在寄主植物中表达与靶基因序列互补的RNA干扰分子,经植物细胞Dicer核酸酶加工形成19~25nt的siRNA分子,病原菌在侵染植物过程中摄入这些siRNA,从而干扰病原菌靶基因的翻译和转录,影响病原菌生长发育,延缓病原菌扩展,降低病害,使植物呈现抗病表型。
HIGS机制探讨与注意事项
(1)寄主植物与病原菌/害虫的RNAi机制需兼容,比如siRNA长度、AGO蛋白偏好性等会影响RISC复合体的功能,从而影响防治效果。
(2)并非所有的病原菌/害虫都能有效地摄取长链和/或小片段的双链RNA(Qiao et al., 2021)。在影响HIGS效果的诸多因素中,对RNAi触发分子(长的未加工dsRNA与短的植物Dicer酶处理的siRNA)的摄取可能是最大的影响因素。
这一观点可以通过比较不同生活方式的害虫(生物性寄生)或病原菌(坏死型真菌)以及不同取食行为(咀嚼型昆虫与吸汁型昆虫)中HIGS介导的病虫害控制程度来进行探讨:
专性寄生真菌(如导致白粉病的真菌):通过吸器摄取宿主细胞间营养,主要依赖siRNA的传递。
坏死营养型真菌(如镰刀菌):通过溶解植物细胞边界主动摄取dsRNA。
咀嚼型昆虫(如玉米根虫):可直接摄取dsRNA,主要是叶绿体表达的dsRNA,可绕过植物Dicer酶的加工。
吸汁型昆虫(如蚜虫):仅能从植物韧皮部汁液中摄取siRNA,无法摄取完整的dsRNA(植物内源Dicer酶已将dsRNA加工成siRNA)(图3)。
HIGS在控制吸汁型昆虫(特别是蚜虫)引起的疾病方面的效果明显低于控制其他HIGS目标昆虫引起的疾病的效果,其控制效率低于40%。蚜虫需要韧皮部汁液来获取营养,因此,HIGS触发机制主要依赖于siRNA的摄取(Biedenkopf et al., 2020)。但蚜虫可能对某些siRNA缺乏响应。针对这种情况,一种规避植物Dicer酶介导的siRNA生成的策略可能是使用特异性于韧皮部的启动子,以确保在筛管细胞(韧皮部的组成部分)中表达和形成dsRNA,从而提高HIGS对蚜虫的防控效果。
HIGS的RNA形式选择和启动子设计需基于对目标生物行为(摄食方式)+分子互作机制(RNA摄取偏好)的双重考量。组织特异性优化本质是调控“何时、何地、以何种形式递送RNA”,从而突破生物屏障限制,是提升HIGS效率的核心策略。
(3)dsRNA摄取及其转化为目标生物体中高度有效的siRNA的过程可能会增强靶基因的沉默效果。
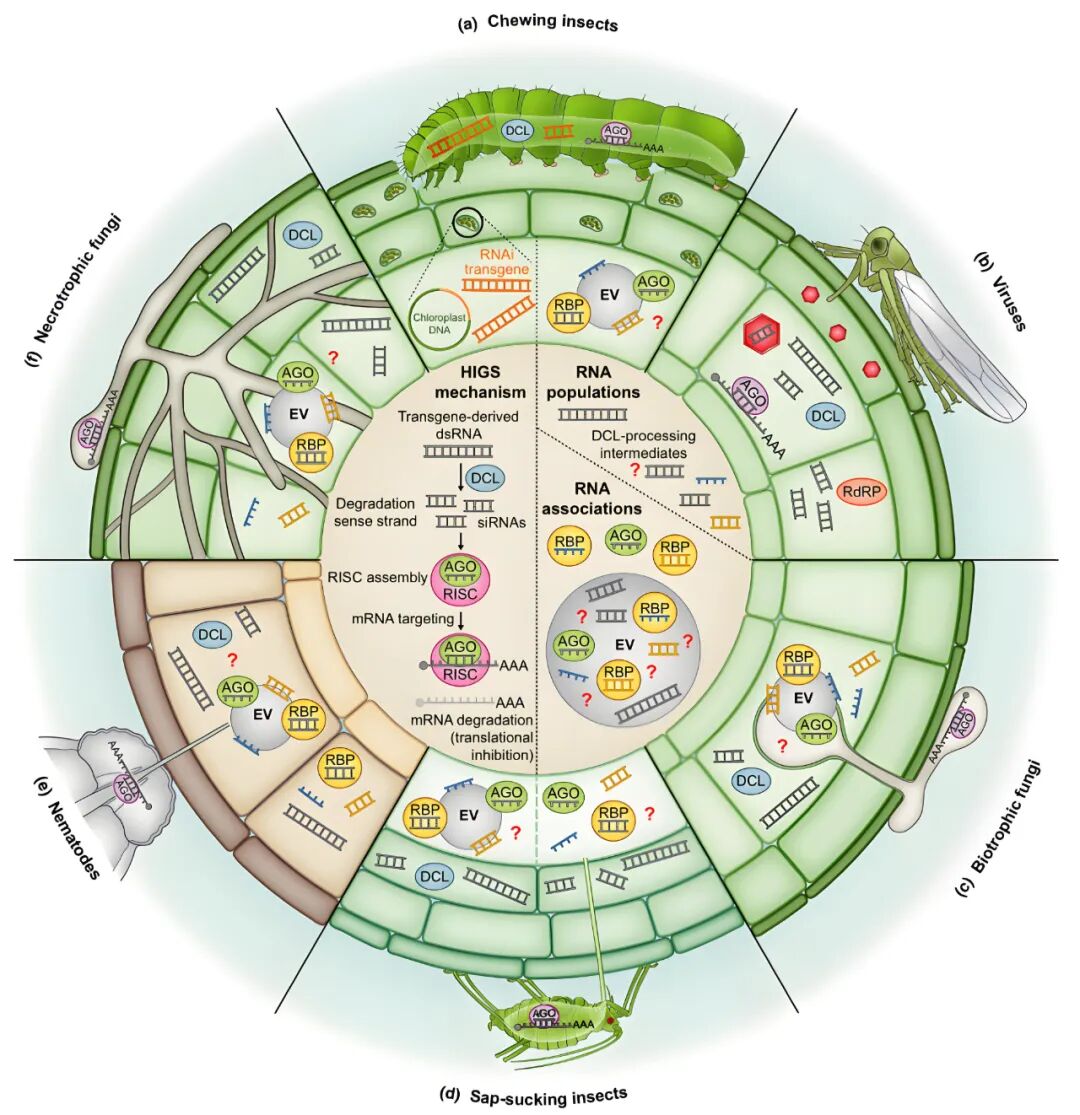
图3 不同病原菌/害虫中多样化的HIGS机制(Aline Koch and Michael Wassenegger, 2021)。
不适合进行HIGS的情况
(1)原核生物:细菌和植原体缺乏RNAi核心机制。
(2)特定真核生物:如酿酒酵母和玉米黑粉菌因进化丢失了关键的RNAi基因,例如AGO基因。
注:存在RNAi机制也并不能保证HIGS技术应用成功,可能的原因包括:a、靶标基因沉默后不足以致死病原菌/害虫;b、病原菌/害虫摄取RNA能力不足(如蚜虫摄入siRNA效率低);c、RNA设计缺陷或抗性机制(如靶标基因突变或外泌体降解)。
文献案例
2022年3月,中国农业科学院植物保护研究所作物线虫和细菌病害监测和防控创新团队在Plant Biotechnology Journal杂志上发表了一篇题为“Host-induced silencing of a nematode chitin synthase gene enhanced resistance of soybeans to both pathogenic Heterodera glycines and Fusarium oxysporum”的研究论文,该研究创制了寄主诱导沉默大豆胞囊线虫几丁质合成酶基因(SCN-CHS)的转基因大豆遗传材料,表明SCN-CHS HIGS转基因大豆能提高SCN(大豆胞囊线虫)抗性。
线虫和真菌含有几丁质合成酶,而植物和脊椎动物没有,这为设计新型杀线虫剂和杀菌剂以及培育新的抗性品种提供了一个新的靶标。基于HIGS是一种有效沉默病原线虫靶标基因的方法,该文克隆了一个大豆胞囊线虫几丁质合成酶基因(SCN-CHS),全长3984bp,含1个催化结构域(Chs)和7个跨膜结构域(TM),该基因主要在线虫卵里高表达,选取催化结构域的一段420bp序列构建了SCN-CHS的RNAi质粒,经农杆菌转化大豆Jack品种,获得3株纯合SCN-CHS HIGS转基因大豆(‘48-7-5’,‘55-8-24’和 ‘57-9-2’)。接种SCN后,上述HIGS转基因大豆根胞囊中卵的SCN-CHS表达量显著降低,表明SCN-CHS已被沉默。SCN-CHS HIGS转基因大豆种子大小和种皮颜色与野生型Jack相比没有差异。T2代HIGS转基因植株(48-7-5(T2),55-8-24(T2)和57-9-2(T2))接种SCN4号生理小种后,相对于野生型Jack,根中各个龄期线虫的发育延迟,每株胞囊数、胞囊大小和每个胞囊所含的卵量均显著降低/变小。这些结果表明SCN-CHS HIGS显著抑制了SCN在大豆根里的表达,提高了大豆的SCN抗性。
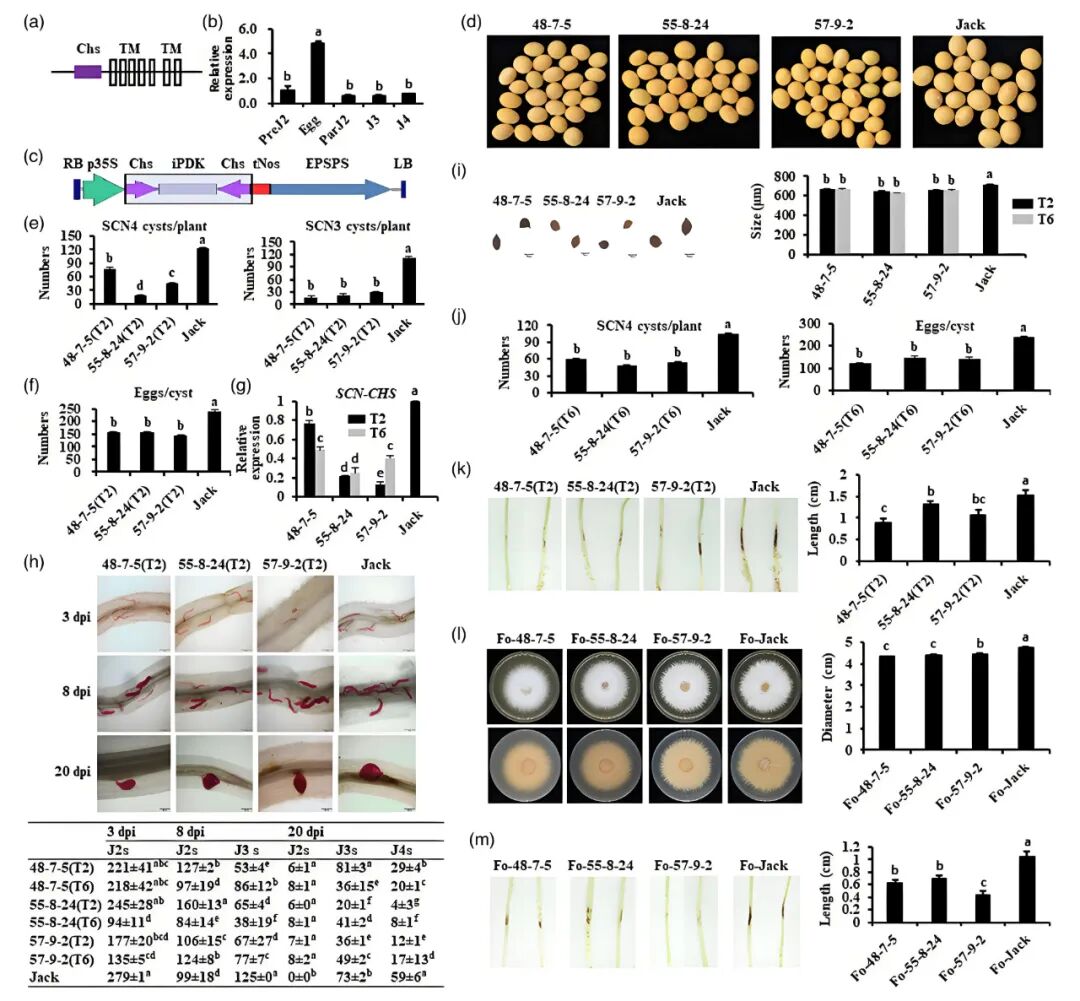
图4 通过寄主诱导沉默大豆胞囊线虫几丁质合成酶基因SCN-CHS来培育对大豆胞囊线虫和尖孢镰刀菌具有增强型广谱持久抗性的大豆品种(Kong et al., 2022)。
SIGS
SIGS的起源可以追溯到大约二十多年前,当时人们观察到将线虫Caenorhabditis elegans浸泡在dsRNA溶液中或通过向其喂食表达dsRNA的细菌,就能够有效地诱导沉默线虫靶基因的表达(Timmons and Fire, 1998;Timmons et al., 2001),这一现象后来被称为“环境RNAi”(Whangbo and Hunter, 2008)。然而,直到2016年才证明向植物喷洒dsRNA能够使植物对真菌病原体Botrytis cinerea和Fusarium graminearum产生抗性,从而产生了SIGS这一术语(Koch et al., 2016; Wang et al., 2016)。
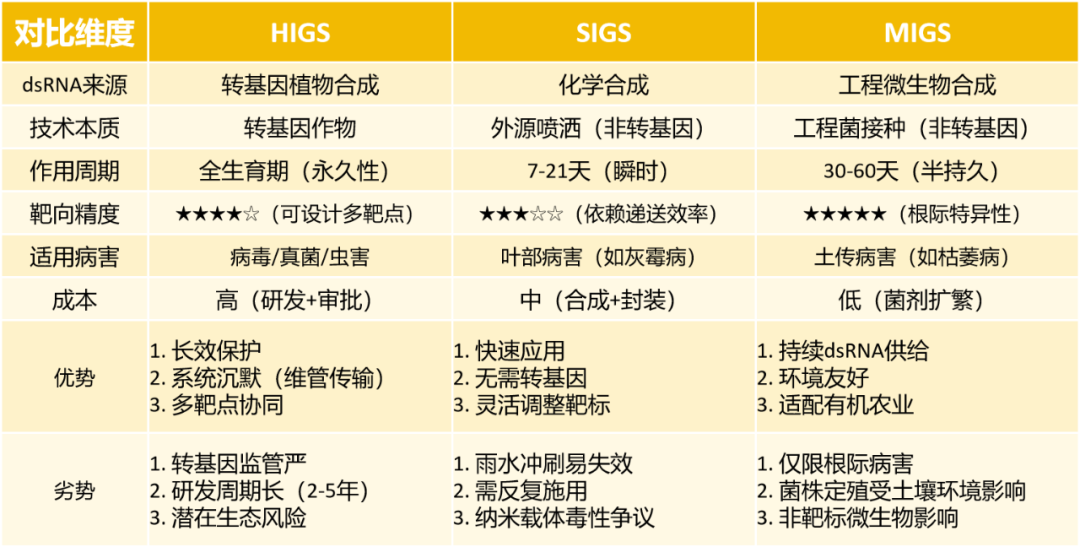
喷施诱导的基因沉默(SIGS)能够有效地控制真菌的繁殖,并减少多种植物病原真菌的疾病(Song et al., 2018)。由于其控制的特异性以及双链RNA在环境中的短存留时间,从而被认为是一种安全、环保的杀菌剂替代品(Bachman et al., 2020; Qiao et al., 2021; Bocos‐Asenjo et al., 2022; Niño‐Sánchez et al., 2022; Spada et al., 2023)。此外,SIGS比HIGS更方便、更快、更便宜且更容易开发,因为它不需要对植物宿主进行改造,因此不受转基因法规的限制(Herman et al., 2021; Rank and Koch, 2021)。
SIGS技术原理
SIGS是指将针对与病原菌相关的基因的外源dsRNA施加到作物上(Koch et al., 2016;Wang et al., 2016)。一旦dsRNA被真菌或植物细胞吸收,它们就会被Dicer酶切割成siRNA。在植物细胞中加工产生的siRNA会转移到真菌细胞中。然后,siRNA与真菌细胞质中的AGO蛋白结合,形成RNA诱导沉默复合体(RISC)。最后,RISC与互补的mRNA目标结合并将其降解,从而减缓病害的进展。
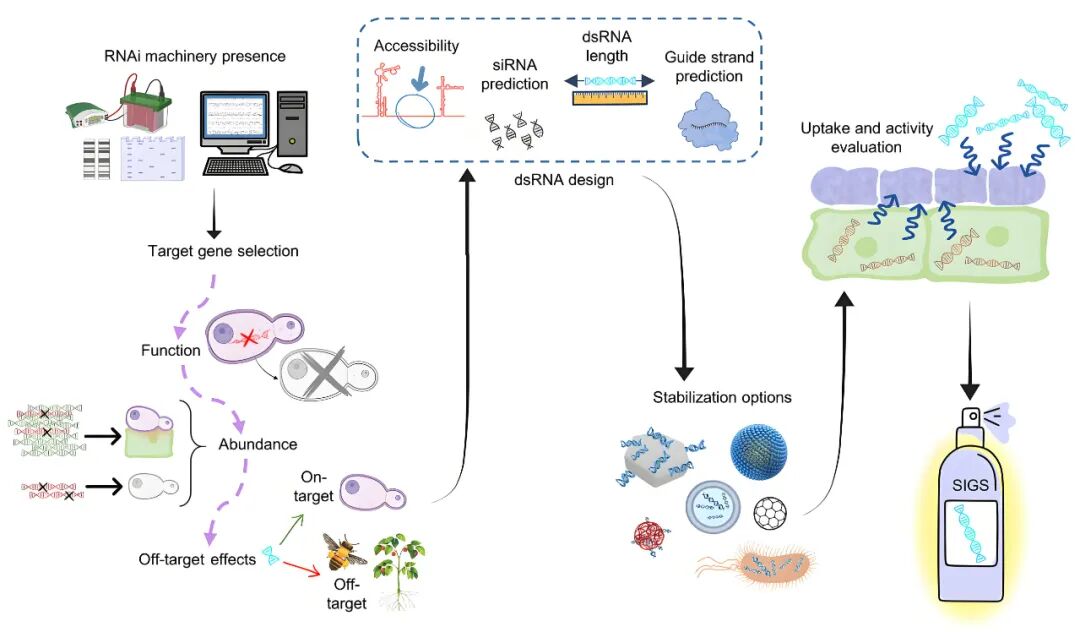
图5 SIGS技术的相关步骤和注意事项(Mosquera et al., 2025)。
SIGS的注意事项
(1)必须确认目标真菌具有完整的RNAi核心组件;
(2)优先靶向真菌的必需基因或关键致病因子,非目标生物(尤其是有益菌或作物本身)中存在高同源性的高度保守基因应避免靶向;
(3)dsRNA长度优先选择150-550bp的区间,这是文献中最常见且有效的长度范围,利用生物信息学工具预测mRNA的二级结构,选择开放、无复杂结构的区域设计dsRNA;
(4)裸露的dsRNA在田间极易降解(Bachman et al., 2020; Qiao et al., 2021),因此通过纳米封装技术(如壳聚糖、脂质体、层状双氢氧化物LDH)可显著延长dsRNA的持效期,从数天提升至数周。
不适合进行SIGS的情况
当出现以下情况时,应避免或谨慎采用SIGS技术,因其成功率极低或可能产生不良后果。

文献案例
白粉病菌(Powdery mildew,PM)是广泛的专性生物营养病原体,可侵染多种重要农业作物,包括大麦、小麦、葫芦、葡萄和玫瑰等。Erysiphe necator是葡萄白粉病的病原菌,对葡萄的产量和品质造成严重的影响。在葡萄的整个生长季节主要使用硫磺和合成杀真菌剂的组合来控制PM真菌侵染。然而,由于PM对合成杀真菌剂的耐药性日益增强,而且其引起的相关人类健康和环境问题也越来越多,因此,亟需开发一种安全的杀菌方法。
2023年6月,美国加州大学伯克利分校植物与微生物生物学系Mary C. Wildermuth团队在Molecular Plant Pathology杂志上发表了一篇题为“Spray-induced gene silencing to identify powdery mildew gene targets and processes for powdery mildew control”的研究论文,在本研究中,针对白粉病菌开发并优化了SIGS方法,该方法基于戈洛文氏菌-拟南芥病理系统中的唑类杀菌剂靶标细胞色素P450 51(CYP51)为作用靶点进行开发。分别采用整株和离体叶片进行了试验以评估SIGS对拟南芥上Gor(一种白粉病菌Golovinomyces orontii MGH1)生长和无性繁殖的影响,设计并测试了两个21bp的靶向GorCYP51的siRNA:siRNA-1和siRNA-2,以及两个长dsRNA-1(199bp)和dsRNA-2(228bp)。实验过程中观察到SIGS针对CYP51的基因沉默减少了Gor的孢子产生和菌丝长度。
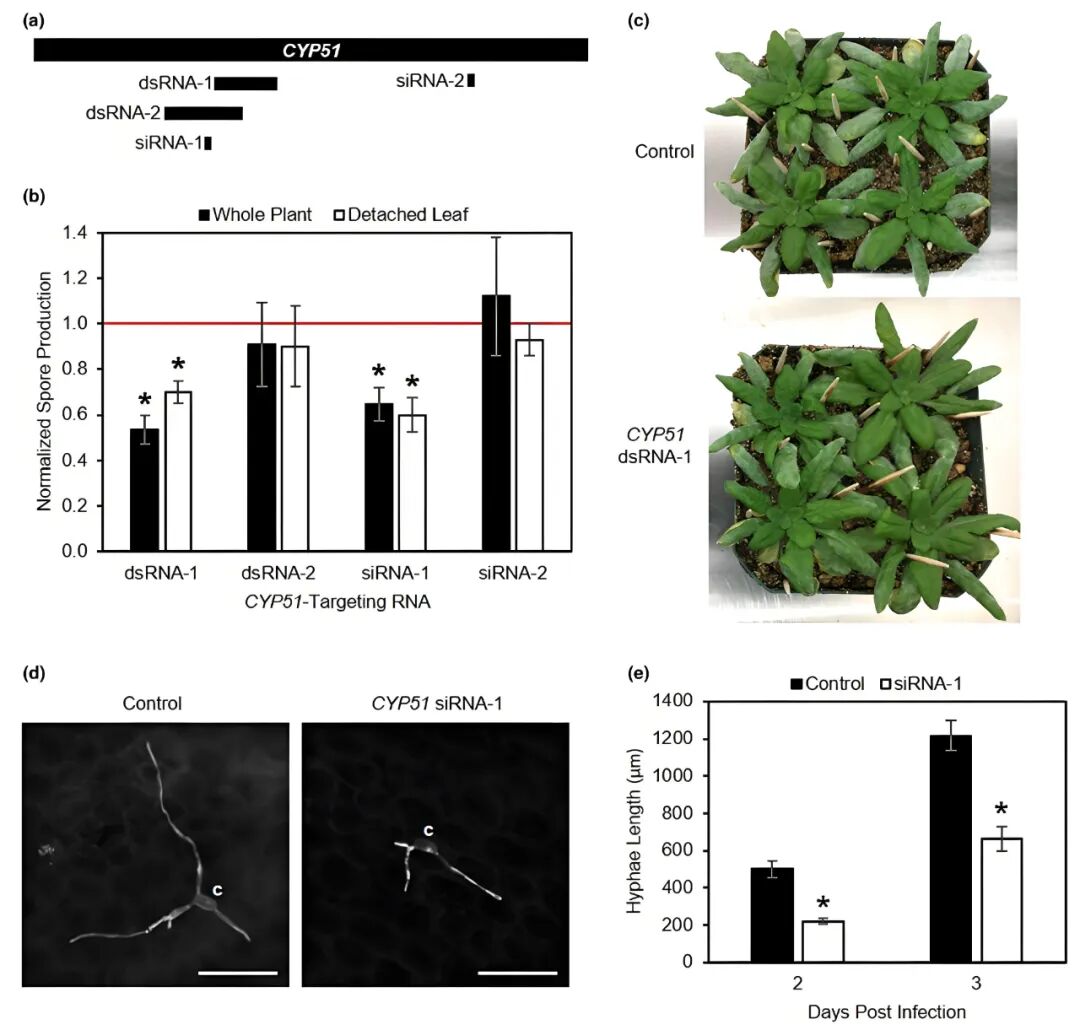
图6 靶向CYP51的SIGS可显著减少孢子产生量并抑制菌丝生长(McRae et al., 2023)。
MIGS
随着微生物组学研究的不断发展,越来越多的证据表明宿主与微生物以及微生物与微生物之间核酸(包括RNA和DNA)交换有助于植物和微生物适应微生态环境(Jian-Hua Zhao and Hui-Shan Guo, 2019),例如,根际微生物在植物吸收营养、响应生物和非生物胁迫的过程中都发挥了重要作用。长期以来,开发有益微生物都是作物病害防控的有效手段。基于不同物种间广泛存在的RNA双向传递现象,研究人员提出利用有益微生物表达靶向病原真菌的dsRNA,从而抑制病原真菌致病性的作物病害防控策略,即MIGS技术(Zhao et al., 2021;Wen et al., 2023)。
MIGS技术原理
将靶向病原真菌关键基因的dsRNA发夹结构转入根际益生菌构建工程菌,工程菌在根际定殖后分泌胞外囊泡(EVs),包裹dsRNA,通过土壤菌丝接触被病原菌吞噬。病原菌内Dicer酶切割dsRNA生成21~24nt siRNA,siRNA结合AGO蛋白形成RISC复合体,降解致病相关基因的表达。
MIGS的注意事项
(1)工程菌株筛选与优化

(2)dsRNA递送系统优化
使用混合菌群策略:结合芽孢杆菌(分泌几丁质酶),增强对病原菌的EV递送效率。
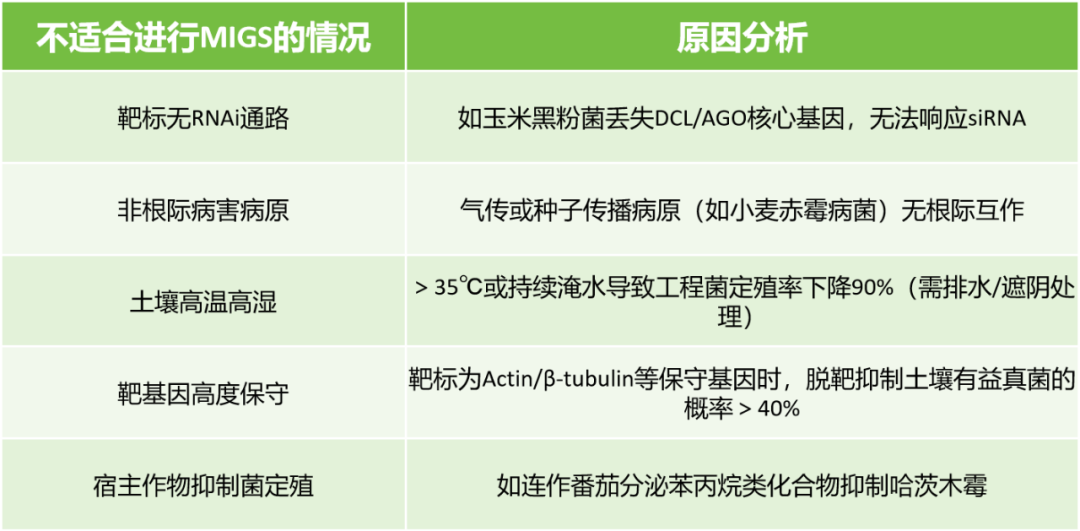
不适合进行MIGS的情况
当出现以下情况时,应避免或谨慎采用MIGS技术,因其成功率极低或可能产生不良后果。
文献案例
玉米茎腐病由一种或多种病原菌复合侵染引起,已经成为最具毁灭性的玉米病害之一。禾谷镰刀菌(Fusarium graminearum)是玉米茎腐病的致病优势菌,会对玉米及相关产业造成巨大的经济损失。
2025年4月,中国科学院微生物研究所郭惠珊团队在aBIOTECH杂志上发表了一篇题为“Microbe-induced gene silencing of fungal gene confers efficient resistance against Fusarium graminearum in maize”的研究论文,利用MIGS技术构建了玉米茎腐病的防控体系。该技术的核心是以哈茨木霉为生物底盘,通过其产生的dsRNA靶向沉默土传病原真菌禾谷镰刀菌的PMT2基因(该基因编码O-甘露糖基转移酶)。
作物病害防控实验表明,与未接种的幼苗相比,接种F. graminearum(Fg)的玉米幼苗株高、鲜重以及根长均受到抑制,根部出现大量褐色病斑;在接种体系中加入底盘菌株T. harzianum(Th)(Fg+Th),玉米幼苗根部褐色病斑减少,但株高、鲜重和根长与单独接种F. graminearum的幼苗相比并没有明显变化,表明野生型T. harzianum能够为玉米提供一定程度的保护作用;在接种体系中加入工程菌株Th-FgPmt2i(Fg+Th-FgPmt2i),玉米幼苗株高、鲜重和根长显著好于单独接种F. graminearum的幼苗,根部只观察到少量浅褐色病斑。另外,同时接种Fg+Th-FgPmt2i的玉米根中病原菌生物量显著低于单独接种Fg与Fg+Th的玉米(图7)。
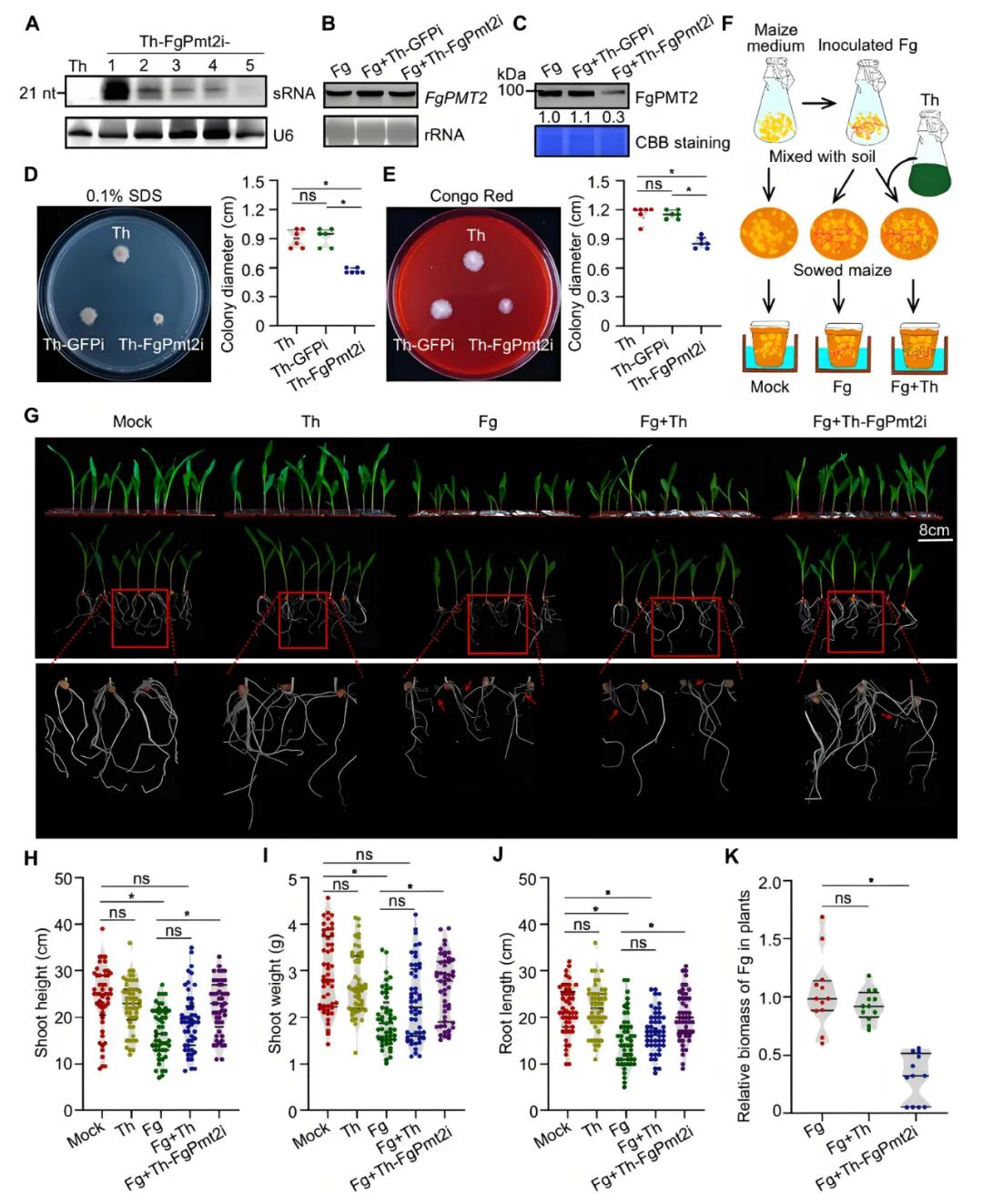
图7 通过沉默FgPMT2基因的MIGS技术可实现玉米对禾谷镰刀菌的防治(Chen et al., 2025)。
以上结果证实,与底盘菌株相比工程菌株能够为玉米提供更强的保护作用,进一步说明MIGS技术是一种通用型作物真菌病害防控技术。
本文主要为大家介绍了VIGS、HIGS、SIGS以及MIGS,这些技术的核心原理都是基于保守的RNAi机制。其中VIGS最早证明了在植物体内通过病毒载体可以高效地诱导基因沉默,主要用于基因功能研究。HIGS是第一个将RNAi应用于抗病的概念验证,它证明了植物体内产生的dsRNA可以被病原菌摄取并沉默其基因,从而实现抗病,但由于其转基因属性,应用受限。SIGS是为了克服HIGS的转基因限制而提出的,它像使用传统农药一样,直接喷洒dsRNA,实现了“非转基因”的RNAi防控,灵活性极高,是当前的研究热点。MIGS可以看作是SIGS的一种升级和补充,它解决了SIGS中dsRNA易降解、成本高的问题,利用微生物作为“活体工厂”在植物周围原位、持续地生产dsRNA,有望实现更持久、更经济的防控效果。对于HIGS、SIGS以及MIGS技术小远还进行了如下总结:
References:
郝梦媛,杭琦,师恭曜.VIGS基因沉默技术在作物基因功能研究中的应用与展望[J].中国农业科技导报,2022,24(01):1-13.
张景霞,王芙蓉,高阳,等.VIGS技术及其在棉花功能基因组研究中的应用进展[J].棉花学报,2015,27(5):469-473.
左刚,毛建平.转录水平siRNA介导的基因沉默[J].中国生物工程杂志,2005,25(12):78-81.
Bachman P, Fischer J, Song Z, et al. Environmental fate and dissipation of applied dsRNA in soil, aquatic systems, and plants[J]. Frontiers in Plant Science, 2020, 11: 21.
Biedenkopf D, Will T, Knauer T, et al. Systemic spreading of exogenous applied RNA biopesticides in the crop plant Hordeum vulgare[J]. ExRNA, 2020, 2(1): 12.
Bocos-Asenjo I T, Niño-Sánchez J, Ginésy M, et al. New insights on the integrated management of plant diseases by RNA strategies: Mycoviruses and RNA interference[J]. International journal of molecular sciences, 2022, 23(16): 9236.
Cakir C, Gillespie M E, Scofield S R. Rapid determination of gene function by virus‐induced gene silencing in wheat and barley[J]. Crop science, 2010, 50: S-77-S-84.
Chang Y N, Zhu C, Jiang J, et al. Epigenetic regulation in plant abiotic stress responses[J]. Journal of integrative plant biology, 2020, 62(5): 563-580.
Chen T, Tian W, Shuai Q, et al. Microbe-induced gene silencing of fungal gene confers efficient resistance against Fusarium graminearum in maize[J]. aBIOTECH, 2025: 1-6.
Fu D Q, Zhu B Z, Zhu H L, et al. Virus‐induced gene silencing in tomato fruit[J]. The Plant Journal, 2005, 43(2): 299-308.
Herman R A, Storer N P, Anderson J A, et al. Transparency in risk-disproportionate regulation of modern crop-breeding techniques[J]. GM Crops & Food, 2021, 12(1): 376-381.
Holzberg S, Brosio P, Gross C, et al. Barley stripe mosaic virus‐induced gene silencing in a monocot plant[J]. The Plant Journal, 2002, 30(3): 315-327.
Koch A, Biedenkopf D, Furch A, et al. An RNAi-based control of Fusarium graminearum infections through spraying of long dsRNAs involves a plant passage and is controlled by the fungal silencing machinery[J]. PLoS pathogens, 2016, 12(10): e1005901.
Koch A, Wassenegger M. Host‐induced gene silencing–mechanisms and applications[J]. New Phytologist, 2021, 231(1): 54-59.
Kong L, Shi X, Chen D, et al. Host‐induced silencing of a nematode chitin synthase gene enhances resistance of soybeans to both pathogenic Heterodera glycines and Fusarium oxysporum[J]. Plant Biotechnology Journal, 2022, 20(5): 809.
Liu H, Fu D, Zhu B, et al. Virus‐induced gene silencing in eggplant (Solanum melongena)[J]. Journal of integrative plant biology, 2012, 54(6): 422-429.
Llave C. Virus-derived small interfering RNAs at the core of plant–virus interactions[J]. Trends in plant science, 2010, 15(12): 701-707.
McRae A G, Taneja J, Yee K, et al. Spray‐induced gene silencing to identify powdery mildew gene targets and processes for powdery mildew control[J]. Molecular Plant Pathology, 2023, 24(9): 1168-1183.
Mosquera S, Ginésy M, Bocos‐Asenjo I T, et al. Spray‐induced gene silencing to control plant pathogenic fungi: A step‐by‐step guide[J]. Journal of Integrative Plant Biology, 2025, 67(3): 801-825.
Niño‐Sánchez J, Sambasivam P T, Sawyer A, et al. BioClay™ prolongs RNA interference‐mediated crop protection against Botrytis cinerea[J]. Journal of Integrative Plant Biology, 2022, 64(11): 2187-2198.
Nowara D, Gay A, Lacomme C, et al. HIGS: host-induced gene silencing in the obligate biotrophic fungal pathogen Blumeria graminis[J]. The Plant Cell, 2010, 22(9): 3130-3141.
Pacak A, Strozycki P M, Barciszewska-Pacak M, et al. The brome mosaic virus-based recombination vector triggers a limited gene silencing response depending on the orientation of the inserted sequence[J]. Archives of virology, 2010, 155(2): 169-179.
Purkayastha A, Dasgupta I. Virus-induced gene silencing: a versatile tool for discovery of gene functions in plants[J]. Plant Physiology and Biochemistry, 2009, 47(11-12): 967-976.
Qiao L, Lan C, Capriotti L, et al. Spray‐induced gene silencing for disease control is dependent on the efficiency of pathogen RNA uptake[J]. Plant biotechnology journal, 2021, 19(9): 1756-1768.
Ratcliff F, Martin‐Hernandez A M, Baulcombe D C. Technical advance: tobacco rattle virus as a vector for analysis of gene function by silencing[J]. The Plant Journal, 2001, 25(2): 237-245.
Robertson D. VIGS vectors for gene silencing: many targets, many tools[J]. Annu. Rev. Plant Biol., 2004, 55(1): 495-519.
Ruiz M T, Voinnet O, Baulcombe D C. Initiation and maintenance of virus-induced gene silencing[J]. The Plant Cell, 1998, 10(6): 937-946.
Song X S, Gu K X, Duan X X, et al. Secondary amplification of siRNA machinery limits the application of spray‐induced gene silencing[J]. Molecular plant pathology, 2018, 19(12): 2543-2560.
Spada M, Pugliesi C, Fambrini M, et al. Knockdown of Bmp1 and Pls1 virulence genes by exogenous application of RNAi-inducing dsRNA in Botrytis cinerea[J]. International Journal of Molecular Sciences, 2023, 24(5): 4869.
Timmons L, Court D L, Fire A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans[J]. Gene, 2001, 263(1-2): 103-112.
Timmons L, Fire A. Specific interference by ingested dsRNA[J]. Nature, 1998, 395(6705): 854-854.
Wang M, Weiberg A, Lin F M, et al. Bidirectional cross-kingdom RNAi and fungal uptake of external RNAs confer plant protection[J]. Nature plants, 2016, 2(10): 1-10.
Wang Y, Pruitt R N, Nürnberger T, et al. Evasion of plant immunity by microbial pathogens[J]. Nature Reviews Microbiology, 2022, 20(8): 449-464.
Wen H G, Zhao J H, Zhang B S, et al. Microbe-induced gene silencing boosts crop protection against soil-borne fungal pathogens[J]. Nature Plants, 2023, 9(9): 1409-1418.
Whangbo J S, Hunter C P. Environmental RNA interference[J]. Trends in genetics, 2008, 24(6): 297-305.
Xie Z H. The roles of RNA silencing in plant biotic stress[J]. Yi chuan= Hereditas, 2010, 32(6): 561-570.
Yu Y, Jia T, Chen X. The ‘how’and ‘where’of plant micro RNA s[J]. New Phytologist, 2017, 216(4): 1002-1017.
Zhao J H, Guo H S. Trans-kingdom RNA interactions drive the evolutionary arms race between hosts and pathogens[J]. Current Opinion in Genetics & Development, 2019, 58: 62-69.
Zhao J H, Zhang T, Liu Q Y, et al. Trans-kingdom RNAs and their fates in recipient cells: advances, utilization, and perspectives[J]. Plant communications, 2021, 2(2).




















 426
426

 被折叠的 条评论
为什么被折叠?
被折叠的 条评论
为什么被折叠?








